一种无内毒素的海藻酸钠的制备方法与流程
本发明涉及医疗器械中医用材料及原材料,尤其是涉及一种无内毒素的海藻酸钠的制备方法。
背景技术:
1、海藻酸钠作为一种从海藻中提取出的天然高分子材料,具有很高的亲水性能和成胶性能,是制备医用敷料的理想材料。我国海藻酸钠产业产能高、市场占有率大,但产品纯度低,高纯度产品仍依赖进口。随着海洋来源生物医用材料相关医疗器械的研发及产业化发展,高纯度材料的市场需求量将越来越大。
2、用于体内植入环境的海藻酸钠材料,如介入治疗栓塞剂、组织隔离材料、深层皮肤修复、细胞移植载体等,材料自身的物化性质就必须要满足ⅲ类医疗器械标准的要求。由于海藻酸钠是提取自海洋生物的材料,本身残留的蛋白、无机盐以及内毒素等杂质很多,严重影响其生物相容性、制约其在临床的应用。在不改变多糖材料物化性能的前提下进行高度纯化技术的开发以及在材料纯化工艺放大过程中有效去除蛋白及内毒素,保证产品达标,都是开发海藻酸钠医用材料所面临的棘手难题。
3、作为原料的海藻酸钠内含有多种杂质,而且具有很高的黏度,所以在纯化方面难度很大,目前没有相关的工艺可以使用。此外,超纯度海藻酸钠制备需要无菌环境,而由于其自身特性,普通的高压、辐照等方式均不能使用,只能进行过程控制,所以耗时很长。
4、超纯度海藻酸钠具有三个突出的特性:一是生物安全性高,且在人体内没有降解酶,理论消融时间很长;二是容易控制,按照其分子量大小可以方便地控制其存在时长;三是遇到钙离子会形成凝胶的特性,应用前景广泛。
5、作为一种天然生物材料,不同来源(种属、地域等)、不同工艺制备的海藻酸其相对分子质量、m/g比例等并不相同,杂质(蛋白、核酸、细菌、热原等)、残留物也不尽相同。相应地,其力学性能和生物学功能也有很大差异。目前,尚无医用级原料生产平台,缺乏系统的原料来源可追溯性控制和工艺控制,产品质量不高、批次间差异大,难以满足临床研究和应用的需求。
6、有鉴于此,特提出本发明。
技术实现思路
1、本发明的目的在于提供一种无内毒素的海藻酸钠的制备方法,所述制备方法包括以下步骤:对海藻酸钠原料依次进行动态吸附、液相分离、超声层析、离子置换、化学降解、沉淀过滤、分子透析、干燥成型,得到无内毒素的海藻酸钠。本发明所述方法在原有的食品级海藻酸钠原料基础上,去除其含有的杂蛋白、无机盐以及内毒素等杂质,得到一种高纯度的无内毒素海藻酸钠材料。
2、为了实现本发明的上述目的,特采用以下技术方案:
3、第一方面,本发明提供一种无内毒素的海藻酸钠的制备方法,所述制备方法包括以下步骤:
4、对海藻酸钠原料依次进行动态吸附、液相分离、超声层析、离子置换、化学降解、沉淀过滤、分子透析、干燥成型,得到无内毒素的海藻酸钠。
5、在本发明中,所述制备方法在原有的食品级海藻酸钠原料基础上,去除其含有的杂蛋白、无机盐以及内毒素等杂质,得到一种高纯度的无内毒素海藻酸钠材料,纯化后的海藻酸钠,内素素含量明显下降,几乎为0,其灰分、蛋白质含量也都有所下降,黏度有所提升,对海藻酸钠的纯化有着明显的提升,产品安全性更高。因此,纯化后得到海藻酸钠的可以应用在医用材料、组织工程领域,开发高端医疗器械、生物制品。此外,本发明所述制备方法以过程控制为主,成本较低、产品性能可控,可实现工业化生产,具有较高的应用价值,有望带来海藻酸钠在医药领域的新突破和新应用。
6、优选地,所述动态吸附的具体步骤为:
7、将吸附材料置于海藻酸钠胶液中,进行震荡浸泡后,得到吸附海藻酸钠原料的吸附材料。
8、优选地,所述吸附材料选自活性炭、阳离子聚合物或聚砜中的任意一种或至少两种的组合,优选为活性炭和阳离子聚合物的组合。
9、优选地,所述阳离子聚合物选自聚二甲亚胺、聚(n-异丙基丙烯酰胺)或聚丙烯酰胺中的任意一种或至少两种的组合。
10、优选地,所述海藻酸钠原料为食品级海藻酸钠原料。
11、优选地,所述海藻酸钠胶液为1~5wt%(例如可以是1wt%、1.5wt%、2wt%、2.5wt%、3wt%、3.5wt%、4wt%、4.5wt%、5wt%等)的海藻酸钠水溶液。
12、优选地,所述吸附材料的添加量为所述海藻酸钠胶液质量的2~5wt%,例如可以是2wt%、2.5wt%、3wt%、3.5wt%、4wt%、4.5wt%、5wt%等。
13、优选地,所述震荡浸泡的温度为35~40℃,例如可以是35℃、36℃、37℃、38℃、39℃、40℃等,震荡浸泡的时间为12~24h,例如可以是12h、14h、16h、18h、20h、22h、24h等,震荡浸泡的频率为50~150rpm,例如可以是50rpm、60rpm、70rpm、80rpm、90rpm、100rpm、110rpm、120rpm、130rpm、140rpm、150rpm等。
14、优选地,所述液相分离的具体步骤为:
15、先采用表面活性剂溶液对已吸附海藻酸钠原料的吸附材料进行洗脱,得到洗脱液;再将洗脱液和萃取剂混合,进行萃取,收集含有海藻酸钠的水相。(用液相分离的方法萃取胶液中的内毒素)
16、优选地,所述表面活性剂选自非离子型表面活性剂和/或阴离子型表面活性剂。
17、优选地,所述非离子型表面活性剂选自triton x-114和/或吐温80。
18、优选地,所述阴离子型表面活性剂选自去氧胆酸钠和/或edta。
19、优选地,所述表面活性剂溶液为1~10wt%(例如可以是1wt%、2wt%、3wt%、4wt%、5wt%、6wt%、7wt%、8wt%、9wt%、10wt%等)的表面活性剂水溶液。
20、优选地,所述洗脱的流速为1~10ml/s,例如可以是1ml/s、2ml/s、3ml/s、4ml/s、5ml/s、6ml/s、7ml/s、8ml/s、9ml/s、10ml/s等,洗脱的时间为1~10h,例如可以是1h、2h、3h、4h、5h、6h、7h、8h、9h、10h等。
21、优选地,所述萃取剂为正丁醇。
22、优选地,所述洗脱液和萃取剂的体积比为1:(1~5),例如可以是1:1、1:1.5、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5、1:5等。
23、优选地,所述超声层析的具体步骤为:
24、将含有海藻酸钠的水相和高浓度盐溶液混合,进行超声处理后,进行第一次过滤,收集含有海藻酸钠的滤液。
25、其中,所述超声层析是利用海藻酸钠材料中的杂蛋白,其本身带有疏水性的载体与高盐浓度结合。通过超声洗脱,将疏水性不同的部分逐个地先后被洗脱而纯化。
26、优选地,所述高浓度盐溶液为5~20wt%(例如可以是5wt%、6wt%、7wt%、8wt%、9wt%、10wt%、11wt%、12wt%、13wt%、14wt%、15wt%、16wt%、17wt%、18wt%、19wt%、20wt%等)的nacl水溶液。
27、优选地,所述含有海藻酸钠的水相和高浓度盐溶液的体积比为1:(1~5),例如可以是1:1、1:1.5、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5、1:5等。
28、优选地,所述超声处理的功率为5~20w,例如可以是5w、6w、8w、10w、12w、14w、16w、18w、20w等,超声处理的时间为0.5~4h,例如可以是0.5h、0.6h、0.8h、1h、1.5h、2h、2.5h、3h、3.5h、4h等。
29、优选地,所述第一次过滤采用孔径为0.22~0.45μm的滤膜,例如可以是0.22μm、0.25μm、0.3μm、0.35μm、0.4μm、0.45μm等。
30、优选地,所述离子置换的具体步骤为:
31、将含有海藻酸钠的滤液通过喷丝孔挤入二价金属离子溶液中,得到海藻酸钠的凝胶束。
32、优选地,所述二价金属离子溶液为1~5wt%(例如可以是1wt%、1.5wt%、2wt%、2.5wt%、3wt%、3.5wt%、4wt%、4.5wt%、5wt%等)的氯化钙溶液。
33、优选地,所述喷丝孔的孔径≤1.6mm,例如可以是1.6mm、1.5mm、1.4mm、1.3mm、1.2mm、1.1mm、1.0mm、0.8mm、0.6mm、0.4mm、0.2mm、0.1mm等。
34、优选地,所述挤入的速度≥5ml/s,例如可以是5ml/s、4.5ml/s、4ml/s、4ml/s、3.5ml/s、3ml/s、2.5ml/s、2ml/s、1.5ml/s、1ml/s等。
35、优选地,所述化学降解的具体步骤为:
36、将海藻酸钠的凝胶束先在酸溶液中进行浸泡,取出后再于碱溶液中进行浸泡,得到经化学降解的海藻酸钠的凝胶束。
37、优选地,所述酸溶液为0.05~0.2m(例如可以是0.05m、0.06m、0.08m、0.1m、0.12m、0.14m、0.16m、0.18m、0.2m等)的盐酸水溶液。
38、优选地,在酸溶液中浸泡的时间为1~16h,例如可以是1h、2h、3h、4h、5h、6h、7h、8h、9h、10h、11h、12h、13h、14h、15h、16h等,优选为3~5h。
39、优选地,所述碱溶液为0.05~0.2m(例如可以是0.05m、0.06m、0.08m、0.1m、0.12m、0.14m、0.16m、0.18m、0.2m等)的氢氧化钠水溶液。
40、优选地,在碱溶液中浸泡的时间为1~16h,例如可以是1h、2h、3h、4h、5h、6h、7h、8h、9h、10h、11h、12h、13h、14h、15h、16h等,优选为10~14h。
41、优选地,所述沉淀过滤的具体步骤为:
42、将经化学降解的海藻酸钠的凝胶束浸泡于碳酸钠溶液中,待凝胶束完全溶解后,进行第二次过滤,收集滤液。
43、优选地,所述碳酸钠溶液为0.05~0.2wt%(例如可以是0.05wt%、0.06wt%、0.08wt%、0.1wt%、0.12wt%、0.14wt%、0.16wt%、0.18wt%、0.2wt%等)的碳酸钠水溶液。
44、优选地,所述溶解的温度为55~65℃,例如可以是55℃、56℃、57℃、58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃等,溶解的时间为1~3h,例如可以是1h、1.2h、1.4h、1.6h、1.8h、2h、2.2h、2.4h、2.6h、2.8h、3h等。
45、优选地,所述第二次过滤采用孔径为0.22~20μm的滤膜,例如可以是0.22μm、0.25μm、0.3μm、0.35μm、0.4μm、0.45μm、1μm、2μm、4μm、6μm、8μm、10μm、12μm、14μm、16μm、18μm、20μm等。
46、优选地,所述分子透析的具体步骤为:
47、采用透析膜对沉淀过滤后收集的滤液进行透析,得到透析液。
48、优选地,所述透析膜为截留相对分子质量≥3000d的透析膜。
49、优选地,透析应在水溶液环境中进行,第一遍透析采用电导率<3的纯化水配制的0.1m的盐酸溶液,12h后更换为电导率<3的纯化水,之后每过12h更换一次电导率<3的纯化水。
50、优选地,当透析后的水溶液电导率稳定保持在3以下时,透析结束。
51、优选地,所述水溶液的电导率<3,例如可以是0~3内的任意数值。
52、优选地,所述干燥成型的具体步骤为:
53、将透析液进行干燥,得到无内毒素的海藻酸钠。
54、优选地,所述干燥包括冷冻干燥或加热干燥,优选为冷冻干燥。
55、优选地,所述冷冻干燥的温度为-60~-40℃,例如可以是-60℃、-55℃、-50℃、-45℃、-40℃等,冷冻干燥的时间为24~48h,例如可以是24h、26h、28h、30h、32h、34h、36h、38h、40h、42h、44h、46h、48h等。
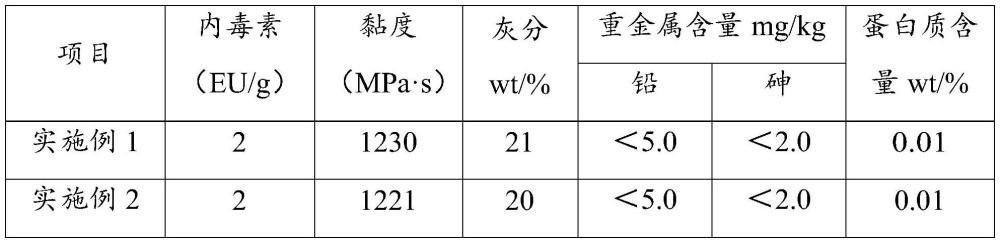
56、优选地,所述加热干燥的温度为60~105℃,例如可以是60℃、65℃、70℃、75℃、80℃、85℃、90℃、95℃、100℃、105℃等,加热干燥的时间为16~72h,例如可以是16h、24h、30h、36h、42h、48h、54h、60h、66h、72h等。
57、优选地,所述无内毒素的海藻酸钠为海绵状或膜状材料。
58、在本发明中,当选择冷冻干燥时,所述无内毒素的海藻酸钠为海绵状材料;而当选择加热干燥时,所述无内毒素的海藻酸钠为膜状材料。
59、优选地,所述干燥成型后还包括研磨的步骤。
60、优选地,所述研磨后得到颗粒状海藻酸钠。
61、优选地,所述颗粒状海藻酸钠的粒径为50~100目,例如可以是50目、60目、70目、80目、90目、100目等。
62、优选地,所述研磨的转速为60~120rpm,例如可以是60rpm、70rpm、80rpm、90rpm、100rpm、110rpm、120rpm等,研磨的时间为10~60mim,例如可以是10mim、20mim、30mim、40mim、50mim、60mim等。
63、相对于现有技术,本发明具有以下有益效果:
64、(1)本发明所述制备方法在原有的食品级海藻酸钠原料基础上,去除其含有的杂蛋白、无机盐以及内毒素等杂质,得到一种高纯度的无内毒素海藻酸钠材料,纯化后的海藻酸钠,内素素含量明显下降,几乎为0,其灰分、蛋白质含量也都有所下降,黏度有所提升,对海藻酸钠的纯化有着明显的提升,产品安全性更高。
65、(2)本发明纯化得到的海藻酸钠其内毒素含量为3eu/g以下,黏度为1200mpa·s以上,灰分含量在21wt%以下,蛋白质含量在0.01wt%以下。
66、(3)本发明纯化后得到海藻酸钠的可以应用在医用材料、组织工程领域,开发高端医疗器械、生物制品。此外,本发明所述制备方法以过程控制为主,成本较低、产品性能可控,可实现工业化生产,具有较高的应用价值,有望带来海藻酸钠在医药领域的新突破和新应用。
- 还没有人留言评论。精彩留言会获得点赞!