一种重组肠激酶轻链或/和其突变体在原核体系中可溶性表达与高效纯化的方法
本发明涉及了重组肠激酶轻链或/和其突变体累的制备,具体涉及了一种重组肠激酶轻链或/和其突变体在原核体系中可溶性表达与高效纯化的方法。
背景技术:
1、肠激酶(ek)(ec 3.4.21.9)是一种丝氨酸蛋白酶,是已知的第一种激活其他酶的酶。人、牛和猪源肠激酶在结构上都是由二硫键连接的重链亚基(80~140kda)和轻链亚基(35~65kda)组成,含有多个糖基化位点,但糖基化与否对肠激酶的活性并不产生显著影响。肠激酶重链主要参与十二指肠内的膜结合和胰蛋白酶原识别,而肠激酶轻链是由糜蛋白酶样丝氨酸蛋白酶结构域组成的丝氨酸蛋白酶,通过切割n-末端六肽val-(asp)4-lys将胰蛋白酶原激活为胰蛋白酶。单独的肠激酶轻链保留了异源二聚体肠激酶的特定活性特征,并且足以对val-(asp)4-lys肽序列进行特异性和酶切。利用肠激酶酶切断裂释放多肽的最大优势在于允许任何下游融合目标蛋白保留其天然n末端,而不会在其n末端留下任何多余的氨基酸残基。这使得肠激酶轻链在利用基因工程技术进行融合蛋白表达、酶切去除融合标签的应用中极具吸引力。肠激酶在各种反应条件下保持活性,能够在ph4.5至9.5的ph值范围、4至45℃的温度范围以及各种洗涤剂和变性剂的存在下发挥酶切活性。部分市售的肠激酶是通过牛或猪的肠道提取纯化而得,价格昂贵,且还存在宿主异源蛋白的污染风险。
2、通过基因工程手段进行肠激酶(轻链)的重组表达是当前主要的获取肠激酶的方式。由于糖基化与否对肠激酶的活性不受影响,因此常用的表达宿主包括原核大肠杆菌表达体系和真核的酵母表达体系。其中,肠激酶在大肠杆菌的重组表达具有速度快、成本低的优势,但仍然存在着技术难点问题。天然的人、牛、猪源的肠激酶含有多个糖基化修饰位点,且在结构中含有多个二硫键结构。因此在原核大肠杆菌表达体系中重组表达肠激酶就面临着:1)不能进行糖基化修饰;糖基化修饰对肠激酶的水溶性和稳定性其中重要作用,在大肠杆菌表达体系中不能进行糖基化的话,导致肠激酶的溶解度下降,疏水性增强,易于在重组表达过程中在胞内形成无活性、无结构的包涵体,进而需要进行蛋白复性;2)肠激酶中的多对二硫键结构难以在大肠杆菌胞内正确形成;大肠杆菌表达体系中缺乏翻译后修饰功能,常规的大肠杆菌宿主难以进行肠激酶中多对二硫键的氧化形成,进而导致二硫键错配的问题严重,进一步加重包涵体的形成。
3、例如,pepeliaev s.等利用大肠杆菌表达体系重组表达人肠激酶轻链时,发现将人肠激酶轻链与硫氧还原蛋白融合(trx-hek)表达,融合蛋白(trx-hek)仍然以包涵体形式表达,需要进行复性(s.pepeliaev,j.krahulec,m.tlustá,z.cerny,j.jílková,expression and purification ofthe light chain ofhuman enteropeptidase ine.coli,minerva biotechnol.24(2012)42–52.)。gasparian m.e.等利用类似的方式,同样在大肠杆菌中以包涵体形式表达,trx融合策略并未显著改善hek在大肠杆菌表达体系中的可溶性表达,下游需要结合蛋白复性操作(m.e.gasparian,v.g.ostapchenko,d.a.dolgikh,m.p.kirpichnikov,biochemical characterization ofhumanenteropeptidase light chain,biochemistry 71(2006)113–119.)。tan h.等人将牛肠激酶轻链与谷胱甘肽芳基转移酶(gst)融合表达,发现gst-bek融合蛋白仍然主要以包涵体形式表达,gst融合的策略也并未改善bek蛋白在大肠杆菌体系中的可溶表达情况,仍然在后续工序中进行蛋白复性(tan h,wang j,zhao zk.purification and refoldingoptimization of recombinant bovine enterokinase light chain overexpressed inescherichia coli.protein expr purif.2007nov;56(1):40-7.)。ayat h.等对比研究了trx-bek在大肠杆菌的胞内表达和分泌周质表达两种方式对trx-bek可溶性表达的影响,发现尽管分泌周质的表达方式能够有限提高trx-bek的可溶性表达比例,但是在两种方式的表达策略中,trx-bek绝大部分仍然以包涵体形式表达(ayat h,darvishi o,moazeni e,momeni bidezarda.comparison of periplasmic and cytoplasmic expressionofbovine enterokinase light chain in e.coli.protein j.2022feb;41(1):157-165.)kimy.s.等人将人肠激酶轻链(hek,c112s)与麦芽糖结合蛋白(mbp)融合,并与分子伴侣(groel/es)在大肠杆菌宿主中共表达,实现hek在大肠杆菌表达体系中的可溶性表达,避免后续进行蛋白复性的操作(kimys,lee hj,park sh,kim yc,ahn j.expression andpurification of soluble and active human enterokinase light chain inescherichia coli.biotechnol rep(amst).2021may 5;30:e00626.)pepeliaev s.等利用毕赤酵母表达体系成功将hek实现可溶性表达,但表达水平相对大肠杆菌较低,且成本较高(pepeliaev s,krahulec j,z,j,m,j.high levelexpression of human enteropeptidase light chain in pichiapastoris.jbiotechnol.2011oct 20;156(1):67-75.)。
技术实现思路
1、本发明的目的在于:本发明针对现有技术的不足和上述所提及的困难问题,提供一种从原核体系中可溶表达重组肠激酶轻链(rek)及其突变体的方法,并提供一种从细菌破碎上清液的复杂体系中高效纯化rek及其突变体的方法。下游工艺中不涉及包涵体变性与复性工序,其培养过程简单且成本极低,rek或其突变体表达周期短,下游纯化步骤简单,所制备的rek或其突变体蛋白结构正确,其体外活性保持良好。
2、为了实现上述目的,本发明采用的技术方案为:
3、一种可溶性表达及高效纯化重组肠激酶轻链的方法,包括以下步骤:
4、步骤1、将c端带his-tag亲和标签的肠激酶轻链或/和其突变体基因序列与两个及以上的sumo蛋白串联序列的3’末端拼接,获得(sumo)n-rek-his(n为≥2,自然数)的基因序列;
5、步骤2、将步骤1得到的(sumo)n-rek-his的基因序列插入原核体系表达质粒载体中,之后将质粒载体转入原核感受态细胞中;
6、步骤3、通过抗性涂板挑选优势生长菌落,进行扩大培养,通过加入iptg并降低温度进行诱导目的基因的表达得到融合蛋白(sumo)n-rek-his;
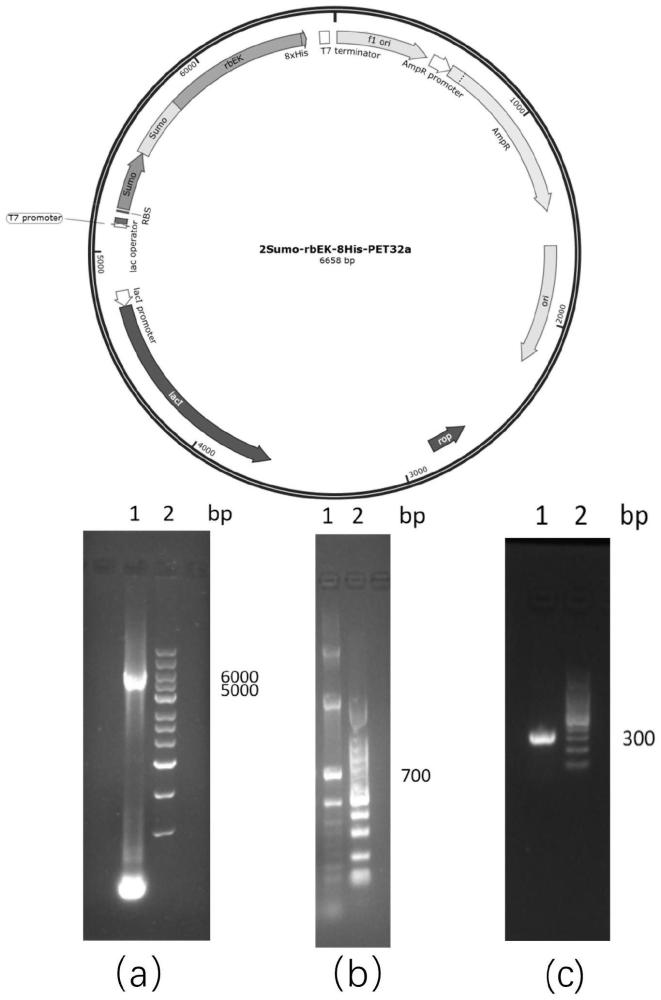
7、步骤4、裂解菌体,离心获得上清液,通过阴离子交换层析从上清液中纯化获取较高纯度重组(sumo)n-rek-his融合蛋白,经ulp1酶酶切除去(sumo)n融合序列后,再通过金属螯合层析,得到重组肠激酶rek-his。
8、基于人、牛和猪源的肠激酶轻链(uniprotkb-p98073(785-1019aa)、p98074(800-1034aa)、e6y432或q6b4r4)及其突变体,如重组牛肠激酶(c112s)突变体(通过密码子大肠杆菌偏好性优化,获得rbek的基因序列,并在此基础上可进行特定(单位点或多位点)氨基酸位点突变,衍生rbek突变体,其常见的突变如c1125s、c112a等,但不局限于此。通过pcr技术,在特定限制性内切酶和特定引物的作用下,可将rek及其突变体的基因序列与两个及以上的小泛素相关修饰物(sumo)串联基因序列的3’端拼接,获得(sumo)n-rek-his(n≥2)基因序列,并通过pcr方法将(sumo)n-rek-his(n≥2)基因序列插入大肠杆菌表达质粒载体中,然后将质粒转入到大肠杆菌感受态细胞中。通过抗性涂板挑选优势生长菌落,进行扩大培养,并通过干预启动子进行目的基因转录和翻译表达得到融合蛋白(sumo)n-rek-his(n≥2)。最终诱导结束收获菌体,经细菌破碎后离心得到破碎上清液,然后进行阴离子交换层析(流穿模式)纯化,得到(sumo)n-rek-his(n≥2),再经ulp1酶切去除(sumo)n(n≥2)融合蛋白后,再次通过金属螯合亲和层析(吸附-洗脱模式)纯化,最终得到rek-his或其突变体。
9、利用原核大肠杆菌可溶性的高表达rek及其突变体蛋白,避免了因难以在大肠杆菌中氧化形成数对二硫键和缺乏糖基化修饰而导致疏水性较强的rek-his及其突变体在原核胞内表达过程中形成无活性、无结构的包涵体,后续下游无需经历包涵体复性的过程。
10、利用原核大肠杆菌体系直接可溶表达rek-his及其突变体的融合蛋白,其n末端含有两个及以上的sumo或sumo改造体((sumo)n,n≥2)促溶融合蛋白序列和亲和纯化标签,促进rek-his及突变体融合蛋白在原核表达体系中正确折叠。
11、利用一步阴离子交换层析法(流穿模式)从大肠杆菌细菌破碎上清液的复杂体系中高效纯化得融合蛋白((sumo)n-rek-his)融合蛋白经过ulp1酶切去除(sumo)n融合序列后,再经过一步金属螯合层析法(吸附-洗脱模式)纯化获得rek-his或其突变体蛋白。所制备获得的rek-his及其突变体蛋白具有正确的空间结构和良好的生物活性。
12、所述的rek,其序列为人、牛或猪源肠激酶轻链亚基(uniprotkb-p98073(785-1019aa)、p98074(800-1034aa)、e6y432或q6b4r4),或者在其序列中缺失或替换一个或数个氨基酸残基。
13、所述的rek-his突变体为rek-his的结构等同物,在不改变rek主体空间结构的前提下,对其一级结构氨基酸序列中的任意位点进行一个或数个氨基酸的替换、缺失或插入的突变体,即可视为rek-his结构等同物。
14、所述的rek-his的基因序列为优化后的大肠杆菌偏好性密码子。
15、所述的rek-his突变体的基因序列是在rek基因序列的基础上进行的一个或数个氨基酸密码子替换所得到的基因序列,例如一种代表性的重组牛肠激酶(c112s)突变体的基因序列为(seq id no:1)。
16、所述的一种具代表性的重组牛肠激酶突变体rbek(c112s)融合表达形式(n端到c端:sumo-sumo-rbek-his)。
17、所述的融合形式((sumo)n-rek-his)中,(sumo)n为两个及以上的sumo蛋白序列的串联,n≥2,且为自然数。
18、所述sumo蛋白序列为小泛素相关修饰物(small ubiquitin-related modifier),其中最具代表性的序列来源物种为酿酒酵母(菌株atcc 204508/s288c)的泛素样蛋白smt3(uniprotkb-q12306)的序列,其氨基酸为(seq id no:2),其大肠杆菌密码子优化后的基因序列为(seq id no:3),或对其一级序列中的一个或数个氨基酸残基进行替换、突变的sumo改造体。
19、所述两个及以上的sumo蛋白序列的串联模式可以是多个sumo重复序列的串联,或是多个sumo改造体的串联,或是sumo与sumo改造体的串联,其中一种代表性的串联模式为sumo改造体-sumo-rek-his(后续简称(sumo)2-rek-his),一种代表性的重组牛肠激酶(c112s)突变体融合蛋白(sumo)2-rbek-his氨基酸序列为(seq id no:4),基因序列为(seqid no:5)。
20、所述的sumo改造体的特征在于对其蛋白序列的一个或数个氨基酸残基进行替换、突变,尤其是c末端的五个氨基酸eqigg中的一个或数个氨基酸残基进行突变、替换或截短等,一种典型的sumo改造体c末端的序列为eqig,其氨基酸为(seq id no:6),基因序列为(seq id no:7),另一种代表性的c末端序列为ddddk。
21、所述的sumo改造体的特征在于当其它蛋白序列融合于其c末端时,ulp1酶不能识别sumo改造体的c末端序列,难以将其酶切断裂。
22、所述的原核体系表达载体的特征在于在原核细菌中能够自我复制扩增、启动转录和翻译的质粒,如pet系列、pbv系列等质粒,代表性质粒如pet-32a质粒。
23、所述的原核感受态细胞宿主所具有的特征包括倍增周期短、培养基要求简单、重组蛋白表达产量高等,包括大肠杆菌、枯草芽孢杆菌等,优选的大肠杆菌,如e.coli bl21de3,更进一步,优选e.coli bl21 origami(de3)和rosetta-gami(de3)plyss宿主,但不局限于此。
24、所述在特定状态下是指在对携带目的基因((sumo)n-rek-his)的质粒进行启动转录的操作状态,包括加入一定浓度的干预启动子的诱导剂、升高或降低培养的温度,或者培养基自诱导的方式等,但不局限于此。一种常用且代表性的干预启动子启动质粒中目的基因转录的方式是通过加入iptg或采用乳糖及其他乳糖结构类似物化合物等,如pet系列质粒t7启动子类型的转录启动。另一种常见且具代表性的促进目的基因可溶表达的方式是降低诱导表达时的培养温度,如20~30℃。
25、所述的金属螯合层析,其固相层析填料的特征在于能够与三个及以上的组氨酸残基串联融合标签(his-tag)亲和结合吸附的层析填料类型;固相层析微球填料上通过衍生出螯合基团螯合二价金属离子,包括镍离子(ni2+)、铜离子(cu2+)、锌离子(zn2+)和钴离子(co2+)等,优先的镍离子螯合层析,但不局限于此。
26、进一步的,sumo的个数n值越多,促溶解表达效果越强。
27、本发明还提供一种从表达宿主菌体破碎后离心所得的复杂上清液体系中纯化rek-his或其突变体的方法。其特征是先后通过阴离子交换层析和金属螯合层析从大肠杆菌菌体破碎上清液复杂体系中高效纯化得到rek-his及其突变体蛋白。
28、进一步的,所述步骤1中,将人源、牛源或猪源的肠激酶rek-his或/和其突变体的氨基酸序列依次进行基因序列转换、大肠杆菌宿主偏好密码子优化,获得c端带his-tag亲和标签的肠激酶轻链或/和其突变体的基因序列。
29、进一步的,c端带his-tag亲和标签的肠激酶轻链的基因序列,核苷酸序列如seqid no:1所示。
30、进一步的,sumo蛋白的序列是小泛素相关修饰物,来源物种为酿酒酵母的泛素样蛋白smt3的序列,或对酿酒酵母的泛素样蛋白smt3的一级序列中的一个或数个氨基酸残基进行替换、突变的sumo改造体。
31、进一步的,所述步骤2中,原核感受态细胞为大肠杆菌或枯草芽孢杆菌。
32、进一步的,所述步骤2中,质粒载体为pet系列质粒或pbv系列质粒。
33、进一步的,所述步骤3中,当n为2时,融合蛋白(sumo)2-rek-his的氨基酸序列如seq id no:4;基因序列如seq id no:5所示。
34、进一步的,所述步骤4中,阴离子交换层析和金属螯合层析为流穿模式。
35、进一步的,所述步骤4中,所述第一次金属螯合层析和所述第二次金属螯合层析中,固相层析填料是能够与三个及以上的组氨酸残基串联融合标签亲和结合吸附的层析填料类型;固相层析微球填料上通过衍生出螯合基团螯合二价金属离子,包括镍离子、铜离子、锌离子和钴离子。
36、进一步的,所述步骤4具体的操作步骤:
37、步骤41、将表达后的菌体,使用重悬缓冲液重悬后进行细菌破碎,将细菌内蛋白释放至胞外重悬缓冲液,离心细菌破碎上清液;
38、步骤42、将步骤41得到的上清液进行阴离子交换层析纯化,样品流经层析填料后,(sumo)n-rek-his存在于流穿液中,杂质吸附在层析柱上,经过适当淋洗后,最终使用高盐洗脱液将大部分杂质洗脱去除;
39、步骤43、步骤42所得蛋白样品在缓冲体系为50mm tris-hcl,ph8.0缓冲液;然后使用ulp1酶进行酶切切除(sumo)n融合蛋白,释放出游离的rbek-his,酶切时间1~24h,酶切温度4~30℃;所用的ulp1酶与蛋白的比例为1:10~10000;
40、步骤44、将步骤43所得酶切后样品,进行镍金属螯合层析纯化,rek-his蛋白被吸附在层析填料上,融合蛋白序列(sumo)n则流穿通过层析柱,最终收集洗脱液,浓缩、换液、保存、获得rek-his蛋白。
41、说明书中涉及的序列如下:
42、seq id no:1:经大肠杆菌偏好性密码子优化后的rbek-his(c112s)突变体的基因序列
43、attgtaggtggttctgattctcgcgaaggtgcttggccgtgggttgtcgctctgtacttcgatgaccagcaggtttgcggtgcttccctggtttcccgtgactggctggtgtccgccgctcattgcgtttacggtcgtaacatggagccgtctaaatggaaagctgtactgggcctgcacatggcgtctaacctgacctccccgcagattgaaactcgtctgattgatcagattgtgatcaaccctcactataacaaacgtcgcaaagacaacgacatcgccatgatgcacctggaaatgaaagtgaactacaccgattatatccagccgatctctctgccagaagagaaccaggttttcagccctggccgtatttgcagcatcgcgggctggggtaccctgatttaccagggttctaccgcagatgtgctgcaggaagcggatgttccgctgctgtctaacgaaaagtgccagcagcagatgccggaatataacatcaccgaaaacatggtttgcgcgggctacgaagcaggtggcgttgattcttgccagggtgattctggtggcccgctgatgtgtcaggaaaataaccgttggctgctggccggcgtcacttcctttggctatcagtgcgcactgccgaatcgtccgggtgtatatgcgcgcgtaccacgctttaccgaatggattcagtctttcctgcaccatcatcaccaccaccaccaccac。
44、seq id no:2
45、代表性的sumo融合蛋白的氨基酸序列
46、sdsevnqeakpevkpevkpethinlkvsdgsseiffkikkttplrrlmeafakrqgkemdslrflydgiriqadqtpedldmedndiieahreqigg。
47、seq id no:3
48、代表性的sumo融合蛋白经大肠杆菌偏好性密码子优化后的基因序列
49、agcgatagcgaagttaatcaagaagccaaaccggaagttaagccggaagtgaaacctgaaacacatattaacctgaaagtgagtgatggtagcagcgagatctttttcaaaatcaaaaagaccacaccgctgcgtcgtctgatggaagcatttgcaaaacgtcagggtaaagaaatggatagcctgcgttttctgtatgatggtattcgtattcaggcagatcagacaccggaagatctggatatggaagataacgatattatcgaagcacatcgtgagcagattggtggt。
50、seq id no:4
51、重组牛肠激酶(c112s)突变体融合蛋白(sumo)2-rek-his的氨基酸序列
52、sdsevnqeakpevkpevkpethinlkvsdgsseiffkikkttplrrlmeafakrqgkemdslrflydgiriqadqtpedldmedndiieahreqigsdsevnqeakpevkpevkpethinlkvsdgsseiffkikkttplrrlmeafakrqgkemdslrflydgiriqadqtpedldmedndiieahreqiggivggsdsregawpwvvalyfddqqvcgaslvsrdwlvsaahcvygrnmepskwkavlglhmasnltspqietrlidqivinphynkrrkdndiammhlemkvnytdyiqpislpeenqvfspgricsiagwgtliyqgstadvlqeadvpllsnekcqqqmpeynitenmvcagyeaggvdscqgdsggplmcqennrwllagvtsfgyqcalpnrpgvyarvprftewiqsflhhhhhhhhh。
53、seq id no:5
54、重组牛肠激酶(c112s)突变体融合蛋白(sumo)2-rek-his的基因序列
55、agcgatagcgaagttaatcaagaagccaaaccggaagttaagccggaagtgaaacctgaaacacatattaacctgaaagtgagtgatggtagcagcgagatctttttcaaaatcaaaaagaccacaccgctgcgtcgtctgatggaagcatttgcaaaacgtcagggtaaagaaatggatagcctgcgttttctgtatgatggtattcgtattcaggcagatcagacaccggaagatctggatatggaagataacgatattatcgaagcacatcgtgagcagattggtagcgatagcgaagttaatcaagaagccaaaccggaagttaagccggaagtgaaacctgaaacacatattaacctgaaagtgagtgatggtagcagcgagatctttttcaaaatcaaaaagaccacaccgctgcgtcgtctgatggaagcatttgcaaaacgtcagggtaaagaaatggatagcctgcgttttctgtatgatggtattcgtattcaggcagatcagacaccggaagatctggatatggaagataacgatattatcgaagcacatcgtgagcagattggtggtattgtaggtggttctgattctcgcgaaggtgcttggccgtgggttgtcgctctgtacttcgatgaccagcaggtttgcggtgcttccctggtttcccgtgactggctggtgtccgccgctcattgcgtttacggtcgtaacatggagccgtctaaatggaaagctgtactgggcctgcacatggcgtctaacctgacctccccgcagattgaaactcgtctgattgatcagattgtgatcaaccctcactataacaaacgtcgcaaagacaacgacatcgccatgatgcacctggaaatgaaagtgaactacaccgattatatccagccgatctctctgccagaagagaaccaggttttcagccctggccgtatttgcagcatcgcgggctggggtaccctgatttaccagggttctaccgcagatgtgctgcaggaagcggatgttccgctgctgtctaacgaaaagtgccagcagcagatgccggaatataacatcaccgaaaacatggtttgcgcgggctacgaagcaggtggcgttgattcttgccagggtgattctggtggcccgctgatgtgtcaggaaaataaccgttggctgctggccggcgtcacttcctttggctatcagtgcgcactgccgaatcgtccgggtgtatatgcgcgcgtaccacgctttaccgaatggattcagtctttcctgcaccatcatcaccaccaccaccaccac。
56、seq id no:6
57、代表性的sumo融合蛋白改造体的氨基酸序列
58、sdsevnqeakpevkpevkpethinlkvsdgsseiffkikkttplrrlmeafakrqgkemdslrflydgiriqadqtpedldmedndiieahreqig。
59、seq id no:7
60、代表性的sumo融合蛋白改造体经大肠杆菌偏好性密码子优化后的基因序列
61、agcgatagcgaagttaatcaagaagccaaaccggaagttaagccggaagtgaaacctgaaacacatattaacctgaaagtgagtgatggtagcagcgagatctttttcaaaatcaaaaagaccacaccgctgcgtcgtctgatggaagcatttgcaaaacgtcagggtaaagaaatggatagcctgcgttttctgtatgatggtattcgtattcaggcagatcagacaccggaagatctggatatggaagataacgatattatcgaagcacatcgtgagcagattggt。
62、综上所述,由于采用了上述技术方案,本发明的有益效果是:
63、本发明提供的一种重组肠激酶轻链或/和其突变体在原核体系中可溶性表达及高效纯化的方法,首先,将肠激酶轻链或/和其突变体的基因序列被拼接在(sumo)n(n≥2)基因序列的3’末端,插入在原核表达体系表达载体中,并转入到原核感受态细胞中;然后,所述的(sumo)n(n≥2)与肠激酶轻链或/和其突变体的融合蛋白在原核表达体系中在特定状态下以可溶的形式在胞内高表达;最后表达后的(sumo)n(n≥2)与肠激酶轻链或/和其突变体的融合蛋白无需进行包涵体复性,通过一步阴离子交换层析获得(sumo)n-rek-his融合蛋白,再经过ulp1酶酶切去除(sumo)n融合序列后,再经过一步金属螯合层析(流穿模式)得到肠激酶轻链或/和其突变体。该方法利用两个及以上的sumo序列串联融合的方法,实现人il-2肠激酶轻链或/和其突变体在大肠杆菌表达体系中的可溶性表达,避免了传统大肠杆菌体系表达肠激酶轻链或/和其突变体形成包涵体,避免肠激酶轻链或/和其突变体以无结构、无活性的包涵体形式表达,避免下游进行肠激酶轻链或/和其突变体蛋白复性的工序;并通过简单的层析步骤从组分复杂的细菌破碎上清液体系中高效纯化得到重组肠激酶轻链或/和其突变体;具有操作简便,适合规模化放大、周期短、纯度高、工艺稳定等特点。
- 还没有人留言评论。精彩留言会获得点赞!