TaEMF2蛋白及其编码基因在调控小麦抽穗期和籽粒产量中的应用
本发明涉及生物中,taemf2蛋白及其编码基因在调控小麦抽穗期和籽粒产量中的应用。
背景技术:
1、小麦(triticum aestivuml.)是世界上广泛种植的粮食作物,世界上约40%的人口以小麦为主要粮食。精确控制抽穗/开花时间对小麦区域适应性及高产、稳产和栽培方式至关重要。在小麦中已经分离出许多调控基因参与响应春化的花启动,并对其功能进行了表征,以响应控制春化来调节开花起始,如vrn1、vrn2、taft1(vrn3)、vrn-d4、ver2、tagrp2与vas。春化前,抑制性组蛋白修饰h3k27me3在vrn1的启动子和第一内含子中富集。此外,富含甘氨酸的rna结合蛋白2(tagrp2)直接与vrn1第一内含子的“关键区”结合,vrn1启动子的p2基序和其第一内含子中的i4基序能够形成环结构,共同抑制vrn1的转录。春化过程中,vrn1的抑制性h3k27me3修饰转化为激活性h3k4me3修饰,磷酸化的vernalization相关2(ver2)是一种凝集素蛋白,能够从细胞质进入细胞核,并直接与o-glcnac修饰的tagrp2相互作用,缓解tagrp2对vrn1转录的抑制最终促进开花。此外,vrn1产生的长链非编码rnavas,其募集tarf2b-tarf2a异源二聚体直接与vrn1启动子的sp1基序结合,增强其转录。vrn1还可以与tavrt2形成复合物,该复合物直接结合到vrn1的carg盒以增加vrn1的表达。因此,克隆小麦抽穗期/开花期基因,研究其分子机理对小麦品种改良具有重大意义。
2、polycomb group(pcg)复合体最初在果蝇中发现,其作用是控制同源异型基因空间表达的调节因子,它主要以三种pcg蛋白复合体(polycomb repressive complex 1(prc1),polycomb repressive complex2(prc2)和pcl-prc2)的形式存在并起作用。随后,有研究发现pcg在哺乳动物和植物中的作用与果蝇中相似。pcg介导的基因抑制能够涉及植物发育的多个过程,如开花时间控制、花器官发育、配子体发育及种子发育等。在植物中,拟南芥中的pcg蛋白复合体也主要是以这三种形式存在,其中以prc2复合体为主进行深入研究,在拟南芥中至少存在三种prc2复合物,分别是vrn2-prc2复合物主要是由clf/swn、vrn2、fie和msi1蛋白组成,在春化过程中通过对开花抑制因子flc的染色质进行组蛋白甲基化修饰进而抑制flc的转录,促进开花;fis-prc2复合物由clf/swn、fis2、fie和msi1蛋白组成,在雌配子形成和早期种子发育过程中起着重要的作用,当在发生基因突变后会导致胚乳发育异常。综上所述,在模式植物拟南芥和水稻中研究了emf2基因与开花过程密切相关,然而,在小麦中相关的研究还还未见报道。因此,挖掘小麦抽穗期新基因并进行功能验证及调控网络分析,为培育小麦广适高产新品种提供新的基因资源。
技术实现思路
1、本发明所要解决的技术问题是如何调控植物抽穗期和籽粒产量。
2、为解决上述技术问题,本发明首先提供了蛋白质或调控所述蛋白质含量或活性的物质的下述任一应用或至少两种应用:
3、d1)调控植物抽穗期;
4、d2)制备调控植物抽穗期产品;
5、d3)培育抽穗期缩短或增加植物;
6、d4)制备培育抽穗期缩短或增加植物产品;
7、d5)调控植物籽粒产量;
8、d6)制备调控植物籽粒产量产品;
9、d7)培育籽粒产量增加植物;
10、d8)制备培育籽粒产量增加植物产品;
11、所述蛋白质来源于小麦(triticum aestivum l.),其名称为taemf2,taemf2为如下a1)、a2)或a3):
12、a1)氨基酸序列是seq id no.3、seq id no.6或seq id no.9的蛋白质;
13、a2)将序列表中seq id no.3、seq id no.6或seq id no.9所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
14、a3)在a1)或a2)的n端或/和c端连接标签得到的融合蛋白质。
15、所述调控植物抽穗期可为延长或缩短植物抽穗期,所述调控taemf2含量或活性可为降低或提高taemf2含量或活性;
16、所述调控植物籽粒产量可为增加植物籽粒产量,所述调控taemf2含量或活性可为降低taemf2含量或活性。
17、上述a2)中的taemf2蛋白质,为与seq id no.3、seq id no.6或seq id no.9所示蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existencecost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。所述具有75%或75%以上同一性为具有75%、具有80%、具有85%、具有90%、具有95%、具有96%、具有97%、具有98%或具有99%的同一性。
18、上述a2)中的taemf2蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
19、上述a2)中的taemf2蛋白质的编码基因可通过将seq id no.2、seq id no.5或seqid no.8所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上标签的编码序列得到。其中,seq id no.2所示的dna分子编码seq id no.3所示的蛋白质,seq id no.5所示的dna分子编码seq idno.6所示的蛋白质,seq id no.8所示的dna分子编码seq id no.9所示的蛋白质。
20、a3)中所述标签可为利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述标签可为poly-arg、poly-his、flag、strep-tag ii、c-myc、mbp标签、ha标签、gst标签和/或sumo标签等。
21、上述应用中,所述物质可为下述b1)至b9)中的任一种:
22、b1)编码taemf2的核酸分子;
23、b2)含有b1)所述核酸分子的表达盒;
24、b3)含有b1)所述核酸分子的重组载体、或含有b2)所述表达盒的重组载体;
25、b4)含有b1)所述核酸分子的重组微生物、或含有b2)所述表达盒的重组微生物、或含有b3)所述重组载体的重组微生物;
26、b5)含有b1)所述核酸分子的转基因植物细胞系、或含有b2)所述表达盒的转基因植物细胞系;
27、b6)含有b1)所述核酸分子的转基因植物组织、或含有b2)所述表达盒的转基因植物组织;
28、b7)含有b1)所述核酸分子的转基因植物器官、或含有b2)所述表达盒的转基因植物器官;
29、b8)降低taemf2含量的核酸分子;
30、b9)含有b8)所述核酸分子的表达盒、重组载体、重组微生物、转基因植物细胞系、转基因植物组织或转基因植物器官。
31、上述应用中,:b1)所述核酸分子可为如下b11)或b12)或b13)或b14)或b15):
32、b11)编码序列是序列表中seq id no.2、seq id no.5或seq id no.8的dna分子;
33、b12)序列表中序列表中seq id no.2、seq id no.5或seq id no.8所示的dna分子;
34、b13)序列表中序列表中seq id no.1、seq id no.4或seq id no.7所示的dna分子;
35、b14)与b11)或b12)或b13)限定的核苷酸序列具有75%或75%以上同一性,且编码taemf2的dna分子;
36、b15)在严格条件下与b11)或b12)或b13)或b14)限定的核苷酸序列杂交,且编码taemf2的dna分子。
37、本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的taemf2的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明的taemf2蛋白质的核苷酸序列75%或者更高同一性的核苷酸,只要编码本发明的taemf2蛋白质且具有相同的蛋白质功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
38、这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码seq id no.2、seq id no.5或seq id no.8所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
39、上述应用中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5mnapo4和1mm edta的混合溶液中杂交,在50℃,2×ssc,0.1% sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,1×ssc,0.1% sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.5×ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.1×ssc,0.1% sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在65℃,0.1×ssc,0.1%sds中漂洗;也可为:在6×ssc,0.5% sds的溶液中,在65℃下杂交,然后用2×ssc,0.1% sds和1×ssc,0.1% sds各洗膜一次;也可为:2×ssc,0.1% sds的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5×ssc,0.1% sds的溶液中,在68℃下杂交并洗膜2次,每次15min;也可为:0.1×sspe(或0.1×ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
40、上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
41、上述应用中,b2)所述的含有编码taemf2的核酸分子的表达盒,是指能够在宿主细胞中表达taemf2的dna,该dna不但可包括启动taemf2编码基因转录的启动子,还可包括终止taemf2编码基因转录的终止子。进一步,所述表达盒还可包括增强子序列。
42、可用现有的表达载体构建含有所述taemf2基因表达盒的重组载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。如pahc25、pbin438、pcambia1302、pcambia2301、pcambia1301、pcambia1300、pbi121、pcambia1391-xa、psn1301或pcambia1391-xb(cambia公司)等。所述植物表达载体还可包含外源基因的3′端非翻译区域,即包含聚腺苷酸信号和任何其它参与mrna加工或基因表达的dna片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mrna前体的3′端,如农杆菌冠瘿瘤诱导(ti)质粒基因(如胭脂碱合成酶基因nos)、植物基因(如大豆贮存蛋白基因)3′端转录的非翻译区均具有类似功能。使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(gus基因、萤光素酶基因等)、抗生素的标记基因(如赋予对卡那霉素和相关抗生素抗性的nptii基因,赋予对除草剂膦丝菌素抗性的bar基因,赋予对抗生素潮霉素抗性的hph基因,和赋予对氨甲喋呤抗性的dhfr基因,赋予对草甘磷抗性的epsps基因)或是抗化学试剂标记基因等(如抗除莠剂基因)、提供代谢甘露糖能力的甘露糖-6-磷酸异构酶基因。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以逆境筛选转化植株。
43、上述应用中,所述载体可为质粒、黏粒、噬菌体或病毒载体。所述质粒具体可为pwmb110载体或pbue413载体。
44、b3)所述重组表达载体具体可为pwmb110::taemf2-2d。pwmb110::taemf2-2d重组载体通过将seq id no.1所示的taemf2-2d基因插入至pwmb110载体中得到,pwmb110::taemf2-2d能表达seq id no.3所示的taemf2蛋白质与3×flag标签形成的融合蛋白质。
45、b8)所述核酸分子可为靶向taemf2蛋白质的编码基因的sgrna或转录所述sgrna的dna分子。所述sgrna的靶序列可为seq id no.1第3904-3922位,seq id no.4的第5190-5208位,seq id no.7的第4341-4359位,和/或,seq id no.1第2050-2068位,seq id no.4的第3334-3352位,seq id no.7的第2495-2513位。
46、b9)所述重组载体可为利用crispr/cas9系统制备的可以降低taemf2含量的重组载体。b9)所述核酸重组载体可为pbue413-taemf2,pbue413-taemf2为利用pbue413载体得到的能转录靶向seq id no.1第3904-3922位、seq id no.4的第5190-5208位、seq id no.7的第4341-4359位、seq id no.1第2050-2068位、seq id no.4的第3334-3352位、seq idno.7的第2495-2513位的sgrna,并能表达cas9蛋白质的重组载体。
47、上述应用中,所述微生物可为酵母、细菌、藻或真菌。其中,细菌可为农杆菌。
48、上述应用中,所述转基因植物细胞系、转基因植物组织和转基因植物器官均不包括繁殖材料。
49、本发明还提供了下述任一方法:
50、x1)培育抽穗期缩短植物的方法,包括使受体植物中表达taemf2,或提高受体植物中taemf2的含量或活性,得到抽穗期缩短的目的植物;
51、x2)缩短植物抽穗期的方法,包括使受体植物中表达taemf2,或提高受体植物中taemf2的含量或活性,得到抽穗期缩短的目的植物,实现植物抽穗期的缩短;
52、x3)培育籽粒产量增加植物的方法,包括降低受体植物中taemf2的含量或活性,或敲除taemf2的编码基因,得到籽粒产量增加的目的植物;
53、x4)提高籽粒产量的方法,包括降低受体植物中taemf2的含量或活性,或敲除taemf2的编码基因,得到籽粒产量提高的目的植物。
54、上述方法中,x1)、x2)、x5)、x6)所述方法可通过向所述受体植物中导入taemf2的编码基因并使所述编码基因得到表达实现。
55、x3)与x4)所述方法可通过敲除taemf2的编码基因实现。
56、上述方法中,所述编码基因可为b1)所述核酸分子。
57、所述taemf2的编码基因可利用含有所述taemf2的编码基因的重组表达载体导入受体植物。所述重组表达载体具体可为所述pwmb110::taemf2-2d。
58、x3)与x4)所述方法可利用crispr/cas9系统敲除taemf2的编码基因实现。具体的,可将所述pbue413-taemf2导入所述受体植物筛选taemf2的编码基因得到敲除的目的植物实现。
59、在本发明的一个实施例中,x3)与x4)所述方法可通过对所述受体植物基因组进行如下编辑实现:在seq id no.4的第5190-5191位间插入a,在seq id no.4的第3336-3337为间插入a,在seq id no.7的第2497-2498位间插入a,缺失seq id no.1的第3886-3909位的tttttgtacatccagccaaaattt,缺失seq id no.1的第2048-2055位的cagaccac。
60、在本发明的一个实施例中,x3)与x4)所述方法还可通过对所述受体植物基因组进行如下编辑实现:缺失seq id no.4的第5193位的t、第3337-3340位的caca,在seq id no.7的第2497-2498位间插入c,在seq id no.1的第3904-3905位间插入a,在seq id no.1的第2052-2053位间插入t/a(即一条染色体插入t,一条染色体插入a)。
61、所述重组载体可通过使用ti质粒,植物病毒载体,直接dna转化,微注射,电穿孔等常规生物技术方法导入植物细胞(weissbach,1998,method for plant molecularbiology viii,academy press,new york,pp.411-463;geiserson and corey,1998,plantmolecular biology(2nd edition).)。
62、所述目的植物理解为不仅包含taemf2蛋白或其编码基因被改变的第一代植物,也包括其子代。对于所述目的植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述目的植物包括种子、愈伤组织、完整植株和细胞。
63、taemf2或所述调控taemf2含量或活性的物质,也属于本发明的保护范围。
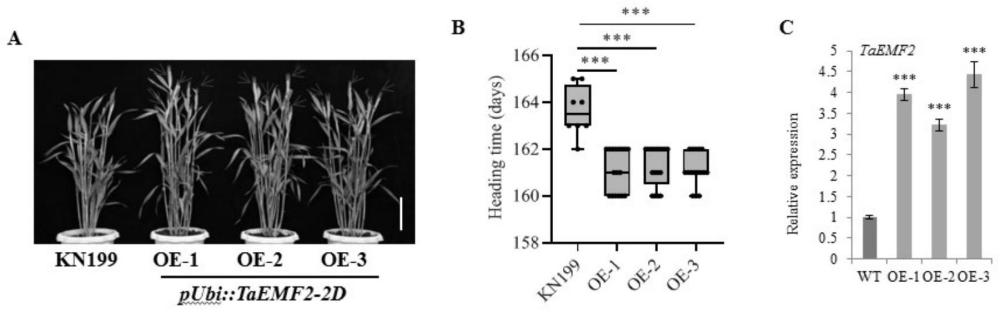
64、本发明中,所述籽粒产量可体现在籽粒大小和/或粒重上。进一步,所述籽粒大小可体现在籽粒宽度和/或长度上。
65、本发明中,所述植物可为m1)或m2)或m3):
66、m1)单子叶植物或双子叶植物;
67、m2)禾本科植物;
68、m3)小麦。
69、实验证明,taemf2基因的过表达可以缩短植物的抽穗期;taemf2基因的敲除可以延长植物的抽穗期,提高籽粒的粒长、粒宽和粒重。表明,taemf2基因及其编码的蛋白质不仅可以调控植物的抽穗期,还可以影响籽粒大小和千粒重等多个性状,具有很好的应用前景。
70、下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
- 还没有人留言评论。精彩留言会获得点赞!