一种基于核酸信号二次放大的无PAM点限制的CRISPR-Cas12f核酸检测平台
本发明设计一种简便、快速、特异、灵敏的微生物核酸诊断技术,属于微生物检测
背景技术:
1、现如今,由病原微生物引起的传染性疾病正在严重威胁着全世界人类的生命健康,警醒世人亟需开发新型的快速、灵敏、特异性的核酸诊断工具以控制传染病的传播。
2、病原微生物核酸诊断技术有很广泛的应用领域,例如poct、食品安全、环境检测等领域。食源性疾病是食品安全的头号问题,主要是由致病性微生物引起的,而且传染性很强,如酿脓链球菌、沙门氏菌、李斯特菌等。酿脓链球菌(又称a组链球菌)每年在世界范围内会感染1810万人,导致50万人的死亡。因此,有必要建立有效的检测技术及时阻断病原菌的传播。
3、目前对病原菌的诊断技术主要有传统的培养分离法、免疫检测技术以及核酸检测技术。但是培养分离法与免疫检测技术存在一些不足之处,如操作复杂,费时且昂贵,而且特异性与灵敏度性能不足。当前,基于pcr的核酸诊断技术是病原微生物的鉴定金标准,但一般依赖于昂贵的设备、专业人员,同时还需要较长的反应时间(~2h)。
4、近几十年来,等温扩增技术凭借其简易、快速、低成本的优点,成为常规的pcr技术的替代方法一直以来都备受瞩目。目前,一些等温扩增技术已有商品化的产品,如环介导等温扩增(lamp)、重组酶聚合酶扩增(rpa)、等温指数扩增反应(expar)、依赖解旋酶恒温扩增反应(hda)、链置换扩增(sda)、滚环扩增(rca)等。lamp扩增技术可以实现在恒定温度下快速、有效地扩增产生核酸序列,并且具有高特异性与高灵敏度的特性。
5、 作为微生物的自适应免疫防御系统,crispr-cas系统的发现对于基因编辑、转录调控、成像技术、分子检测等领域产生了革新性的影响。多项研究将crispr-cas系统与各种核酸扩增技术偶联可实现扩增检测信号的放大,使得特异性和灵敏度性能指标提高,富集稀少且低丰度的分子靶标,极大地促进了poc诊断技术的发展。crispr-cas系统是一种rna-guide 核酸内切酶,crrna与cas蛋白组装后会靶向碱基互补配对的序列,激活其内切酶活性,引起核酸的切割。cas12f是目前发现的最小尺寸的蛋白,它可以靶向切割ssdna,但不需要pam识别。cas12f不仅可以切割靶链片段(正切),也有侧切活性,可以非特异性切割ssdna,而且,其切割ssdna的特异性高于cas12a。因此,cas12f蛋白适合作为生物传感器用于病原微生物核酸检测与诊断技术。前期工作已经研究报道了不对称pcr与crispr-cas12f系统偶联用于病原菌诊断的应用,其表现出了较高的特异性与灵敏度。
6、在本研究中,为应对病原菌检测的挑战,我们建立了一种平台用于酿脓链球菌的快速、特异性、准确的、灵敏检测,命名为lsd14。我们的系统特点有:广适性,克服了cas12f直接靶向双链核酸需要pam位点的局限性,通过二次信号放大将信号转化为单链,提高了cas12f检测的通用能力;快速,靶标扩增与crispr-cas12f反应可在1h内完成;高特异性,环介导等温扩增引物是基于酿脓链球菌基因组序列设计完成扩增的,而且检测是依赖于cas12f蛋白对扩增的核酸产物的识别继而产生的反式切割信号;操作简易,仅需要在单管内完成恒温反应,然后取样加至酶标板检测即可。这套系统适用于大范围的野外环境的病原菌早期检测,可有效实现检出以限制其传播。
技术实现思路
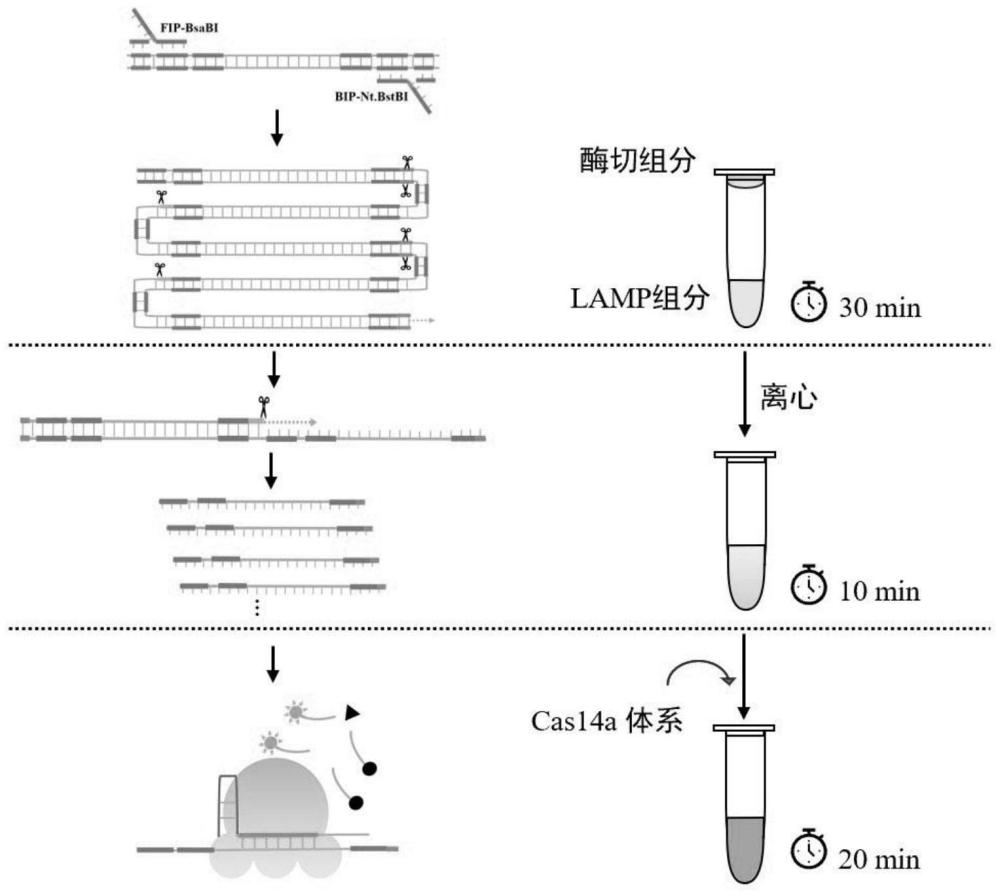
1、 一种信号二次放大的无pam点限制的crispr-cas12f 核酸检测平台,其特征在于:所述方法的步骤包括:材料的准备,lamp引物筛选与改造、sgrna的设计与合成,细菌培养与dna提取,cas12f蛋白的表达与纯化,单管内环介导扩增与链置换体系的建立,cas12f检测体系的建立。
2、 以上所述的lamp引物筛选与改造、sgrna的设计与合成是根据链球菌属酿脓链球菌特异性基因speb的保守序列区域设计,包括一对外引物f3/b3,一对内引物fip-nt/bip-bsa,seq id no:1~4。sgrna序列根据链置换反应形成的单链核酸设计,seq id no:5。
3、 seq id no:1所示的核苷酸序列为:f2: 5’- ctagacaatacaactggaacaa-3’。
4、 seq id no:2所示的核苷酸序列为:b3: 5’- gtgaacagattggttgtagc-3’。
5、 seq id no:3所示的核苷酸序列为:fip-nt: 5’- ccatcaattctgaaatcgccatttt-gagtc-catcctacctacttatagcgg -3’。
6、 seq id no:4所示的核苷酸序列为:bip-bsa: 5’-ttcagtagacatggattatggtcca- gatttttatc- tttcaaggctctttgaacac-3’。
7、 seq id no:5 所示的核苷酸序列为:5’-uugauggcugauguugguau-3’。
8、 以上所述的细菌培养与dna提取是细菌接种lb培养基(lb: 10 g/l 胰蛋白胨, 5g/l 酵母粉,5 g/l nacl)在37℃下摇床(180rpm)培养12h后,使用试剂盒提取基因组dna。
9、以上所述的cas12f蛋白表达与纯化是通过质粒转化后扩培诱导感受态大肠杆菌,利用亲和层析纯化获得单一纯净的cas12f蛋白。
10、 以上所述的单管内环介导扩增与链置换体系的建立,反应管为200μl无核酶pcr管,lamp反应总体系置于管底,链置换反应体系置于管盖。lamp组分为25μl,组分包括:
11、10×反应缓冲液 1×
12、mgso4 6 mm
13、dntps 2.5 mm each
14、fip-nt/bip-bsa 1.6 μm
15、f3/b3 0.2 μm
16、bst 10 u
17、模板 1μl
18、超纯水 补足至25μl
19、反应使用金属浴65℃下,反应30 min。 链置换反应体系为5μl,组分包括:
20、bsabi 1 u
21、ntbstbi 1 u
22、10×反应缓冲液 1×
23、超纯水 补足至5μl
24、待lamp反应结束后,将pcr管置于离心机瞬时离心,再放回金属浴65℃反应10min。
25、 以上所述的cas12f检测体系的建立,反应总体系为20μl,组分包括:
26、5×反应缓冲液 1×
27、cas12f 1 μm
28、sgrna 1 μm
29、ssdna-fq 0.5 μm
30、mgso4 10 mm
31、单链产物 5 μl
32、超纯水 补足至20μl
33、 以上所述的检测体系采用bio-tak酶标仪在45℃下实时检测荧光信号。
34、 以上所述的检测体系的ssdna-fq序列seq id no:6其特征为化合物修饰的短核苷酸序列,核苷酸长度为12nt,其5’端标记羧基荧光素(fam),3’端标记淬灭基团(bhq1)。
35、 seq id no:6所示的核苷酸序列为:5’- fam/tttttttttttt/bhq1 -3’。
36、 本发明的实质性特点与进步是:
37、1)特异性强
38、所检测的阳性样本均检出,且所检测阴性对照均无阳性结果,与金标准qpcr的检测结果一致。
39、2)灵敏度高
40、本发明的检测方法检测酿脓链球菌的检测限约为102 cfu/ml,而qpcr的检测限为104 cfu/ml,本发明显著提高了100倍。
41、3)适用范围广
42、本发明利用crispr-cas12f酶可靶向识别无pam位点的ssdna的性能,使得本检测方法可选择的靶向基因序列无限制,大大地拓展了其可适用范围。
43、4)检测速度快
44、 本发明的检测方法反应可以在最短1个小时内产生信号,相较于qpcr整个过程2-3小时相比,极大地提高了检测速度。
45、5)设备简易,操作简单
46、本发明的检测方法均在恒温条件下进行,相较于pcr设备要求来说成本较低,金属浴即可完成,并且信号采集可通过酶标仪进行实时观察。
- 还没有人留言评论。精彩留言会获得点赞!