一种药物组合物及其用途
本发明涉及分子生物学领域,特别是涉及一种药物组合物及其用途。
背景技术:
1、嵌合抗原受体t细胞(chimeric antigen receptor t-cell,car-t)疗法是指在体外对t细胞进行工程化改造,使t细胞表达能特异性识别和结合肿瘤细胞表面抗原的car,经过体外扩增后再回输至患者体内用于杀伤肿瘤细胞的一种新型免疫疗法。自2017年fda批准全球首个car-t产品kymriah(诺华)上市后,截止2024年3月,目前已有6款car-t产品获得fda批准。我国也于2021年相继批准阿基仑赛、瑞基奥仑塞、纳基奥仑塞、伊基奥仑赛、泽沃基奥仑赛五款car-t疗法上市。car-t疗法的临床试验数量也在近几年呈现爆发式增长,截至2024年3月,在《临床试验》上注册的car-t细胞疗法临床试验已经高达1119项。大量临床数据表明相较于传统肿瘤疗法,car-t在多种肿瘤治疗中特别是复发或难治性淋巴瘤和骨髓瘤中显示出巨大的潜力和明显的优势[1]。
2、car基因转染是car-t疗法中最关键的步骤,同时这也是限制car-t疗法高速发展的限速步骤。目前研究中多数是利用慢病毒或者γ-逆转录病毒将编码car的核酸递送至t细胞内进行转染。已上市的十一款car-t产品中,七款(替沙来塞、利基迈仑赛、西达基奥仑赛、伊基奥仑赛、瑞基奥伦塞、纳基奥仑赛和泽沃基奥仑赛)使用了慢病毒,其余两款(阿基仑赛、布瑞基奥仑赛)使用了γ-逆转录病毒。目前全球car-t临床研究中接近95%的在研项目采用病毒载体构建car-t[2]。病毒载体存在包载容量小、生产成本高、免疫原性高、插入突变、具有致癌风险等诸多局限,同时所涉及的复杂程序和高昂成本限制了car-t的大量生产和应用[3]。因此,安全性更高,成本更低的非病毒递送方式逐渐受到研究人员的关注并用于car-t细胞的构建。
3、如利用电穿孔将质粒dna或mrna直接递送至胞内用于体外构建car-t,当前已有十余个相关的临床在研项目(nct03288493、nct03741127、nct04250324、nct03927261等)。虽然电穿孔适用范围广、操作简单、转染效率高,但是仍然存在许多缺陷。电穿孔技术只适用于体外使用,且在制备过程中造成不可逆的细胞损伤,导致细胞增殖能力和活力显著降低[4]。因此,亟需开发更为安全有效的新型t细胞基因转染策略,这对于推动car-t进一步发展具有重要临床意义。
4、脂质纳米粒(lipid nanoparticle,lnp)是一类新型脂质类非病毒载体,因安全性和有效性受到越来越多的关注。目前fda已批准三款lnp药物上市,包括1款sirna药物(onpattro)和2款mrna疫苗(bnt162b2和mrna-1273)。lnp已经被证明在多种细胞上发挥较好的基因递送效果,但其在car-t细胞构建中的应用仍然较少。
5、目前相关研究多是利用lnp将car-mrna递送进入t细胞用于瞬时表达car分子。例如,daniel j.siegwart研究团队利用脾脏靶向的sort脂质纳米颗粒递送cd19 car-mrna在小鼠体内原位构建car-t,脾脏内t细胞阳性率为7%[5]。michael j.mitchell研究团队通过筛选新型可离子化脂质库得到一种能够高效将car-mrna递送至原代人t细胞的脂质纳米颗粒,转染效率与电转染效率相当,且细胞存活率(>75%)显著优于电穿孔(31%)[6]。许巧兵研究团队设计合成了一类含有咪唑头基的可离子化脂质,通过筛选优化得到最佳脂质纳米颗粒处方并用于体内递送cre-mrna,t细胞阳性率约为8%[7]。宾夕法尼亚大学jonathan aepstein团队使用cd5靶向的脂质纳米粒子递送优化后的fap car-mrna,用于体内生产瞬时表达的car-t细胞,转染48h后的t细胞阳性率约为80%[8]。虽然许多研究表明lnp在将mrna递送进入t细胞方面表现出较好的效果,但是mrna只能在细胞内瞬时表达,目标蛋白表达会在几天内迅速下降到低水平,所以通常需要重复给药来维持长期抗肿瘤效果,而这种长期给药可能会造成不可预估的细胞毒性。
6、转座子质粒系统是一种能够实现稳转的基因载体,它通常由一个携带car(转座子)的质粒和一个携带转座子酶的质粒组成,可以通过安全有效的基因组整合来可实现持续高效的转基因表达。转座子质粒制备简单,价格低廉,安全性高,已经为一系列基因疾病提供了创新和潜在的治疗方案。目前已有研究报道利用lnp递送转座子质粒系统用于稳转car-t的构建,但是其体外转染效率最高仅有4.57%[7],无法满足疾病治疗的需要。转染效率低下是目前阻碍lnp递送质粒进入t细胞构建car-t的巨大瓶颈,其主要原因包括以下三个:(1)lnp难以有效进入t细胞:lnp被内吞进入t细胞是发挥转染作用的前提,但是t细胞作为一种非吞噬性淋巴细胞,难以吞噬外源性物质,从而限制lnp进入t细胞发挥转染作用[9];(2)内体逃逸效率不足:基因药物需要从内体中逃逸进入胞质才能避免被降解或外排,但目前报道的lnp内体逃逸效率不超过15%,内体逃逸困难是目前影响lnp转染效率的关键因素[10];(3)质粒入核难:用于稳转构建car-t细胞的转座子质粒体积较大,难以入核进行转录表达。
7、参考文献:
8、[1]lu j,jiang g.the journey of car-t therapy in hematologicalmalignancies[j].mol cancer,2022,21(1):194.
9、[2]michels a,ho n,buchholz c j.precision medicine:in vivo car therapyas a showcase for receptor-targeted vector platforms[j].mol ther,2022,30(7):2401-15.
10、[3]high k a,roncarolo m g.gene therapy[j].n engl j med,2019,381(5):455-64.
11、[4]ditommaso t,cole j m,cassereau l,et al.cell engineering withmicrofluidic squeezing preserves functionality of primary immune cells invivo[j].proc natl acad sci u s a,2018,115(46):e10907-e14.
12、[5]alvarez-benedicto e,tian z,chatterjee s,et al.spleen sort lnpgenerated in situ car t cells extend survival in a mouse model oflymphoreplete b cell lymphoma[j].angew chem int ed engl,2023,62(44):e202310395.
13、[6]billingsley m m,singh n,ravikumar p,et al.ionizable lipidnanoparticle-mediated mrna delivery for human car t cell engineering[j].nanolett,2020,20(3):1578-89.
14、[7]zhou j e,sun l,jia y,et al.lipid nanoparticles produce chimericantigen receptor t cells with interleukin-6knockdown in vivo[j].j controlrelease,2022,350:298-307.
15、[8]rurik j g,tombacz i,yadegari a,et al.car t cells produced in vivoto treat cardiac injury[j].science,2022,375(6576):91-6.
16、[9]olden b r,cheng e,cheng y,et al.identifying key barriers incationic polymer gene delivery to human t cells[j].biomater sci,2019,7(3):789-97.
17、[10]wittrup a,ai a,liu x,et al.visualizing lipid-formulated sirnarelease from endosomes and target gene knockdown[j].nat biotechnol,2015,33(8):870-6.
技术实现思路
1、针对现有技术的缺陷,发明人经过广泛而深入的研究,构建了一种药物组合物包括递送载体和核酸表达载体,该药物组合物能够介导外源基因高效转染入宿主细胞中,且核酸表达载体在宿主细胞中能够高效稳定的表达。
2、为解决上述问题,本技术所采取的技术方案为:
3、一方面,本发明提供一种药物组合物,所述药物组合物包括递送载体和核酸表达载体,其中,
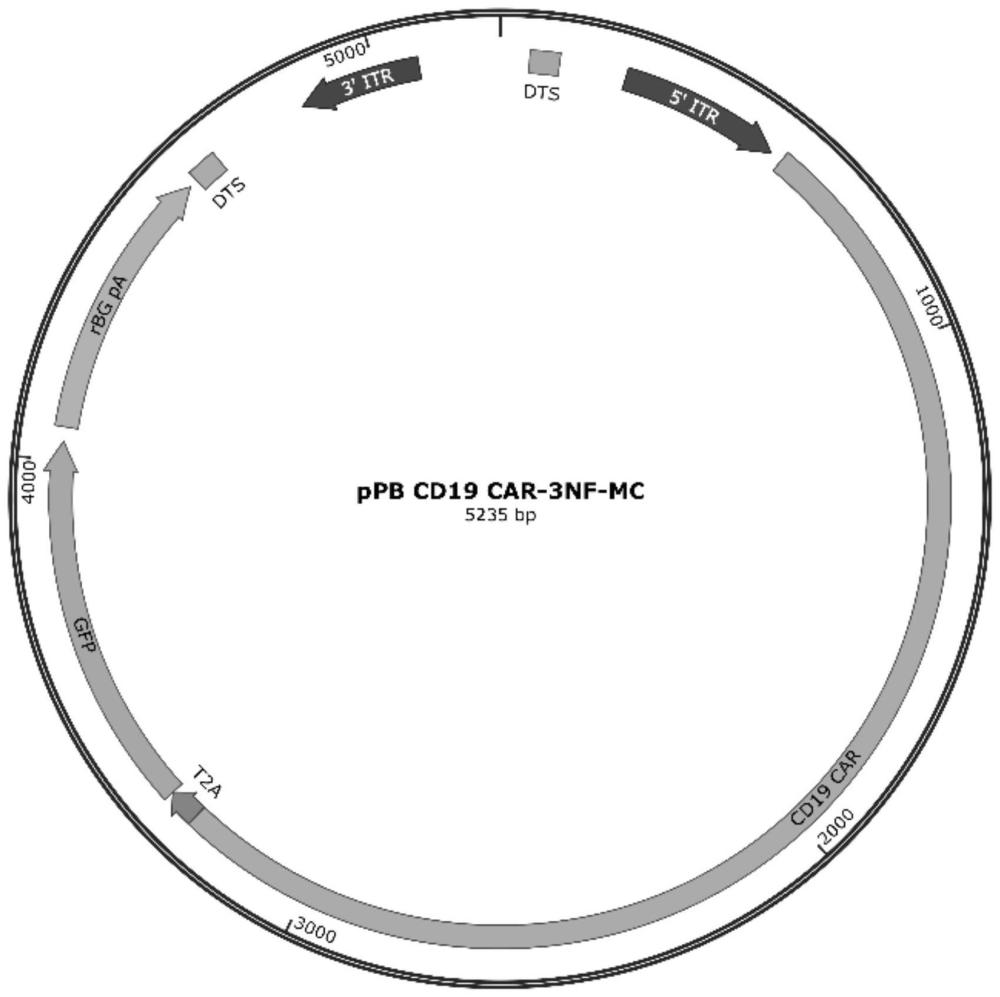
4、所述核酸表达载体包括以下元件:转座子5’末端重复序列、启动子、编码外源受体序列、核靶向序列及转座子3’末端重复序列;所述核靶向序列选自nfκb核靶向序列、糖皮质激素响应元件序列和sv40增强子序列中的一种或多种;
5、所述递送载体包括金刚烷尾链脂质、可离子化脂质、中性磷脂、胆固醇和聚乙二醇化脂质,其中,所述中性磷脂选自二油酰基磷脂酰乙醇胺,
6、所述金刚烷尾链脂质选自式(ad8)所示的化合物,
7、
8、所述可离子化脂质选自式(a7)所示的化合物,
9、
10、优选地,所述聚乙二醇化脂质,其尾链为长度为c6-c20的饱和或不饱和烷烃链。
11、进一步优选地,所述聚乙二醇化脂质选自1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000、胆固醇-聚乙二醇2000、聚乙二醇2000丁二酸双十四醇酯中的一种或多种。
12、更进一步优选地,所述聚乙二醇化脂质选自聚乙二醇2000丁二酸双十四醇酯(peg2000-suc-ta2),其结构式如下:
13、
14、进一步优选地,所述递送载体包括式(ad8)所示的化合物、式(a7)所示的化合物、二油酰基磷脂酰乙醇胺、胆固醇和聚乙二醇2000丁二酸双十四醇酯。
15、优选地,所述金刚烷尾链脂质、所述可离子化脂质、所述中性磷脂、所述胆固醇和所述聚乙二醇化脂质的摩尔比为10~20:10~20:10~20:30~50:0.5~5。
16、进一步优选地,所述金刚烷尾链脂质、所述可离子化脂质、所述中性磷脂、所述胆固醇和所述聚乙二醇化脂质的摩尔比为12~18:12~18:12~20:40~50:1~3。
17、更进一步优选地,所述金刚烷尾链脂质、所述可离子化脂质、所述中性磷脂、所述胆固醇和所述聚乙二醇化脂质的摩尔比为15:15:18:50:2。
18、优选地,所述核靶向序列选自nfκb核靶向序列,所述nfκb核靶向序列包括第一序列和第二序列,
19、其中,所述第一序列的核酸序列包括下列中的任一组:
20、(1)seqid no:1所示的多核苷酸序列;
21、(2)与seqid no:1所示的多核苷酸序列有≥95%同一性;或,
22、(3)与(1)~(2)中任一项部分互补或完全互补的多核苷酸序列;
23、所述第二序列的核酸序列包括下列中的任一组:
24、(4)seqid no:8所示的多核苷酸序列;
25、(5)与seqid no:8所示的多核苷酸序列有≥95%同一性;或,
26、(6)与(4)~(5)中任一项部分互补或完全互补的多核苷酸序列。
27、优选地,所述第一序列和所述第二序列是分开的。
28、优选地,所述第一序列位于所述转座子5’端重复序列的上游。
29、优选地,所述第二序列位于所述转座子3’末端重复序列的上游。
30、优选地,所述启动子选自cmv启动子、minicmv启动子、cmv53启动子、minisv40启动子、minitk启动子、mlp启动子、pjb42cat5启动子、yb_tata启动子、ef1α启动子、sv40启动子、ubiquitinb启动子、cag启动子、hsp70启动子、pgk-1启动子、β-actin启动子、tk启动子和grp78启动子中的一种或多种。
31、进一步优选地,所述启动子为cmv启动子和/或ef1α启动子。
32、更进一步优选地,所述所述启动子为ef1α启动子。
33、再进一步优选地,所述ef1α启动子的核酸序列如seqid no:3所示;
34、优选地,所述外源受体包括非天然存在受体,所述非天然存在受体为嵌合抗原受体,所述嵌合抗原受体靶向于选自以下各靶标结合蛋白中的一种或多种:cd19、cd7、cd20、cd22、cd23、cd30、cd33、cd38、cd44v7/8、cd123、cd133、cd138、cd171、afp、bcma、cil-1、cs-1、cea、ca125、ca199、cldn18.2、epcam、egfr、egfrvⅲ、fap、gpc1、gpc3、her2、il-13ra2、整合素β7、fr、tag-72、muc1、msln、nectin-1、ny-eso-1、gd2、gucy2c、gmr、psma、gp100、vfgfr1、vfgfr2。
35、进一步优选地,所述嵌合抗原受体靶向于选自以下各靶标结合蛋白中的一种或多种:cd19、bcma、cldn18.2、msln、gpc3、her2、gd2、psma、muc1、gucy2c、cd22、cd7、cd20、cd30、cd123、cd33。
36、更进一步优选地,所述嵌合抗原受体靶向于cd19靶标结合蛋白。
37、再进一步优选地,所述编码cd19的核酸序列如seqid no:4所示。
38、优选地,所述转座子5’末端重复序列如seqid no:2所示。
39、优选地,转座子3’末端重复序列如seqid no:9所示。
40、优选地,所述核酸表达载体还包括转录终止序列,所述转录终止序列如seqid no:7所示。
41、优选地,所述核酸表达载体还包括编码连接子的核酸序列,编码所述连接子的序列如seqid no:5所示。
42、优选地,所述核酸表达载体的核酸序列如seqid no:10所示。
43、优选地,所述药物组合物还包括能够表达转座酶的载体。
44、另一方面,本发明提供根据上述任一项所述药物组合物在预防和/或治疗癌症相关疾病药物中的用途。
45、优选地,所述癌症为恶性血液瘤和/或实体瘤。
46、发明的效果
47、本发明提供的药物组合物具有入核能力更强、整合效率更高以及转染效率更高等优点。其能够更进一步地显著提高外源基因整合到目的细胞(如免疫效应细胞)中的比例,还提高了外源基因转染t细胞效率,同时利用本发明提供的药物组合物构建的car-t具有较强的靶细胞杀伤能力,为细胞治疗提供了一种新的基于非病毒载体的工具和手段。
- 还没有人留言评论。精彩留言会获得点赞!