一种聚甘露糖修饰脂质分子及其应用
本发明涉及医药,具体涉及一种聚甘露糖修饰脂质分子及其在制备脂质纳米颗粒中的应用。
背景技术:
1、脂质纳米颗粒(lipid nanoparticles,lnp)是一种多组分系统,通常由可电离脂质或阳离子类脂质化合物、辅助脂质、胆固醇、保护剂聚乙二醇-脂质共轭物组成。脂质纳米颗粒的制备取决于自组装能力,即脂质成分发生分子间相互作用而自发组织成纳米结构实体。脂质作为一类两亲性(amphipathic)生物分子,当掺入药物产品时,它们表现出理想的安全性和药代动力学特征。近年来,递送mrna核酸分子的lnp疫苗被广泛研究。裸露的rna是一种带负电荷的亲水性大分子,由于细胞膜的静电排斥,难以进入细胞,且易被体内rna酶迅速降解。利用脂质囊泡包封rna可通过细胞膜并将rna释放到细胞质中。
2、聚乙二醇修饰脂质体后可在脂质体表面形成构象云和水化膜,为脂质体提供较大的空间位阻并掩盖其表面疏水性的结合位点,从而减少体内肝脾等单核巨噬系统的识别和摄取,显著延长脂质体的体内循环时间。然而当间隔几天向同一动物体内重复静脉注射聚乙二醇化脂质体(pegylated liposomes,peg-l)时会出现加速血液清除(acceleratedblood clearance)现象。另外,聚乙二醇对细胞具有一定的毒性;多次注射含有聚乙二醇药物后,聚乙二醇的免疫原性容易引起明显的体液免疫反应,导致聚乙二醇化脂质体纳米颗粒应用范围受限。
3、此外,通用的脂质体纳米颗粒在特异性免疫细胞转染和特异性器官转染上仍有待于改进。目前,脂质体纳米颗粒靶向递送到肝脏的研究方面取得了不错的进展,装载mrna的脂质纳米粒静脉注射后主要在肝脏表达,mrna在脾脏等免疫器官的表达不足限制了mrna肿瘤疫苗的免疫活性,提示脂质体作为mrna疫苗递送载体仍需要进一步改造。
4、脾脏是机体最大的外周免疫器官,具有造血、贮血和过滤作用,也是接受抗原刺激产生免疫应答的场所。脾内定居着大量淋巴细胞和其他免疫细胞,抗原进入脾脏之后,可被抗原提呈细胞摄取并提呈给t细胞,诱导t细胞活化和增殖,产生致敏t淋巴细胞。由于90%左右的循环血液要经过脾,因此利用靶向递送技术将经静脉注射的肿瘤抗原递至脾脏,通过诱导快速的抗肿瘤免疫应答,发挥高效地抗肿瘤作用成为可能。
5、因此,开发对于免疫细胞具有高效且特异性转染能力的新脂质体纳米颗粒递送系统对于疫苗开发和嵌合抗原受体t细胞(car-t)治疗技术的提高有着重要意义。
技术实现思路
1、本发明的目的在于提供一种新的两亲性脂质分子,该脂质分子作为药物递送载体能够靶向肝外组织如脾脏等免疫细胞高效递送药物,通过激活免疫应答,增强药物的预防或治疗效果。
2、为实现上述目的,本发明采用如下技术方案:
3、本发明提供了一种聚甘露糖修饰脂质分子,结构通式如式(ⅰ)所示:
4、
5、其中n为10~50,r为单链烷氧基或胺基,或者为双链烷氧基或胺基。
6、所述聚甘露糖修饰脂质分子包括聚甘露糖和脂肪链两部分。
7、作为细胞膜的组分,糖类常作为受体分布于细胞膜的表面传导信号,其在细胞与细胞间的相互作用以及在细胞黏附促进的各种分子识别中发挥着重要的作用。本发明设计的聚甘露糖脂是由脂肪链作为疏水端,多个重复糖基部分作为亲水段组成的糖脂衍生物,聚合度为10~50。聚甘露糖脂选择的单体糖是甘露糖,甘露糖作为天然单糖的一种,生物相容性好。合成得到的聚甘露糖脂是无毒无害的,还容易进行生物降解。本发明提供的聚甘露糖脂可用于制备脂质体纳米颗粒,该成分在插入到脂质体纳米颗粒以后,可以稳定脂质体纳米颗粒的结构,避免脂质体纳米颗粒聚集。
8、优选的,r为碳原子数为8~18的单链烷氧基或胺基,或者为碳原子数为16~36的双链烷氧基或胺基。
9、作为本发明的一些具体实例,所述聚甘露糖修饰脂质分子为以下结构式(ⅱ)-(ⅴ)中的任意一种:
10、
11、上述结构式中n为10~50。
12、本发明还提供了制备所述聚甘露糖修饰脂质分子的方法,制备方法包括:在氟化硼乙醚的催化条件下,乙酰化甘露糖和甲基丙烯酸羟乙酯反应制得甲基丙烯化的乙酰化甘露糖;在碱性条件下水解反应得到甲基丙烯化甘露糖;然后利用带有脂质分子的链转移剂通过可逆加成-断裂链转移聚合法或者利用带有脂质分子的链引发剂通过原子转移自由基聚合法对甲基丙烯化甘露糖聚合制得所述聚甘露糖修饰脂质分子。
13、本发明还提供了一种脂质纳米颗粒,所述脂质纳米颗粒的原料组成包括:可电离脂质或阳离子类脂质化合物、辅助脂质、胆固醇,以及聚甘露糖修饰脂质分子,所述原料通过自组装形成脂质纳米颗粒。
14、本发明以聚甘露糖修饰脂质分子代替传统的聚乙二醇-脂质,与可电离脂质或阳离子类脂质化合物、辅助脂质、胆固醇混合自组装制备脂质纳米颗粒。所述脂质纳米颗粒的制备方法可以采用但不限于:乙醇注入法、薄膜法、超声法。具体来说,制备包载药物的脂质纳米颗粒时,采用上述方法使脂质材料与待包载药物在酸性缓冲液中通过超分子作用力和静电相互作用,自组装形成纳米颗粒。
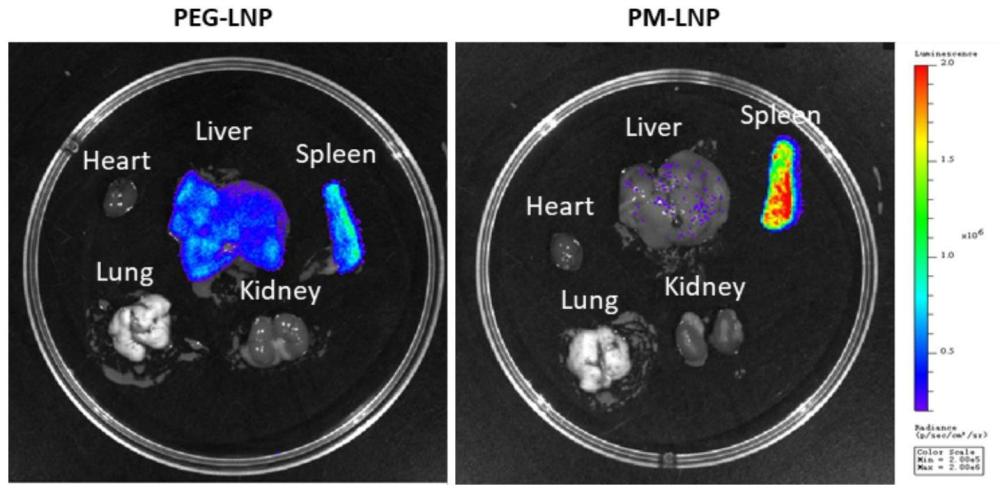
15、本发明中,聚甘露糖部分暴露于脂质体纳米颗粒表面,赋予了脂质体纳米颗粒靶向免疫细胞的能力。动物实验表明,本发明提供的脂质体纳米颗粒经静脉给药后能够高效且特异性转染到脾脏区域。本发明为脂质体纳米颗粒作为优异的免疫细胞和免疫器官转染疫苗递送系统提供了条件。
16、进一步的,所述可电离脂质可以为但不限于为sm-102(cas:2089251-47-6)、alc-0315(cas:2036272-55-4)、dlin-mc3-dma(cas:1224606-06-7)。
17、所述辅助脂质为二硬脂酰磷脂酰胆碱(dspc)或1,2-二油酰基卵磷脂(dope)。
18、进一步的,可电离脂质或阳离子类脂质化合物、辅助脂质、胆固醇和聚甘露糖修饰的脂质分子的摩尔比为45-55:5-15:35-45:0.1-2。优选的,可电离脂质、辅助脂质、胆固醇和聚甘露糖修饰的脂质分子的摩尔比为50:10:38.5:1.5,该配比条件下自组装形成的脂质纳米颗粒粒径分布均一,稳定性好,药物包封率高。
19、本发明还提供了所述的脂质纳米颗粒作为载体在制备递送小分子药物或核酸的药物中的应用。
20、本发明提供的脂质体可以很好地包封疏水性小分子药物,构建优异的小分子药物递送体系。所述小分子药物可以为但不限于阿霉素(dox)、紫杉醇(ptx)或喜树碱(cpt)等。
21、所述核酸可以为但不限于信使核糖核酸(mrna)、小干扰核糖核酸(sirna)或微小核糖核酸(mirna)。
22、进一步的,所述应用包括:将可电离脂质或阳离子类脂质化合物、辅助脂质、胆固醇和聚甘露糖修饰脂质分子加入到含有小分子药物或核酸的缓冲液中,自组装形成包载小分子药物或核酸的脂质纳米颗粒,制得所述递送核酸药物。
23、进一步的,所述递送药物为靶向脾脏的药物。相较于传统的聚乙二醇修饰脂质体纳米颗粒,本发明提供的脂质纳米颗粒能够靶向脾脏区域递送药物。
24、进一步的,所述递送核酸药物为mrna疫苗。所述mrna为包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,该mrna化合物包封在脂质纳米颗粒中。
25、进一步的,所述核酸为可编码细胞因子的mrna,所述mrna为包含编码至少一种细胞因子的mrna序列的mrna化合物,该mrna化合物包封在脂质纳米颗粒中。
26、进一步的,所述递送小分子药物为化疗药物,该小分子药物包封在脂质纳米颗粒中。
27、本发明研究表明,相较于传统的聚乙二醇修饰脂质体纳米颗粒,本发明提供的脂质纳米颗粒作为载体负载编码ova的mrna制备的药物,其抗肿瘤活性显著提高。
28、本发明具备的有益效果:
29、本发明利用聚甘露糖脂代替传统脂质体纳米颗粒中的聚乙二醇或聚乙二醇衍生物,制备的脂质体纳米颗粒具有无毒、药物包封率高和稳定性好等优势,可高效递送疏水性小分子药物或核酸等药物,系统给药后能够明显降低在肝脏区域的转染,并显著提高在脾脏区域的转染,具备优异的化疗药物或核酸疫苗递送系统开发潜力。
- 还没有人留言评论。精彩留言会获得点赞!