口腔鳞癌相关生物标志物及诊断和治疗方法与流程
本发明属于生物医药领域,涉及口腔鳞癌相关生物标志物及诊断和治疗方法。
背景技术:
1、口腔鳞状细胞癌(oral squamous cell carcinoma,oscc)是一种易于转移的上皮源性恶性肿瘤。近些年来,口腔鳞状细胞癌的全球发病率呈明显增长趋势,并且发病年龄逐渐年轻化,但发病趋势改变的原因尚未明了。尤其在发展中国家地区,其发病率增长速度是尤为凸显(wang f,zhang h,wen j,et al.nomograms forecasting long-term overalland cancer-specific survival ofpatients with oral squamous cell carcinoma[j].cancer med.2018;7(4):943-952.)。
2、随着影像学,外科手术的改进,放疗和传统治疗的进步,目前oscc的治疗方法主要是手术切除,化疗和放疗或者是这三种方法联合治疗(kim sm,jeong d,min kk,et al.twodifferent protein expression profiles of oral squamous cell carcinomaanalyzed by immunoprecipitation high-performance liquid chromatography[j].world journal ofsurgical oncology.2017;15(1):151.)。虽然治疗方式在不断改进,但因为口腔的手术会密切接触到重要的组织和器官,严重制约了手术的范围。另外,领面部组织血管和神经丰富,颈部淋巴结转移和侵袭发生率高,预后差,近年来5年生存率并没有明显增加(50%-60%左右)。晚期肿瘤或者肿瘤复发患者的5年生存率更低(radhika t,jeddyn,et al.salivary biomarkers in oral squamous cell carcinoma-an insight[j].journal of oral biology&craniofacial research 2016,6(suppl 1):s51-54.)。有研究发现,部分开始手术切除干净的晚期oscc患者,存活时间也有低于30个月(felice fd,polimeni a,et al.radiotherapy controversies and prospective in head and neckcancer:aliterature-based critical review[j].neoplasia 2018;20(3):227-232.)。另外,患者的5年生存率还与肿瘤的位置、阶段、患者年龄及是否有基础疾病都有相关性。因此,对于oscc来说,找到具有分子诊断、预测预后和靶向治疗的肿瘤标记物对于肿瘤的治疗具有重要意义,也是未来的发展方向。深入了解oscc的发生发展、侵袭和转移机制,揭示oscc的促癌基因和抑癌基因,有利于完善和补充口腔鳞癌的治疗手段,具有重要的临床意义。
技术实现思路
1、为了弥补现有技术的不足,本发明研究了在口腔鳞癌中呈现差异表达的基因,并通过进一步的细胞实验探究了差异表达基因对癌细胞的影响,从而为口腔鳞癌的诊断和治疗提供了检测和靶向位点,同时对于揭示口腔鳞癌的发病机制提供了理论。
2、本发明采用了如下技术方案:
3、本发明的一方面提供了一种诊断口腔鳞癌的生物标志物,所述生物标志物选自linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5、ap000695.6的一种或几种。
4、进一步,相比正常(癌旁)样本,所述生物标志物在口腔鳞癌中表达显著上调。
5、本发明第二方面提供了本发明第一方面所述的生物标志物和/或其表达产物或特异性检测本发明第一方面所述的生物标志物和/或其表达产物试剂的用途,用于制备诊断口腔鳞状细胞癌的产品。
6、进一步,所述试剂选自:特异性扩增rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5和/或ap000695.6的引物;或特异性识别rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5和/或ap000695.6基因的探针。
7、进一步,特异性扩增rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5和/或ap000695.6基因的引物序列分别如seq id no.1~14所示。
8、本发明的第三方面提供了一种诊断口腔鳞状细胞癌的产品,所述产品包括检测本发明第一方面所述的生物标志物的试剂。
9、进一步,所述产品包括芯片、试剂盒或试纸条。其中,所述芯片包括固相载体以及固定在固相载体的寡核苷酸探针,所述寡核苷酸探针包括用于检测生物标志物表达水平的针对生物标志物的寡核苷酸探针;所述试剂盒包括用于检测生物标志物的表达水平的引物、探针或芯片。
10、进一步,所述试剂盒还包括使用说明书或标签、阳性对照物、阴性对照物、缓冲剂、助剂或溶剂;所述说明书或标签注明所述试剂盒用于检测口腔鳞癌。
11、进一步,所述试剂包括通过反转录pcr、实时定量pcr、原位杂交或基因芯片检测本发明所述的生物标志物的试剂。
12、进一步,通过反转录pcr检测本发明所述的生物标志物的试剂至少包括一对特异性扩增所述生物标志物的引物;通过实时定量pcr检测本发明所述的生物标志物的试剂至少包括一对特异性扩增所述生物标志物的引物;通过原位杂交检测本发明所述的生物标志物的试剂包括与所述生物标志物的核酸序列杂交的探针;通过基因芯片检测本发明所述的生物标志物的试剂包括与所述生物标志物的核酸序列杂交的探针。
13、本发明的第四方面提供了本发明第一方面所述的生物标志物在制备治疗口腔鳞癌的药物组合物中的用途。
14、进一步,所述药物组合物包括所述生物标志物功能性表达的抑制剂。
15、进一步,所述抑制剂降低所述一种或多种生物标志物的表达水平。
16、进一步,所述抑制剂选自gapmer、干扰rna、crispr、talen或锌指核酸酶。
17、进一步,所述抑制剂选自干扰rna。
18、在本发明的具体实施方式中,干扰rna为sirna,在本发明中,rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5和/或ap000695.6的sirna的序列分别如seq id no.17-18、seq id no.19-20、seq id no.21-22、seq id no.23-24、seq id no.25-26、seq id no.27-28、seq id no.29-30所示。
19、本发明的第五方面提供了一种药物组合物,所述药物组合物包括本发明第一方面所述的生物标志物的功能性表达的抑制剂。
20、进一步,所述抑制剂降低所述一种或多种生物标志物的表达水平。
21、进一步,所述抑制剂选自gapmer、干扰rna、crispr、talen或锌指核酸酶。
22、进一步,所述抑制剂选自干扰rna。
23、在本发明的具体实施方式中,干扰rna为sirna,所述sirna具有如上所述的seq idno.17~30序列。
24、进一步,所述药物组合物还包括药学上可接受的载体。
25、本发明的第六方面提供了本发明第一方面所述的生物标志物在筛选治疗口腔鳞癌的候选药物的用途。
26、进一步,筛选候选药物的步骤如下:
27、(1)用待筛选物质处理表达或含有本发明第一方面所述生物标志物的体系;和
28、(2)检测所述体系中所述生物标志物的表达水平;
29、若所述待筛选物质可降低所述生物标志物的表达水平,则表明该待筛选物质为预防或治疗口腔鳞状细胞癌的候选药物。
30、进一步,所述的候选物质包括(但不限于):针对所述生物标志物或其上游或下游基因的干扰分子、核酸抑制物、结合分子、小分子化合物等。
31、本发明的第七方面提供了一种筛选预防或治疗口腔鳞状细胞癌的候选药物的方法,所述方法包括:
32、(1)用待筛选物质处理表达或含有本发明第一方面所述的生物标志物的体系;和
33、(2)检测所述体系中生物标志物的表达水平;
34、若所述待筛选物质可降低所述生物标志物的表达水平,则表明该待筛选物质为预防或治疗口腔鳞状细胞癌的候选药物。
35、本发明的第八方面提供了一种抑制肿瘤细胞增殖的方法,将本发明第一方面所述的生物标志物的抑制剂导入到肿瘤细胞中。
36、进一步,所述抑制剂包括针对所述生物标志物的sirna、shrna、反义寡核苷酸或功能缺失型基因。
37、本发明的第九方面提供了一种诊断口腔鳞癌的方法,所述方法包括:检测受试者样本中本发明第一方面所述的生物标志物的表达水平。
38、若与正常人相比,受试者样本中rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5、ap000695.6的至少一个表达显著升高,则该受试者被诊断为口腔鳞癌患者。
39、进一步,所述方法包括:
40、(1)收集受试者样本;
41、(2)提取受试者样本中的rna,检测本发明第一方面所述的生物标志物的表达水平;
42、(3)与正常人相比,受试者样本中ip11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5、ap000695.6的至少一个表达显著升高,则该受试者被诊断为口腔鳞癌患者。
43、本发明的第十方面提供了一种预防或治疗口腔鳞癌的方法,所述方法包括:对受试者施用药学有效量的针对本发明第一方面所述的生物标志物的抑制剂。
44、进一步,所述抑制剂降低所述一种或多种生物标志物的表达水平。
45、进一步,所述抑制剂选自gapmer、干扰rna、crispr、talen或锌指核酸酶。
46、进一步,所述抑制剂选自干扰rna。
47、进一步,所述干扰rna的序列选自seq id no.17~30。
48、本发明的另一方面提供了一种抑制肿瘤细胞增殖的方法,所述方法为将rp11-875o11.3基因的下调剂在体外导入到肿瘤细胞中。
49、进一步,所述下调剂包括将针对rp11-875o11.3基因的sirna、shrna、反义寡核苷酸或功能缺失型基因。
50、本发明还提供本发明第一方面所述的生物标志物在构建诊断口腔鳞癌的计算模型、制备包含诊断口腔鳞癌计算模型的系统/装置/设备/可读存储介质中的应用。
51、具体的实施方式
52、本发明经过深入的研究,首次发现了口腔鳞癌组织中rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5、ap000695.6基因的表达显著高于正常粘膜组织,并且实验证明了rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5、ap000695.6在口腔鳞癌细胞中也呈现高表达,下调rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5、ap000695.6的表达水平可以抑制口腔鳞癌细胞的增殖和侵袭,提示rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5、ap000695.6可作为诊断和治疗的靶标应用于临床。
53、本发明中的lncrna包括野生型、突变型或其片段,只要进行序列比对时可以将其比对到所述基因即可。目前已经公开的rp11-875o11.3存在两个转录本,序列分别如enst00000520840.1和enst00000523806.1所示。在本发明的具体实施方式中,所述rp11-875o11.3的序列如enst00000520840.1所示。目前已经公开的linc01679存在一个转录本,序列如nr_131902.1所示。目前已经公开的ap000695.4存在两个转录本,序列分别如enst00000428667.1和enst00000454980.1所示。在本发明的具体实施方式中,所述ap000695.4的序列如enst00000428667.1所示。目前已经公开的rp11-339b21.10存在一个转录本,序列如enst00000610052.1所示。目前已经公开的rp11-426c22.4存在一个转录本,序列如enst00000566070.1所示。目前已经公开的rp11-426c22.5存在两个转录本,序列分别如enst00000562902.1和enst00000563477.1所示,在本发明的具体实施方式中,所述rp11-426c22.5的序列如enst00000562902.1所示。目前已经公开的ap000695.6存在一个转录本,序列如enst00000429588.1所示。
54、本发明中所使用的“标志物”及“生物标志物”可混用,以便于指称个体中正常或异常进展的指征或个体中疾病或其他状态的指征或表现这些的靶分子。更详细地,“标志物”或“生物标志物”为正常或异常,以及若是异常,则为与慢性或急性的特定生理学状态或进展的存在相关的解剖学、生理学、生物化学或分子学参数。生物标志物可通过包括实验室检测和医学成像的多种方法来进行检测及测定。
55、本发明中所使用的“生物标志物值”、“值”、“生物标志物水平”及“水平”为利用从生物样本检测生物标志物的任意分析方法来进行测定,并且,在上述生物样本中,为了指称表示生物标志物的、用于生物标志物的、或对应于生物标志物的存在、不存在,绝对量或浓度、相对量或浓度、滴定量、水平、表达水平、测定的水平的比率等的测定值而混用。
56、“进行诊断”、“诊断的”、“诊断”及这些术语的变化型是指基于与个体相关的一个或其以上的征兆、症状、数据或其他信息,来对个体的健康状态或状况的发现、判断或认知。个体的健康状态可被诊断为健康的/正常的(即,不存在疾病或疾患),或者可被诊断为不健康的/异常的(即,存在疾病或疾患或特性的评估)。上述术语“进行诊断”、“诊断的”、“诊断”等包括与特定疾病或疾患相关地,疾病的早期发现;疾病的特性或分类;疾病的进展、治愈或复发的发现;个体的处置或治疗后,对疾病的反应的发现。口腔鳞癌的诊断包括不患有癌的个体与患有癌的个体的区别。
57、当生物标志物为表示个体中的异常性进展或疾病或其他状态或其标记时,该生物标志物通常表示个体中的正常性进展或疾病或其他状态的不存在,或与作为它的标记的生物标志物的表达水平或值相比较,表现为过高表达或过低表达中一种。“上调”、“经上调的”、“过表达”及该表现的变化型是为了指比典型性地从类似于健康的或正常的个体的生物样本中检测到的生物标志物的值或水平(或值或水平的范围)更高的生物样本中的生物标志物值或水平而混用。多个上述术语还可指比可在特定疾病的互不相同的步骤中检测到的生物标志物的值或水平(或值或水平的范围)更高的生物样本中的生物标志物值或水平。
58、“下调”、“低表达的”及该表现变化型是为了指比典型性地从健康的或正常性的个体的类似的生物样本检测到的生物标志物的值或水平(或值或水平的范围)更小的生物样本中的生物标志物值或水平而混用。多个上述术语还可指比能够从特定疾病的互不相同的步骤中检测到的生物标志物的值或水平(或值或水平的范围)更小的生物样本中的生物标志物值或水平。
59、并且,经过高表达或经过低表达的生物标志物可被称为个体中的正常性进展或疾病或其他状态的不存在的表示,或者与表现其的生物标志物的“正常性的”表达水平或值相比较,具有“差异性地表达”或“差异性的水平”或“差异性的值”。因此,生物标志物的“差异性的表达”还能够以生物标志物的“正常性的”表达水平的变化来被表现。
60、所谓“差异性的基因表达”及“差异性的表达”的术语是为了指与正常对象或对照对象中的表达相比,在具有特定疾病的对象中以更高或更低的水平来进行表达活性化的基因而混用。上述术语还包含在相同疾病的互不相同的步骤中以高水平或低水平来进行表达活性化的基因。差异性的基因表达可包括两个或其以上的基因或它们的基因产物之间的表达的比较;或者两个或其以上的基因或它们的基因产物之间的表达比率的比较;或者反而正常受试者与患有疾病的受试者之间或相同疾病的多种阶段之间不同的、相同基因的以不同的方式处理的两个产物的比较。差异性的表达包括例如,在正常的及患病的细胞,或经历互不相同的疾病事件或疾病阶段的多个细胞之间的基因或它们的表达产物中,根据时间的或细胞性表达模式中的定量差异及定性差异。
61、本发明可以利用本领域内已知的任何方法测定基因表达。本领域技术人员应当理解,测定基因表达的手段不是本发明的重要方面。为了检测基因的表达,可使用多个互不相同的检测方法,例如,杂交测定、质量分析或实时荧光定量核酸扩增检测等的检测方法。在某些实施例中,核酸碱基序列分析方法可用于检测基因序列,且检测生物标志物值。关于本文中提及的lncrna基因产物“增加的”水平,指比正常存在的更高的水平。通常,这可通过与对照比较来估计。根据特定的实施方案,lncrna增加的水平是比对照高10%、20%、25%、30%、40%、50%、60%、70%、75%、80%、90%、100%、150%、200%或甚至更高的水平。根据另一个特定的实施方案,意指lncrna基因产物表达或存在,而其在正常情况下(或在对照中)缺失。换句话说,在这些实施方案中,测定lncrna基因产物增加的表达相当于检测lncrna基因产物的存在。通常,该这种情况下,将包括对照以确保检测反应正确进行。关于lncrna的“功能性表达”,意指功能性基因产物的转录和/或翻译。对于像lncrna的非蛋白编码基因,“功能性表达”可以在至少两个水平上失调。第一,在dna水平上,例如通过基因的缺失或破坏,或者是没有转录发生(在两种情况下都阻止相关基因产物的合成)。转录的缺失可以例如由表观遗传的变化(例如dna甲基化)或由功能缺失性突变导致。
62、第二,在rna水平上,例如通过缺乏有效的翻译-例如因为mrna的不稳定(例如通过utr变体),可以导致在转录物翻译之前mrna被降解。或者通过缺乏有效的转录,例如因为突变诱导了新的剪接变体。
63、据此,本发明的一个目的是,提供lncrna基因功能性表达的抑制剂。这种抑制剂可在dna水平上或在rna(即基因产物)水平上起作用。由于lncrna是非编码基因,该基因没有蛋白质产物。
64、如果在dna水平上实现抑制,可以通过使用基因治疗敲除或破坏靶标基因来进行。如本文中所使用的,“敲除”可以是基因敲低,或可以将基因敲除,通过使用本领域所知的技术,包括但不限于,逆转录病毒基因转移,造成突变,例如点突变、插入、删除、移码、或错义突变。可以将基因敲除的另一方式是,使用锌指核酸酶。锌指核酸酶(zfn)是通过将锌指dna结合结构域与dna切割结构域融合而产生的人工限制性酶。可以对锌指结构域进行改造以靶向目的dna序列,这可使锌指核酸酶靶向复杂基因组中的独特序列。通过利用内源的dna修复机制,这些试剂可用于精确改变高等生物体的基因组。其它可用来敲除基因的基因组定制技术有meganuclease和tal效应物核酸酶(talens,cellectis bioresearch)。由用于序列特异性识别的tale dna结合结构域与引入双链断裂(dsb)的核酸内切酶的催化结构域融合组成。meganuclease是序列特异性核酸内切酶,是天然产生的“dna剪刀”,其源自各种单细胞生物体例如细菌、酵母、藻类和某些植物细胞器。meganuclease具有12至30个碱基对的长识别位点。可以改变天然meganuclease的识别位点以使其靶向天然的基因组dna序列(例如内源基因)。
65、另一个最近的基因组编辑技术是crispr/cas系统,其可以被用来实现rna引导的基因组改造。crispr干扰是允许序列特异性控制原核和真核细胞中基因表达的遗传技术。其基于源自细菌免疫系统的crispr(规律成簇的间隔短回文重复)通路。
66、基因失活,即基因功能性表达的抑制,也可以例如通过设计表达反义rna的转基因生物体,或者通过对受试者施用反义rna来实现。可以例如作为表达质粒来递送反义构建体,其中当所述表达质粒在细胞中表达时,产生与细胞lncrna lncrna的至少一个独特部分互补的rna。
67、用于抑制基因表达的一个更快方法是,基于使用由dna或其它合成的结构类型(例如硫代磷酸酯、2’-0-烷基核糖核苷酸嵌合体、锁核酸(lna)、肽核酸(pna)或吗啉核酸)组成的较短反义寡聚物。除了rna寡聚物、pna和吗啉核酸以外,所有其它反义寡聚物都在真核细胞中通过rna酶h介导的靶切割机制起作用。pna和吗啉核酸高度亲和地和特异地结合互补的dna和rna靶标,由此通过对rna翻译机器的简单空间位阻来起作用,且表现出完全抵抗核酸酶的攻击。“反义寡聚物”指,包含至少长约10个核苷酸的寡聚物的反义分子或反基因剂。在实施方案中,反义寡聚物包含至少15、18、20、25、30、35、40或50个核苷酸。反义方法包括设计与lncrna的多核苷酸序列编码的rna互补的寡核苷酸(dna或rna或其衍生物)。可以将反义rna导入细胞中,通过与其碱基配对和物理上阻碍翻译机器来抑制互补mrna的翻译。该效果因此是化学计量的。尽管优选完全互补,但这不是必需的。如本文中所提及的,序列与rna的一部分“互补”,意思是序列具有能够与rna杂交、形成稳定的双链体的足够互补性;在双链反义多核苷酸序列的情况下,可以检测双链体dna的单链,或可以检测三链体的形成。杂交的能力将取决于互补的程度和反义多核苷酸序列的长度。通常,进行杂交的多核苷酸序列越长,其可包含越多的与rna错配的碱基且仍然形成稳定的双链体(或三链体,视情况而定)。技术人员可以通过使用标准程序测量杂交复合体的熔点,确定错配的耐受程度。反义寡聚物应该长至少10个核苷酸,优选寡聚物长15至约50个核苷酸。在某些实施方案中,寡聚物长至少15个核苷酸、至少18个核苷酸、至少20个核苷酸、至少25个核苷酸、至少30个核苷酸、至少35个核苷酸、至少40个核苷酸、或至少50个核苷酸。一个相关的方法使用核酶替代反义rna。核酶是具有催化作用的rna分子,其具有与酶一样的切割特性,可以被设计以靶向特定的rna序列。在小鼠、斑马鱼和果蝇中报道了使用核酶的成功靶基因失活,包括时间和组织特异性的基因失活。rna干扰(rnai)是一种转录后基因沉默形式。rna干扰现象最初在秀丽隐杆线虫中得到观察和描述,其中显示了外源双链rna(dsrna)通过诱导靶标rna快速降解的机制可以特异地和有力地破坏包含同源序列的基因的活性。几个报道在其它生物体中描述了相同的催化现象,包括展示在空间上和/或时间上控制基因失活的实验,所述生物体包括植物(拟南芥)、原生动物(布氏锥虫)、无脊椎动物(黑腹果蝇)和脊椎动物物种(斑马鱼和非洲爪蟾)。介导序列特异性信使rna降解的可以是小干扰rna(sirnas),其从较长的dsrna通过核糖核酸酶iii切割产生。通常,sirna的长度为20-25个核苷酸。sirna通常包含通过标准的watson crick碱基配对相互作用(在下文中称为“碱基配对”)退火在一起的正义rna链和互补的反义rna链。正义链包含与靶标mrna中的靶标序列一致的核酸序列。本发明的sirna的正义和反义链可以包含两个互补的单链rna分子,或可以包含单个分子,在该单个分子中,两个互补的部分碱基配对并通过单链“发夹”区(通常称为shrna)共价连接。术语“分离的”意思是通过人为干预从天然状态改变或移出。例如,天然存在活体动物中的sirna不是“分离的”,但合成的sirna或从与其天然状态共存的材料中部分或完全分离的sirna是“分离的”。分离的sirna可以相当纯的形式存在,或可在非天然环境例如sirna所转入的细胞中存在。
68、本发明的sirna可以包括部分纯化的rna、相当纯的rna、合成的rna、或重组产生的rna、以及通过添加、删除、替换和/或改变一个或多个核苷酸而与天然存在的rna不同的经改变了的rna。这样的改变可以包括添加非核苷酸材料至例如sirna的末端(一个或多个)或至sirna的一个或多个内部核苷酸,包括使sirna抵抗核酸酶消化的修饰。
69、本发明的sirna的一条或两条链也可以包含3′突出端。“3′突出端”指从rna链的3′末端伸出来的至少一个非配对的核苷酸。因此,在一个实施方案中,本发明的sirna包含长1个至约6个核苷酸(包括核糖核酸或脱氧核糖核酸)的至少一个3′突出端,优选长1至约5个核苷酸,更优选长1至约4个核苷酸,特别优选长约1至约4个核苷酸。
70、在sirna分子的两条链都包含3′突出端的实施方案中,对于每条链,突出端的长度可以是相同或不同的。在最进一步实施方案中,3′突出端存在于sirna的两条链上,长2个核苷酸。为了增强本发明sirna的稳定性,也可以使3′突出端稳定化以对抗降解。在一个实施方案中,利用包括嘌呤核苷酸例如腺苷或鸟苷核苷酸来稳定突出端。
71、可选的,以经修饰的类似物替换嘧啶核苷酸,例如以2′脱氧胸苷替换3′突出端中的尿苷核苷酸,是可耐受的,不影响rnai降解的效率。特别是,2′脱氧胸苷中的2′羟基的缺失显著增强组织培养基中3′突出端的核酸酶抗性。
72、本发明的sirna可以靶向任何靶标lncrnarna序列(“靶序列”)中约19至25个连续核苷酸的任何区段,在本技术中提供了其实例。用于选择sirna的靶序列的技术在本领域公知。因此,本发明的sirna的正义链可以包含与靶标mrna中任何一段约19至约25个连续的核苷酸一致的核苷酸序列。
73、可以使用许多本领域技术人员所知的技术获得本发明的sirna。例如,可以使用本领域所知的方法通过化学合成或重组产生sirna。优选地,使用适当保护的核糖核苷亚磷酰胺和常规的dna/rna合成仪来化学合成本发明的sirna。sirna可以作为两个分开的、互补的rna分子,或作为具有两个互补区的单个rna分子来合成。
74、如本文中所使用,sirna的“有效量”是足够导致rnai介导的靶标mrna降解的量,或足够抑制受试者中的转移进程的量。可以使用分离和定量mrna或蛋白质的标准技术(如上述),通过测量受试者细胞中靶标mrna或蛋白质的水平来检测rnai介导的靶标mrna降解。
75、通过考虑例如受试者的大小和重量,疾病渗入的程度,受试者的年龄、健康状况和性别,给药途径,和给药是局部还是全身性的,本领域技术人员可以容易确定待施用于给定受试者的本发明sirna的有效量。
76、反义rna策略的另一特殊形式是gapmer。gapmer是嵌合的反义寡核苷酸,其包含长度足以诱导rnase h切割的脱氧核苷酸单体的中心区段。gapmer中心区的侧翼是2’-o修饰的核糖核苷酸或其它经人工修饰的核糖核苷酸单体的区段,例如桥核酸(bridged nucleicacid,bnas),保护内部区段免受核酸酶降解。gapmer已被用于获得rnase-h介导的靶标rna切割,而降低硫代磷酸酯连接的数量。硫代磷酸酯拥有与未经修饰的dna相比对核酸酶增加的抗性。然而,它们具有几个缺点。这包括与互补核酸的低结合能力和导致毒性副作用的与蛋白质的非特异性结合,从而限制了它们的应用。毒性副作用的发生和非特异性结合导致的脱靶效应已经激发人们设计新的人工核酸用于开发经修饰的寡核苷酸,以在体内提供有效的和特异的反义活性而不表现出毒性副作用。通过招募rnaseh,gapmers选择性切割靶标寡核苷酸链。该链的切割引发反义效应。该方法已经被证明是抑制基因功能强有力的方法,并逐渐成为用于反义治疗的流行方法。gapmer可由商业提供。例如由exiqon提供的lnalongrna gapmer,或由isis pharmaceuticals提供的moe gapmer。moe gapmers或“2′moegapmers”是15-30个核苷酸的反义硫代磷酸酯寡核苷酸,其中所有的骨架连接通过在非桥接氧上添加硫(硫代磷酸)而修饰,且一段至少10个连续的核苷酸保持未经修饰状态(脱氧糖),而其余的核苷酸在2′位置包含o′-甲基o′-乙基取代(moe)。对于临床使用,将依照本发明的化合物或其前药形式配制成药物组合物,其配制为与其意图的施用路径,例如口服、直肠、胃肠外或其它施用模式相容。通常,通过混合活性物质与常规的药学可接受稀释剂或载体来制备药物配制剂。如本文中所使用的,语言“药学可接受载体”意图包括与药物施用相容的任何和所有溶剂、分散介质、涂层、抗细菌和抗真菌剂、吸收延迟剂等等。药学可接受稀释剂或载体的例子有水、明胶、阿拉伯树胶、乳糖、微晶纤维素、淀粉、羟基乙酸淀粉钠、磷酸氢钙、硬脂酸镁、滑石、胶体二氧化硅等等。此类介质和药剂对药学活性物质的用途是本领域中公知的。除非任何常规的介质或药剂与活性化合物不相容,涵盖其在组合物中的用途。
77、本发明的药物还可与其他治疗口腔鳞状细胞癌的药物联用,其他治疗性化合物可以与主要的活性成分同时给药,甚至在同一组合物中同时给药。还可以以单独的组合物或与主要的活性成分不同的剂量形式单独给予其它治疗性化合物。主要成分的部分剂量可以与其它治疗性化合物同时给药,而其它剂量可以单独给药。在治疗过程中,可以根据症状的严重程度、复发的频率和治疗方案的生理应答,调整本发明药物组合物的剂量。
78、本发明中术语“样本”是指从目标患者得到的组合物,其包含细胞和/或其他分子体—将进行特征化和/或识别,例如,根据物理、生化、化学和/或生理特征。例如,短语“临床样本”或“疾病样本”及其变体,是指从目标患者获得的任何样本,将预期或已知所述样本中能够获得细胞和/或分子体,例如将被特征化的生物标志物。
79、下面结合实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harborlaboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。
80、实施例1qpcr检测lncrna的差异表达
81、1、收集33例周围正常粘膜组织和口腔鳞状细胞癌组织,均经病理学诊断证实,所有患者术前未接受任何形式的治疗。手术切下的样本于液氮中冻存。
82、2、rna提取
83、取出冻存于液氮中的组织样本,把组织样本放入已预冷的研钵中进行研磨,按照试剂盒中的说明书提取分离rna。具体如下:
84、1)加入trizol,室温放置5min;
85、2)加入氯仿0.2ml,用力振荡离心管,充分混匀,室温下放置5-10min;
86、3)12000rpm离心15min,将上层水相移到另一新的离心管中(注意不要吸到两层水相之间的蛋白物质),加入等体积的-20℃预冷的异丙醇,充分颠倒混匀,置于冰上10min;
87、4)12000rpm高速离15min后小心弃掉上清液,按1ml/ml trizol的比例加入75%depc乙醇洗涤沉淀(4℃保存),洗涤沉淀物,振荡混匀,4℃,12000rpm离心5min;
88、5)弃去乙醇液体,室温下放置5min,加入depc水溶解沉淀;
89、6)用nanodrop2000紫外分光光度计测量rna纯度及浓度,冻存于-70℃冰箱。
90、3、逆转录:
91、1)配置10μl反应体系:
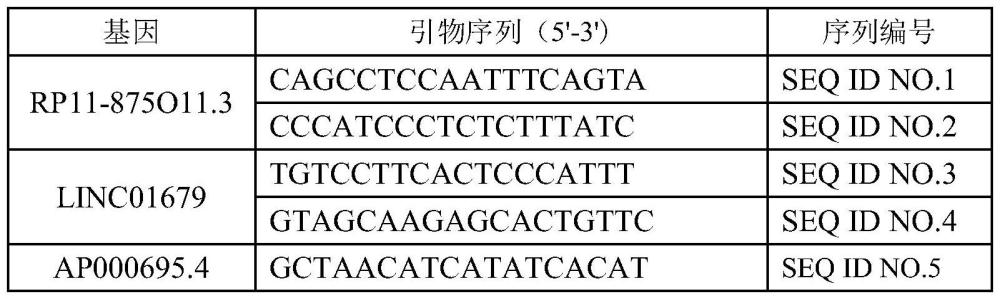
92、取mgcl22μl、10×rt buffer 1μl、无rnase水3.75μl、dntp混合液1μl、rnase抑制剂0.25μl、amv反转录酶0.5μl、寡聚dt适配子引物0.5μl、实验样品1μl混合
93、2)逆转录反应条件
94、按照rnapcrkit(amv)ver.3.0中逆转录反应条件进行。
95、42℃60min,99℃2min,5℃5min。
96、3)聚合酶链反应
97、1)引物设计
98、根据genebank中rp11-875o11.3基因和gapdh基因的编码序列设计qpcr扩增引物,由博迈德生物公司合成。具体引物序列如表1所示。
99、表1引物序列
100、
101、
102、2)配制25μl pcr反应体系:
103、正(反)向引物1μl、takaraex taqhs12.5μl、模板2μl、去离子水8.5μl
104、3)pcr反应条件:94℃4min,(94℃20s,60℃30s、72℃30s)×30个循环。
105、以sybr green作为荧光标记物,在light cycler荧光定量pcr仪上进行pcr反应,通过融解曲线分析和电泳确定目的条带,2-δδct法进行相对定量,每个样进行3次重复实验。△△ct法:△ct1=(目的基因,待测样本)ct值-(内参基因,待测样本)ct值;△ct2=(目的基因,对照样本)ct值-(内参基因,对照样本)ct值。△△ct=△ct1-△ct2,表达倍数=2-δδct。
106、5、统计学方法
107、以gapdh为内参,计算口腔鳞状细胞癌组织与正常粘膜组织荧光定量rt-pcr的实验结果,两者之间的差异采用t检验,以p<0.05具有统计学差异。
108、6、结果
109、结果如表2所示,与周围正常粘膜组织相比,rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、rp11-426c22.4、rp11-426c22.5、ap000695.6基因在口腔鳞状细胞癌组织中表达上调,差异具有统计学意义(p<0.05)。
110、表2lncrna的相对表达水平
111、
112、
113、实施例2lncrna的沉默检测及功能验证
114、1、细胞培养
115、将液氮内保存的人口腔鳞癌scc-15细胞取出后进行复苏接种于dmem培养基在37℃、5%co2恒温的培养箱中培养细胞。24h后细胞呈贴壁生长即复苏成功每隔1-2d换液1次,使用胰蛋白酶消化并制成细胞悬液用于实验。
116、2、细胞转染
117、将细胞按2×105/孔接种到六孔细胞培养板中,在37℃、5%co2培养箱中进行培养。将处于增殖对数期细胞(约80%左右),弃培养基,pbs清洗2次,加入2m1 dmem于培养箱内饥饿培养1h,使用脂质体转染试剂2000(购自于invitrogen公司)进行转染,具体操作按照说明书进行。将实验分为三组:空白对照组(scc-15)、阴性对照组(sirna-nc)和实验组(sirna组),其中阴性对照组sirna与各lncrna基因的序列无同源性。
118、其中,sirna-nc为由上海吉码制药技术有限公司提供的通用阴性对照,针对各lncrna的sirna序列如表3所示。
119、表3lncrna的sirna序列
120、
121、3、qpcr检测rp11-875o11.3基因的转录水平
122、各组细胞转染培养48h后,使用trizol法提取细胞总rna,按照实施例1中的方法进行逆转录以及实时定量pcr检测。
123、4、cck-8细胞增殖实验
124、将转染24h的阴性对照组与实验组细胞常规方法消化、离心,弃上清液,加入1ml完全培养基重悬细胞,吹打混匀,以每孔3000个细胞接种至96孔板,补充完全培养基至100μ1;在孔板最外周一圈内加入100μ1depc水,将96孔板至于恒温培养箱内培养。培养48h后加入含有10%的cck-8的100μ1培养基,继续于培养箱内培养1h后,于酶标仪测定450nm吸光度,统计数据。
125、5、细胞迁移实验
126、将transwell小室置于24孔板内,上室内加入200μ1dmem溶液,置于培养箱内,水化1h;按照每小室2×104个细胞进行铺板,将上室液体补充至200μ1,吹打混匀,下室加入700μ1完全培养基,继续于培养箱内培养36h;取出小室,弃去上室及下室内的培养基,用棉签轻柔擦拭去上室内残留的培养基及细胞,pbs清洗小室,摇床5min,弃pbs;下室内加入500μ14%多聚甲醛,室温固定30min,弃固定液,pbs清洗3次,摇床5min,弃pbs;将小室置于通风橱内,风干30min;下室内加入500μ1制备好的0.1%结晶紫溶液,排除气泡,静止30min;弃结晶紫溶液,使用pbs清洗3次,摇床5min,弃pbs,用干棉签轻柔擦去上室内多余液体,将小室置于显微镜下,进行细胞数量统计。
127、6、统计学方法
128、实验都是按照重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,两者之间的差异采用t检验,认为当p<0.05时具有统计学意义。
129、7、结果
130、sirna的沉默效果如表4所示,相比空白对照组,实验组的各sirna对相应的基因都具有较好的干扰效果(p<0.05),而sirna-nc则无显著的变化(p>0.05)。
131、表4sirna的转染效果
132、
133、注:p:与空白对照相比
134、cck-8检测结果如表5所示,实验组的od值相对于阴性对照组显著降低,p<0.05,说明本研究的lncrna在口腔鳞癌细胞的增殖中起着重要的作用。
135、表5od值
136、
137、迁移实验的结果表6所示,与阴性对照组相比,实验组rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、ap000695.6的迁移细胞数显著降低(p<0.05),而rp11-426c22.4、rp11-426c22.5组的细胞数虽然有所降低,但是并不显著,根据上述结果可以判断rp11-875o11.3、linc01679、ap000695.4、rp11-339b21.10、ap000695.6在口腔鳞癌的转移中起着重要的作用。
138、表6迁移细胞数
139、
140、上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!