提高细胞基因组中同源定向修复(HDR)效率的方法与流程
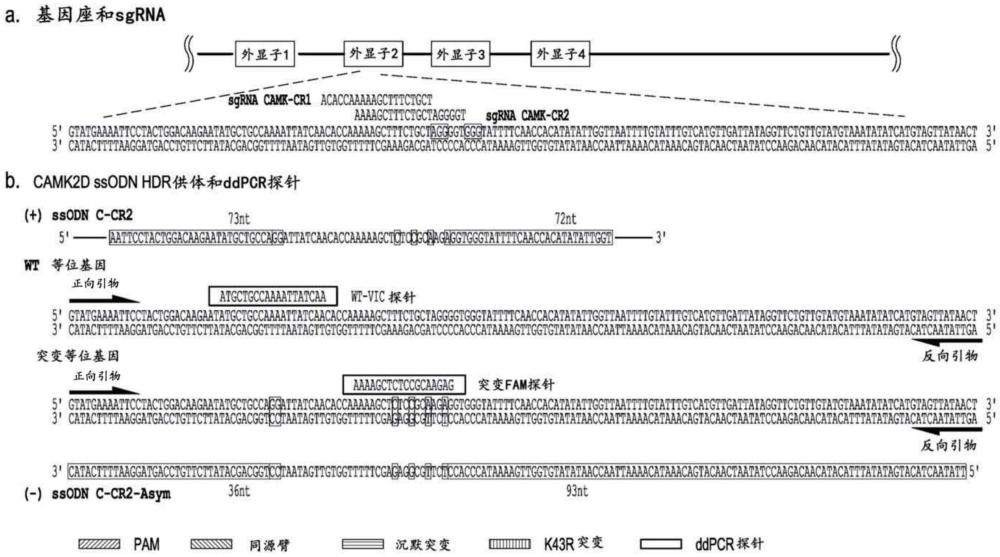
本技术涉及生物,具体地涉及提高细胞基因组中同源定向修复(hdr)效率的方法。
背景技术:
1、本领域已经描述了用于基因组序列的dna靶向切割的各种方法。此类靶向切割事件可用于诱导靶向诱变,诱导细胞dna序列的靶向缺失,并促进在预定染色体基因座处的靶向重组。这些方法通常涉及使用工程化切割系统在靶dna序列中诱导双链断裂(dsb)或切口,使得通过错误产生的过程(例如非同源末端连接(nhej)或同源定向修复(hdr))而对断裂的修复可以导致基因失活或外源目的序列的插入。通过如下方式可以发生切割:通过使用特异性核酸酶例如工程化锌指核酸酶(zfn)、转录激活因子样效应子核酸酶(talen),使用crispr/cas系统与工程化单一指导rna(sgrna)来指导特异性切割。
2、通过hdr过程在特定靶位置处的基因组修饰的效率在细胞中相对较低。因此,仍然需要提高细胞基因组中同源定向修复(hdr)效率的方法。
技术实现思路
1、在某些实施方案中,本发明提供了用于提高细胞基因组中同源定向修复(hdr)效率的方法,其包括:(a)向所述细胞中引入:(i)核酸酶;和(ii)供体核酸,其包括有待插入基因组中的修饰序列;并且(b)使所述细胞经受从37℃到更低温度的温度转变;其中所述核酸酶在所述细胞中的切割位点切割基因组,并且所述供体核酸通过提高的hdr率引导用所述修饰序列修复基因组序列。例如,同源定向修复(hdr)率提高了至少1.5倍。任选地,同源定向修复(hdr)率提高了至少2倍。
2、在某些方面,更低温度为28℃-35℃。任选地,更低温度为30℃-33℃。例如,细胞在更低温度下生长至少24小时或至少48小时,例如1天-5天(1天、2天、3天、4天或5天)。任选地,在温度转变后,细胞在37℃下生长。
3、在某些方面,细胞是真核细胞,例如哺乳动物细胞。在一个具体实施方案中,细胞是干细胞,例如诱导多能干细胞(ipsc)。在另一个具体实施方案中,细胞是原代细胞。
4、在某些方面,本发明中使用的核酸酶包括所有dna序列特异性核酸内切酶或rna指导的dna核酸内切酶。任选地,核酸酶是选自cas核酸酶或cpf1核酸酶的crispr核酸酶。例如,核酸酶是cas9核酸酶。为了说明,将crispr核酸酶(例如cas9)与dna形式的sgrna(例如编码cas9核酸酶和sgrna的dna)或rna形式的sgrna(例如sgrna/cas9 rnp或sgrna/cas9mrna)一起引入细胞中。任选地,sgrna是合成的并且是经化学修饰的。在某些方面,供体核酸含有对称同源臂。任选地,供体核酸与基因组中的dna链互补,所述dna链被核酸酶切割。
5、在某些方面,本发明中使用的核酸酶是锌指核酸酶(zfn)。在某些其他方面,本发明中使用的核酸酶是tale核酸酶(talen)。
6、在某些实施方案中,本发明提供了通过上述方法产生的分离的细胞。
7、在某些实施方案中,本发明提供了药物组合物,所述药物组合物包含通过上述方法产生的分离的细胞。
8、在某些实施方案中,本发明提供了向有需要的受试者提供目的蛋白质的方法,所述方法包括:(a)根据上述方法将编码目的蛋白质的供体核酸引入细胞中;并且(b)将细胞引入受试者中,使得目的蛋白质在受试者中表达。
9、在某些实施方案中,本发明提供了一种用于提高细胞基因组中同源定向修复(hdr)效率的方法,其包括向所述细胞中引入:(i)核酸酶;和(ii)供体核酸,其含有对称同源臂,与基因组中被所述核酸酶切割的dna链互补,并包含有待以远离切割位点大于10个碱基对的距离插入基因组中的修饰序列,其中所述核酸酶在所述细胞中的所述切割位点处切割基因组,并且所述供体核酸通过提高的hdr率引导用所述修饰序列修复基因组序列。例如,同源定向修复(hdr)率提高了至少1.5倍或至少2倍。任选地,此类方法进一步包括使细胞经受从37℃到更低温度(例如,28℃-35℃或在30℃-33℃)的温度转变。例如,细胞在更低温度下生长至少24小时或至少48小时,例如1天-5天(1天、2天、3天、4天或5天)。任选地,在温度转变后,细胞在37℃下生长。在某些方面,细胞是真核细胞,例如哺乳动物细胞。在一个具体实施方案中,细胞是干细胞,例如诱导多能干细胞(ipsc)。在另一个具体实施方案中,细胞是原代细胞。在某些方面,本发明中使用的核酸酶是选自cas核酸酶或cpf1核酸酶的crispr核酸酶。例如,核酸酶是cas9核酸酶。为了说明,将crispr核酸酶(例如cas9)与dna形式的sgrna(例如编码cas9核酸酶和sgrna的dna)或rna形式的sgrna(例如sgrna/cas9 rnp或sgrna/cas9 mrna)一起引入细胞中。在某些方面,本发明中使用的核酸酶是锌指核酸酶(zfn)。在某些其他方面,本发明中使用的核酸酶是tale核酸酶(talen)。
10、具体地,本发明包括但不限于以下各项:
11、1.一种提高细胞基因组中同源定向修复(hdr)效率的方法,其包括:
12、(a)向所述细胞中引入:(i)核酸酶;和(ii)供体核酸,其包括有待插入基因组中的修饰序列;并且
13、(b)使所述细胞经受从37℃到更低温度的温度转变;
14、其中所述核酸酶在所述细胞中的切割位点处切割基因组,并且所述供体核酸通过提高的hdr率引导用所述修饰序列修复基因组序列。
15、2.根据项1所述的方法,其中所述更低的温度为28℃-35℃。
16、3.根据项1所述的方法,其中所述更低的温度为30℃-33℃。
17、4.根据项1所述的方法,其中所述细胞在所述更低温度下生长至少24小时。
18、5.根据项1所述的方法,其中所述细胞是哺乳动物细胞。
19、6.根据项5所述的方法,其中所述细胞选自干细胞、诱导多能干细胞(ipsc)或原代细胞。
20、7.根据项1所述的方法,其中所述核酸酶是选自cas核酸酶或cpf1核酸酶的crispr核酸酶。
21、8.根据项7所述的方法,其中所述核酸酶是cas9核酸酶。
22、9.根据项7所述的方法,其中将所述crispr核酸酶与dna形式或rna形式的sgrna一起引入所述细胞中。
23、10.根据项9所述的方法,其中所述sgrna是合成的并且是经化学修饰的。
24、11.根据项9所述的方法,其中将编码所述cas9核酸酶和sgrna的dna引入所述细胞中。
25、12.根据项9所述的方法,其中将sgrna/cas9 rnp引入所述细胞中。
26、13.根据项9所述的方法,其中将sgrna/cas9 mrna引入所述细胞中。
27、14.根据项1所述的方法,其中所述供体核酸含有对称同源臂,并且与基因组中被所述核酸酶切割的dna链互补。
28、15.根据项1所述的方法,其中同源定向修复(hdr)率提高了至少1.5倍。
29、16.通过项1所述的方法产生的细胞。
30、17.一种药物组合物,其包含项16的细胞。
31、18.一种向有需要的受试者提供目的蛋白质的方法,其包括:
32、(a)根据项1的方法将编码目的蛋白质的供体核酸引入细胞中;并且
33、(b)将所述细胞引入受试者中,使得所述目的蛋白质在所述受试者中表达。
34、19.一种用于提高细胞基因组中同源定向修复(hdr)效率的方法,其包括向所述细胞中引入:(i)核酸酶;和(ii)供体核酸,其含有对称同源臂,与基因组中被所述核酸酶切割的dna链互补,并包含有待以远离切割位点大于10个碱基对的距离插入基因组中的修饰序列,其中所述核酸酶在所述细胞中的所述切割位点处切割基因组,并且所述供体核酸通过提高的hdr率引导用所述修饰序列修复基因组序列。
35、20.根据项19所述的方法,其中所述方法进一步包括使所述细胞经受从37℃到更低温度的温度转变。
- 还没有人留言评论。精彩留言会获得点赞!