一种用于细胞培养肉的优质猪成纤维细胞筛选方法
本发明属于生物工程和动物细胞培养肉,具体涉及一种优质且高纯度的猪成纤维细胞分离纯化方法。
背景技术:
1、细胞培养肉的其生产效率和成本效益受限于原代种子细胞的质量和性能,成纤维细胞是在细胞培养领域中广泛应用的一种细胞类型,它们能分泌胶原蛋白和其他细胞外基质成分,为肌肉细胞提供必要的结构支持和三维框架,模拟自然肉的纹理和组织结构。此外,成纤维细胞通过分泌生长因子和细胞因子等信号分子,促进肌肉细胞的增殖和分化,同时维持细胞培养系统的稳定性,它们还参与营养物质的供给和代谢调节,确保肌肉细胞的健康生长。因此,成纤维细胞是细胞培养肉生产中不可或缺的一部分,对提高产品质量和生产效率具有关键作用。
2、现有的成纤维细胞分离技术通常未考虑猪不同年龄和不同部位成纤维细胞的差异性,这些差异可能会影响其在细胞培养肉生产中的应用。例如,不同部位如耳朵、前腿、后腿和背部的成纤维细胞在细胞外基质的构成、增殖能力以及分泌特定蛋白的能力上可能存在差异。此外,幼猪与成猪的成纤维细胞在生物化学特性和生长动力学方面也可能表现不同。这些差异对于细胞培养肉的质量和生产成本有着重要影响。因此,需要一种能够区分和优化不同来源成纤维细胞的分离纯化方法,以提高细胞培养肉的生产效率和产品质量。
3、现有技术中,常见的成纤维细胞筛选方法包括差速贴壁法、密度梯度离心法和酶消化法,这些方法虽然操作简单且成本较低,但缺乏选择性和特异性,且可能在筛选过程中对细胞造成损伤。而基于表面标记的技术如流式细胞术(facs)和磁珠分选技术特异性高并且适用于大规模筛选,但成本高昂,且操作复杂,需要专业设备和技术人员。此外,基于细胞的生物化学属性进行筛选,例如通过代谢活性测定或基因表达分析,能够提供深入的细胞功能状态信息,但这些方法通常要求严格的实验条件,且数据处理复杂耗时。尽管现有技术提供了多种成纤维细胞的筛选方案,但这些方法往往无法同时满足效率、成本和特异性的需求。因此,迫切需要一种新的筛选方法,通过优化筛选流程和减少整个生产过程中的资源消耗和成本,以提高细胞培养肉的生产效率和质量。
技术实现思路
1、本发明的目的是提供一种用于细胞培养肉研究和生产的猪成纤维细胞的分离纯化方法。
2、本发明采用的技术方案如下:
3、一种用于细胞培养肉的优质猪成纤维细胞的筛选方法,所述方法包括如下步骤:
4、(1)分别采集不同年龄猪的不同部位的真皮组织或肌肉内结缔组织;
5、(2)将步骤(1)采集的组织用碘伏消毒,再用75%酒精进行脱碘消毒,对组织进行去毛、漂洗、浸泡,将组织块剪至2-3cm2大小;
6、(3)剔除伤口部位、软骨组织、肌肉组织及表皮皮肤,将剩余组织剪至宽度不大于3mm(2-3mm),置于培养皿中,加入血清;
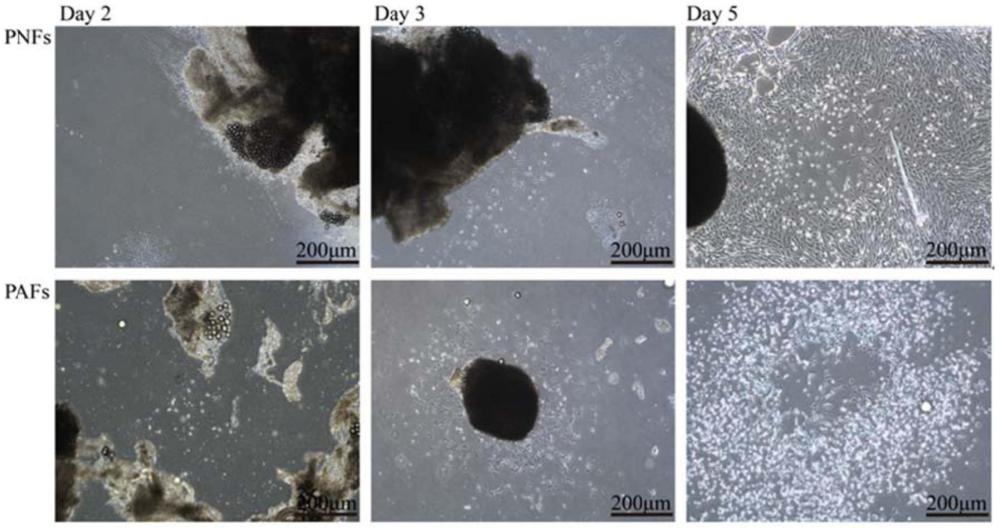
7、(4)将加入血清后的组织匀浆均匀涂抹在培养皿中,37℃,5% co2干涸培养3-6h;
8、(5)干涸后,沿培养皿壁加入增殖培养基,24h后补加增殖培养基继续培养,每2天更换一次培养基,待有细胞迁出时,视细胞生长状况和汇合度消化传代及冻存;
9、(6)经过3-4次传代后,得到纯度较高的成纤维细胞。
10、进一步的,步骤(1)所述不同年龄猪的真皮组织或肌肉内结缔组织分别为1~10日龄内幼猪皮肤真皮组织、4-5月龄成猪肌肉结缔组织。
11、进一步的,步骤(1)所述不同部位分别为幼猪的耳朵、前腿、背部、后腿中不少于一个部位的真皮组织,成猪的前腿、背部、后腿不少于一个部位的肌肉内结缔组织。
12、进一步的,步骤(2)所述漂洗为使用75%酒精溶液和含有3vol%青霉素-链霉素双抗的pbs进行漂洗;优选的,步骤(2)所述漂洗为使用75%酒精溶液时间为5~10s,使用含有3vol%青霉素-链霉素双抗的pbs时间为10~30s。
13、进一步的,步骤(2)所述浸泡步骤使用含有3vol%青霉素-链霉素双抗的dmem/f12培养基。
14、进一步的,步骤(6)所述细胞的传代采用含10%胎牛血清和1vol%青霉素-链霉素双抗的dmem/f12培养基。
15、具体的,步骤(6)中所述传代为待细胞汇合度在80-90%时,弃除培养皿中原培养基,沿皿壁加入pbs,轻晃润洗细胞,去除死细胞、未贴壁组织块和残余血清,加0.25%胰酶,移入培养箱,37℃消化2min,显微镜下观察细胞回缩、脱离皿壁,加入胰酶等体积的完全培养基终止反应,轻轻吹打散匀,移入15m l离心管,800-1200r/min,离心5min,去上清,加2ml完全培养基重悬,按1×105接种到新的培养皿中,入培养箱再培养;传代3-4次后即可得到纯度较高的成纤维细胞,后续的传代培养所用增殖培养基为含10vol%胎牛血清和1vol%青霉素-链霉素双抗的dmem/f12培养基。
16、进一步的,所述方法还包括使用免疫荧光染色和特异性标记蛋白检测以鉴定步骤(6)得到的成纤维细胞的纯度,并检测细胞的体外增殖能力。所述特异性标记蛋白为vimentin基因。
17、具体的,所述纯度鉴定的具体操作为:
18、(1)将细胞接种至6孔板中,用增殖培养基培养后进行vimentin基因的阳性率验证;
19、(2)细胞培养密度达到95%时,进行免疫荧光染色鉴定成纤维细胞的纯度;
20、进一步的,所述增殖培养基,为含10vol%胎牛血清和1vol%青霉素-链霉素双抗的dmem/f12的培养基,并补充碱性成纤维细胞生长因子,所述碱性成纤维细胞生长因子的浓度为1~20ng/ml,优选为5~10ng/ml;
21、结果为:由显微镜下可见,猪成纤维细胞在2d培养条件下呈梭形;免疫荧光染色可检测到猪成纤维细胞中vimentin蛋白表达呈阳性。
22、该鉴定方法与传统鉴定方法相比较优势显著,vimentin作为细胞骨架的一部分,在成纤维细胞中的表达尤为显著,在细胞生长和分化过程中表现出相对稳定的表达模式,这种稳定性有助于在不同的细胞状态和实验条件下进行可靠的鉴定。vimentin可以通过常规的免疫组织化学或免疫荧光方法进行检测,这些方法设备需求不高,操作简单。
23、进一步的,所述方法还包括将步骤(6)得到的成纤维细胞分化培养后,利用实时荧光定量pcr技术检测不同年龄不同部位成纤维细胞分泌细胞外基质相关基因的表达情况,所述细胞外基质相关基因包括collagen i、collagen iii、laminin、fibronectin、elastin。
24、进一步的,所述分化培养采用的分化培养基为含2vol%胎牛血清和1vol%青霉素-链霉素双抗的dmem/f12的培养基,转化生长因子tgf-β1的浓度为5~10ng/ml。
25、本发明技术方案所实现的有益效果为:
26、本发明提供的不同年龄不同部位猪成纤维细胞的分离方法高效且经济,分离操作相对简单,采用组织块贴壁法可以在较短时间内获得较多的细胞数,避免了现有技术中37℃条件下胰蛋白酶水解对细胞表面蛋白质的破坏,避免了细胞损伤,收获的成纤维细胞在体外培养成活率高,贴壁率高,增殖力强,有利于细胞培养肉种子细胞的扩大培养。
- 还没有人留言评论。精彩留言会获得点赞!