WNV基因检测靶序列及其引物组合、试剂盒、检测方法
本发明属于特殊样品中wnv的微量检测,尤指wnv基因检测靶序列及其引物组合、试剂盒、检测方法。
背景技术:
1、西尼罗病毒(westnile virus,wnv)于1937年在非洲的乌干达首次被发现,从westnile地区的一位发热的成年妇女血液中分离到,因此得名west nile virus。西尼罗病毒属于黄病毒科黄病毒属。黄病毒科成员还有登革热病病毒、日本脑炎病毒以及黄热病病毒等70余种,多属于虫媒病毒。
2、西尼罗病毒主要通过鸟—蚊—鸟循环传播。该病毒可感染人、鸟类、多种哺乳动物、两栖类及爬行类动物,人和鸟类最为易感,其所致疾病主要分布在沿鸟类迁移飞行路线所连接的欧洲、非洲以及中东国家。候鸟在西尼罗热的全球流行和传播上发挥重要作用。它的主要传染源为处于病毒血症期的带毒动物,和该病毒的自然储存宿主-候鸟,传播该病毒的蚊子主要包括库蚊、伊蚊和曼蚊,特别是尖音库蚊将病毒传播给人。蚊子因叮咬感染wnv的鸟类而带毒,然后带毒的蚊子通过叮咬将西尼罗病毒传播给人和其他物。西尼罗病毒能穿过血脑屏障,干扰正常的中枢神经系统功能,临床上主要表现为脑炎或脑膜脑炎。
3、西尼罗病毒广泛分布于欧美、非洲、中东和西亚,主要引起西尼罗河热(w estnilefever),所致疾病大多为人畜共患病,引起严重的公共卫生问题且多缺乏有效的治疗、预防和控制措施,给疾病控制提出了严峻的挑战。我国也存在wnv输入的风险。
4、现有wnv检测技术普遍通过收集人体或者动物组织或血液样本进行核酸检测,主要针对易感宿主进行诊断,这种检测方法达不到疫情监测和流行病学分析的目的;根据wnv的传播途径,主要通过鸟类(候鸟)传播,而候鸟不宜直接捕杀,采集血液或组织样本对于鸟类来说也很困难。因此,本发明中检测候鸟的wnv携带情况的技术创新有重要的实际意义,对于监测wnv的疫情监测,输入风险分析,流行病学调查都有实际作用;
5、此外,常规的wnv核酸检测方法均采用软件设计引物,普通软件设计引物是以基因的gc含量、tm值、结合自由能等核酸参数进行优化设计,设计的引物无法分析病毒核酸的降解问题。软件设计的引物不会接触到实际临床样品中的未降解序列。即依靠基因组参数设计的引物无法扩增到粪便样品中实际存在的wnv序列。
技术实现思路
1、针对以上技术问题,本发明的目的在于提供wnv基因检测靶序列及其引物组合、试剂盒、检测方法,可通过候鸟粪便检测wnv的携带情况,以便通过wnv的携带情况来分析wnv的传播流行。
2、由于候鸟粪便中的wnv含量低且不稳定,现有方法基本检测不到,而本发明找到了wnv相对稳定的靶标,从而能够有效检测候鸟粪便(即wnv微量样本),判断候鸟中wnv的携带情况,为wnv的传播提供有效的预防与控制措施。
3、根据本发明的第一方面,提供用于wnv基因检测的靶序列,通过wnv全基因组覆盖筛选共筛选出11组靶序列,为seq id no.1~seq idno.11所示的核苷酸序列,选取其中至少一组序列用于微量wnv的基因检测。
4、一些技术方案中,从11组靶序列中选取相对其他位置更加稳定的五段序列中的至少一组作为微量wnv基因检测的靶序列,该五段序列为seq idno.1~seq id no.5所示的核苷酸序列。
5、一些技术方案中,所述wnv全基因组覆盖筛选的过程中,将wnv全基因组划分为约200nt的片段,并且每组片段之间有50nt的重合序列。
6、根据本发明的第一方面,提供用于wnv基因检测的引物组合,所述引物组合用于扩增上述的靶序列,其中,
7、扩增seq id no.1所示的核苷酸序列的引物组合为引物组合1,所述引物组合1包括引物对1,所述引物对1包括seq id no.12所示的上游引物1和seq id no.13所示的下游引物1;
8、扩增seq id no.2所示的核苷酸序列的引物组合为引物组合2,所述引物组合2包括引物对2,所述引物对2包括seq id no.14所示的上游引物2和seq id no.15所示的下游引物2;
9、扩增seq id no.3所示的核苷酸序列的引物组合为引物组合3,所述引物组合3包括引物对3,所述引物对3包括seq id no.16所示的上游引物3和seq id no.17所示的下游引物3;
10、扩增seq id no.4所示的核苷酸序列的引物组合为引物组合4,所述引物组合4包括引物对4,所述引物对4包括seq id no.18所示的上游引物4和seq id no.19所示的下游引物4;
11、扩增seq id no.5所示的核苷酸序列的引物组合为引物组合5,所述引物组合5包括引物对5,所述引物对5包括seq id no.20所示的上游引物5和seq id no.21所示的下游引物5。
12、根据本发明的再一方面,提供用于wnv基因检测的试剂盒,所述试剂盒包括上述的引物组合,以及pcr扩增和/或qpcr扩增的反应试剂。
13、一些技术方案中,所述试剂盒还包括rna提取试剂、阳性对照及阴性对照;所述反应试剂包括dna聚合酶和dna聚合酶缓冲液。
14、根据本发明的又一方面,提供一种wnv基因检测的方法,所述方法为利用上述的靶序列或者由该靶序列与质粒载体构建的重组质粒作为内标准基因阳性对照进行pcr和/或qpcr的步骤。
15、一些技术方案中,所述方法包括以下步骤:
16、s1、获取鸟类粪便中的核酸样本;
17、s2、利用上述的试剂盒对所述核酸样本进行pcr和/或qpcr扩增;
18、s3、根据pcr和/或qpcr的扩增结果,判断所述鸟类是否携带wnv病原体。
19、一些技术方案中,步骤s1具体为:采集新鲜粘稠或固体候鸟粪便样品置于无rna酶的ep管中,按照1:1比例加入rna保存液并短期放置在-70℃~-80℃保存;
20、和/或,
21、步骤s2中,所述试剂盒采用qiagen公司的病毒rna提取试剂盒;
22、和/或,
23、所述优化后的pcr配制体系包括taq mix 12.5μl,鸟粪cdna 1μl,上游引物20μm0.5μl,下游引物20μm 0.5μl,灭菌水9.5μl;优化后的反应程序为98℃10s,55℃30s,72℃20s,30个循环;
24、和/或,
25、所述优化后的qpcr反应体系包括10μl 2×magic sybr mixture、10μm上下游引物各0.4μl、2μl cdna溶液和7.2μl水;优化后的反应条件为95℃预变性30s后,95℃5s变性,60℃30s延伸,共40个循环。
26、根据本发明的另一方面,上述的靶序列,或者上述的引物组合,或者上述的试剂盒在微量wnv基因检测中的应用。
27、本发明采用以上技术方案至少具有如下的有益效果:
28、1.本发明提供的用于wnv基因检测的靶序列,经过全基因组覆盖筛选得到,相对其他位置来说更加稳定,从而可针对性的在鸟粪的微量样本中实现wnv的定性,为判断鸟粪中wnv的携带情况提供可靠的保证;
29、2.本发明提供的用于wnv基因检测的靶序列,通过wnv全基因组筛选得到,不同于常规软件设计引物,为了保证对wnv全基因组进行覆盖式扫描,将wnv全基因组划分为约200nt的片段,并且每组片段之间有50nt的重复,在此设计的基础上引物扩增引物;
30、3.本发明提供的用于wnv基因检测的引物组合,为对照以上稳定存在的靶序列设计得到,可实现特异性结合;
31、4.本发明提供的重组质粒,为质粒载体与上述的靶序列目的基因通过酶进行相接得到,可用于pcr及qpcr中的阳性对照;
32、5.本发明提供的用于wnv基因检测的试剂盒,可用于鸟粪微量样品的wnv核酸提取和检测,采用特异性结合病毒rna的离心吸附柱和独特的缓冲液系统,可于鸟粪中快速提取高纯的核酸样本;病毒裂解后,rna在高离序盐状态下选择性吸附于离心柱内硅基质膜,再通过一系列快速的漂洗-离心的步骤,将盐、细胞代谢物、蛋白等杂质去除,最后低盐的洗脱缓冲液将纯净的病毒rna从硅基质膜上洗脱。纯化后的病毒核酸无杂质和pcr抑制剂,可直接适用于pcr/qpcr等分析中;
33、6.本发明提供的wnv基因检测的方法,通过将候鸟粪便中的核酸样本利用本发明特殊设计的引物组合进行pcr/qpcr扩增,快速判断出候鸟中wnv病原体的携带情况,为疾病的预防、控制及治疗提供可靠的检测数据;本发明的检测方法,操作简便,且结果可靠。
34、附图说明
35、图1a为引物组合1的鸟粪样品cdna的电泳验证图谱,图1b为应用本发明中引物组合1时不同时间点(跨年)鸟粪样品cdna的电泳验证图谱,靶序列为片段1,产物大小203bp,其中,左起第一泳道m为dnamarker,从上到下片段大小依次为600bp、500bp、400bp、300bp、200bp、100bp,左起第二泳道1为鸟粪样品cdna,左起第三泳道2为空白对照组模板为灭菌水,左起第四泳道3为wnv重组质粒,左起第五泳道4为阴性鸟粪cdna,左起第六泳道5为wnv空载质粒;
36、图2a为引物组合2的鸟粪样品cdna的电泳验证图谱,图2b为应用本发明中引物组合2时不同时间点(跨年)鸟粪样品cdna的电泳验证图谱,靶序列为片段2,产物大小202bp,其中,左起第一泳道m为dnamarker,从上到下片段大小依次为600bp、500bp、400bp、300bp、200bp、100bp,左起第二泳道1为鸟粪样品cdna,左起第三泳道2为空白对照组模板为灭菌水,左起第四泳道3为wnv重组质粒,左起第五泳道4为阴性鸟粪cdna;
37、图3a为引物组合3的鸟粪样品cdna的电泳验证图谱,图3b为应用本发明中引物组合3时不同时间点(跨年)鸟粪样品cdna的电泳验证图谱,靶序列为片段3,产物大小186bp,其中,左起第一泳道m为dnamarker,从上到下片段大小依次为600bp、500bp、400bp、300bp、200bp、100bp,左起第二泳道1为鸟粪样品cdna,左起第三泳道2为空白对照组模板为灭菌水,左起第四泳道3为wnv重组质粒,左起第五泳道4为阴性鸟粪cdna,左起第六泳道5为wnv空载质粒;
38、图4a为引物组合4的鸟粪样品cdna的电泳验证图谱,图4b为应用本发明中引物组合4时不同时间点(跨年)鸟粪样品cdna的电泳验证图谱,靶序列为片段4,产物大小185bp,其中,左起第一泳道m为dnamarker,从上到下片段大小依次为600bp、500bp、400bp、300bp、200bp、100bp,左起第二泳道1为鸟粪样品cdna,左起第三泳道2为空白对照组模板为灭菌水,左起第四泳道3为wnv重组质粒,左起第五泳道4为阴性鸟粪cdna,左起第六泳道5为wnv空载质粒;
39、图5a为引物组合5的鸟粪样品cdna的电泳验证图谱,图5b为应用本发明中引物组合5时不同时间点(跨年)鸟粪样品cdna的电泳验证图谱,靶序列为片段5,产物大小185bp,其中,左起第一泳道m为dnamarker,从上到下片段大小依次为600bp、500bp、400bp、300bp、200bp、100bp,左起第二泳道1为鸟粪样品cdna,左起第三泳道2为空白对照组模板为灭菌水,左起第四泳道3为wnv重组质粒,左起第五泳道4为阴性鸟粪cdna,左起第六泳道5为wnv空载质粒;
40、图6-7为采用引物组合1进行qpcr扩增的溶解曲线;
41、图8为采用引物组合1进行qpcr扩增的扩增曲线,其中,从左至右依次对应拷贝数为5.20×109~5.20×102拷贝/μl的倍比稀释的wnv重组质粒和待测样本cdna的扩增曲线,其中每个稀释倍数为两个重复,待测样本cdna为三个重复;
42、图9-10为采用引物组合2进行qpcr扩增的溶解曲线;
43、图11为采用引物组合2进行qpcr扩增的扩增曲线,其中,从左至右依次对应拷贝数为5.20×109~5.20×102拷贝/μl的倍比稀释的wnv重组质粒和待测样本cdna的扩增曲线,其中每个稀释倍数为两个重复,待测样本cdna为三个重复;
44、图12-13为采用引物组合3进行qpcr扩增的溶解曲线;
45、图14为采用引物组合3进行qpcr扩增的扩增曲线,其中,从左至右依次对应拷贝数为1.21×109~1.21×102拷贝/μl的倍比稀释的wnv重组质粒和待测样本cdna的扩增曲线,其中每个稀释倍数为两个重复,待测样本cdna为三个重复;
46、图15-16为采用引物组合4进行qpcr扩增的溶解曲线;
47、图17为采用引物组合4进行qpcr扩增的扩增曲线,其中,从左至右依次对应拷贝数为5.20×109~5.20×102拷贝/μl的倍比稀释的wnv重组质粒和待测样本cdna的扩增曲线,其中每个稀释倍数为两个重复,待测样本cdna为三个重复;
48、图18-19为采用引物组合5进行qpcr扩增的溶解曲线;
49、图20为采用引物组合5进行qpcr扩增的扩增曲线,其中,从左至右依次对应拷贝数为5.20×109~5.20×102拷贝/μl的倍比稀释的wnv重组质粒和待测样本cdna的扩增曲线,其中每个稀释倍数为两个重复,待测样本cdna为三个重复;
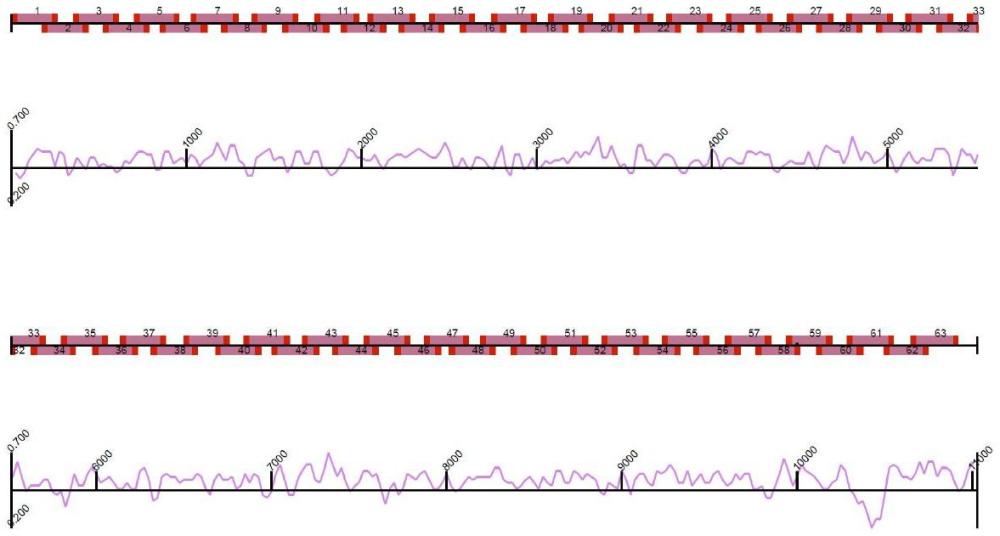
50、图21为wnv扩增子的设计图,其中,红色为引物示意,粉红色为扩增片段示意;
51、图22为wnv全基因组筛选出来的基因片段。
- 还没有人留言评论。精彩留言会获得点赞!