基于PCN配体的钌络合物及其制备方法和应用与流程
本发明涉及有机化学领域,尤其涉及一种基于pcn配体的钌络合物及其制备方法和应用。
背景技术:
1、环丙烷分子存在于多种天然产品和药物分子中,由于其特殊的反应活性和构象限制,它是化学家们追捧的合成目标。
2、过渡金属催化重氮化合物将烯烃转化为环丙烷不仅是合成环丙烷的主要方法,也是合成有机化学中最成熟、最广泛采用的方法之一。以与铑、钴和铜络合物相比,ru的研究和开发较少,而铑、钴和铜络合物是重氮化合物反应中应用最广泛的过渡金属催化剂。
3、钳形配合物具有很高的热稳定性,可灵活调节金属中心周围的立体和电子特性,因此被广泛应用于过渡金属催化反应中。
4、钌具有丰富的配位化学性质,金属价格也便宜得多,但在手性pincer化学方面的发展却稍逊一筹。大多数已报道的手性钳形-ru催化反应仅限于不饱和c=x(x=c、n、o等)键的不对称还原(例如:h.wang,j.wen,x.zhang,chem.rev.2021,121,7530–7567)。在这种情况下,寻找pincer-ru络合物在不对称催化中的更多潜在应用具有重要意义。
5、nishiyama和同事首次报道了ru催化的α-重氮羰基化合物的不对称环丙烷化反应(h.nishiyama,y.itoh,h.matsumoto,s.b.park,k.itoh,j.am.chem.soc.1994,116,2223–2224;s.b.park,n.sakata,h.nishiyama,chem.eur.j.1996,2,303–306)。通过使用ncn或nnn ru-pincer催化剂,尽管脂肪族烯烃底物的反应活性较低,但对末端烯烃却能获得良好的产率和立体选择性。随后,支志明报告了手性钌卟啉催化末端烯烃的不对称分子间环丙烷化反应和烯烃的分子内环丙烷化反应(c.-m.che,j.-s.huang,f.-w.lee,y.li,t.-s.lai,h.-l.kwong,p.-f.teng,w.-s.lee,w.-c.lo,s.-m.peng,z.-y.zhou,j.am.chem.soc.2001,123,4119–4129);(j.l.zhang,c.-m.che,org.lett.2002,4,1911–1914)。iwasa(s.chanthamath,s.iwasa,acc.chem.res.2016,49,2080–2090)和mendoza(m.montesinos-magraner,m.costantini,r.ramirez-contreras,m.e.muratore,m.j.johansson,a.mendoza,angew.chem.int.ed.2019,58,5930–5935)报道了一种双齿配体-钌配合物,它能够高立体选择性地催化各种末端烯烃的不对称环丙烷化反应和烯烃的分子内反应。
6、尽管已有ru催化环丙烷化的实例报道,但反应效率低的烯烃(如多取代的烯烃)的分子间环丙烷化仍然是一个巨大的挑战。
技术实现思路
1、本发明提供了一种基于pcn配体的钌络合物及其制备方法,该钌络合物在催化烯烃的对映选择性的环丙烷化反应中表现出优异的反应选择性和立体选择性,并且反应的收率较高,反应条件温和,反应速率快。
2、本发明的技术方案如下:
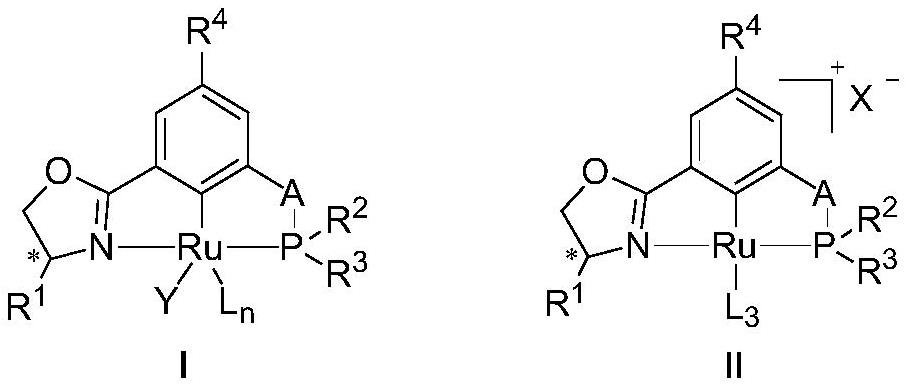
3、一种基于pcn配体的钌络合物,结构如式(i)或式(ii)所示:
4、
5、其中,a为o、nh或ch2;
6、y为卤素;
7、l为中性配体;n为1、2或3;
8、x为非配位阴离子;
9、r1、r2、r3、r4各自独立地为氢原子、甲酰基、苄基、卤素、取代或未取代的c1~c10的烷基、取代或未取代的c2~c10的烯基、取代或未取代的c2~c10的炔基、取代或未取代的c6~c14的芳基、取代或未取代的c1~c10的烷氧基、取代或未取代的c6~c14的芳氧基、取代或未取代的c1~c10的烷基羰基、取代或未取代的c1~c10的烷硫基、r5,r6,r7,r8,r9,r10,r11各自独立地为氢原子、c1~c10的烷基或c6~c14的芳基;r2、r3之间不成环;
10、“*”处表示手性碳原子,其为r构型、s构型或其混合。
11、在一些实施例中,基于pcn配体的钌络合物选自:
12、
13、其中,a、y、x、“*”、r1、r2、r3、r4定义如上。
14、在一些实施方案中,a为o。
15、在一些实施方案中,y为cl。
16、在一些实施方案中,l为三苯基膦和/或乙腈。
17、进一步的,l为三苯基膦时,n为1;l为乙腈时,n为2或3。
18、在一些实施方案中,x为二氯亚铜阴离子、四氟硼酸根阴离子、六氟磷酸根阴离子和/或四(3,5-二(三氟甲基)苯基)硼酸根阴离子。
19、进一步的,x为二氯亚铜阴离子或四氟硼酸根阴离子。
20、r1、r2、r3、r4中,所述的取代是指基团中的至少一个氢原子被卤素、c1~c10烷基和/或c1~c10烷氧基取代,当一个基团中多个氢原子被取代时,各取代基可以相同或不同。
21、在一些实施例中,r1、r2、r3、r4中:
22、所述的卤素为cl、br或i;
23、所述的c1~c10的烷基为c1~c6的烷基;
24、所述的c2~c10的烯基为c2~c6的烯基;
25、所述的c2~c10的炔基为c2~c6的炔基;
26、所述的c6~c14的芳基为c6~c10的芳基;
27、所述的c1~c10的烷氧基为c1~c6的烷氧基;
28、所述的c6~c14的芳氧基为c6~c10的芳氧基;
29、所述的c1~c10的烷基羰基为c1~c6的烷基羰基;
30、所述的c1~c10的烷硫基为c1~c6的烷硫基;
31、r5、r6、r7、r8、r9、r10、r11各自独立地为c1~c6的烷基或c6~c10的芳基。
32、进一步的,所述的c1~c6的烷基为甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基或环己基;
33、所述的c2~c6的烯基为乙烯基、
34、所述的c2~c6的炔基为乙炔基、
35、所述的c6~c10的芳基为苯基或β-萘基;
36、所述的c1~c6的烷氧基为甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、或叔丁氧基;
37、所述的c6~c10的芳氧基为苯氧基;
38、所述的c1~c6的烷基羰基为甲基羰基、乙基羰基、异丙基羰基、丁基羰基、异丁基羰基或叔丁基羰基;
39、所述的c1~c6的烷硫基为甲硫基、乙硫基、丙硫基、异丙硫基、丁硫基、异丁硫基或叔丁硫基。
40、在一些实施例中,r1、r2、r3各自独立地为三氟甲基、异丙基、叔丁基、苯基;r4为氢原子。
41、进一步的,基于pcn配体的钌络合物选自:
42、
43、其中,a、x、“*”定义如上。
44、进一步的,基于pcn配体的钌络合物选自:
45、
46、本发明还提供了所述的基于pcn配体的钌络合物的制备方法,包括:
47、式(i-1)化合物的制备:在惰性气体保护下,有机溶剂中,加入三乙胺,pcn配体1和ruy2(pph3)4进行络合反应,即得:
48、
49、式(i-2)化合物的制备:在惰性气体保护下,乙腈中,式(i-1)化合物进行配体交换反应,即得;
50、
51、式(ii-1)化合物的制备:在惰性气体保护下,乙腈中,式(i-2)化合物与agx或cucl反应,即得;
52、
53、所述的惰性气体为氦气、氩气、氖气和氮气中的一种或多种。
54、式(i-1)化合物的制备中:
55、所述的有机溶剂为醚类溶剂;有机溶剂与所述的pcn配体1的体积质量比为10~300ml/g;进一步优选为30~150ml/g。
56、ruy2(pph3)4与所述的pcn配体1的摩尔比值优选1:1.0~2.0;进一步优选为1:1.0~1.5;再进一步优选1:1.0~1.2。
57、三乙胺与所述的pcn配体1的摩尔比值为1.0~5.0:1;进一步优选为1.0~3.0:1;再进一步优选为1.0~1.5:1。
58、所述的反应的温度可以为本领域中该类络合反应的常规温度,本发明中优选为0~150℃;进一步优选110~130℃。
59、反应时间为1~48h;进一步优选为3~36h;再进一步优选为8~12h。
60、式(i-2)化合物的制备中:
61、乙腈与式(i-1)化合物的体积质量比为10~300ml/g;进一步优选为30~150ml/g。
62、反应的温度可以为本领域中该类络合反应的常规温度,本发明中优选为0~150℃;进一步优选110~130℃。
63、反应时间为1min~1h;进一步优选为10~30min;再进一步优选为10~15min。
64、式(ii-1)化合物的制备中:
65、乙腈与式(i-2)化合物的摩尔比为1.0~10.0:1;进一步优选为2.0~8.0:1;再进一步优选为5.0~6.0:1。
66、agx和/或cucl与式(i-2)化合物的摩尔比为1.0~5.0:1;进一步优选为1.0~3.0:1;再进一步优选为1.0~1.5:1。
67、反应的温度可以为本领域中该类络合反应的常规温度,本发明中优选为0~80℃;进一步优选为0~50℃;再进一步优选为20~30℃。
68、反应时间优选1~12h;进一步优选为3~8h;再进一步优选为4~6h。
69、本发明还提供了所述的基于pcn配体的钌络合物在催化烯烃的不对称环丙烷化反应中的应用。
70、所述的应用包括:惰性气体保护下,在所述的基于pcn配体的钌络合物催化作用下,式(iii)所示的烯烃底物和式(iv)所示的2-重氮羰基化合物进行环丙烷化反应,生成式(v)所示的环丙烷化合物;
71、
72、其中,r12、r13、r14、r15各自独立地为氢原子、卤素、三甲基硅基、c1~c10的烷基、c2~c10的烯基、c6~c14的芳基、取代的c6~c14的芳基、c1~c10的烷氧基、c2~c10的酰氧基、c2~c10的烷基酯基、杂原子数为1~3个的c2~c10的杂环基;
73、或r12、r13之间同与之相连的碳原子组合形成c3~c10的饱和或不饱和环。
74、在一些实施例中,r12、r13、r14、r15中:
75、所述的卤素为f、cl、br或i;
76、所述的c1~c10的烷基为c1~c4的烷基;
77、所述的c6~c14的芳基为苯基或β-萘基;
78、所述的c1~c10的烷氧基为c1~c4的烷氧基;
79、所述的c2~c10的酰氧基为乙酰氧基;
80、所述的c2~c10的烷基酯基为甲酸甲酯基;
81、杂原子数为1~3个的c2~c10的杂环基团为噻吩基或吲哚基;
82、取代的c6~c14的芳基为其中r16、r17、r18、r19、r20各自独立地为氢、卤素、三氟甲基、三甲基硅基、c1~c10的烷基、c2~c10的烯基、c6~c14的芳基、c1~c10的烷氧基、c2~c10的酰氧基、c2~c10的烷基酯基、取代的氮原子、杂原子数为1~3个的c2~c10的杂环基团;
83、或r16、r17、r18、r19、r20中,相邻两基团之间同与之相连的碳原子组合形成c3~c10的饱和或不饱和环。
84、在一些实施例中,r16、r17、r18、r19、r20中:
85、所述的卤素为f、cl、br或i;
86、所述的c6~c14的芳基为苯基或β-萘基;
87、所述的c1~c10的烷氧基为甲氧基;
88、所述的c2~c10的酰氧基为乙酰氧基;
89、所述的c2~c10的烷基酯基为甲酸甲酯基;
90、所述的取代的氮原子为二甲胺基或咔唑基;
91、所述的杂原子数为1~3个的c2~c10的杂环基团为
92、r16、r17、r18、r19、r20中相邻两基团之间同与之相连的碳原子组合形成c3~c10的饱和或不饱和环,相邻两基团为
93、在一些实施例中,r12、r13、r14、r15各自独立地为氢原子、卤素、三甲基硅基、c1~c4的烷基、c1~c4的烷氧基、苯基、取代苯基;
94、或r12、r13之间同与之相连的碳原子组合形成c3~c10的饱和或不饱和环;
95、取代苯基为为其中r16、r17、r18、r19、r20各自独立地为氢、卤素、三氟甲基、三甲基硅基、c1~c3的烷基、c2~c3的烯基、
96、在一些实施例中,式(iii)所示的烯烃底物选自:
97、
98、式(iv)所示的2-重氮羰基化合物为
99、所述的惰性气体为氦气、氩气、氖气和氮气中的一种或多种。
100、环丙烷化反应所使用的有机溶剂为醇类、醚类、卤代烷烃类溶剂中的至少一种。
101、醇类溶剂为甲醇、乙醇、六氟异丙醇中的至少一种;卤代烷烃类溶剂为二氯甲烷。
102、在一些实施例中,有机溶剂与式(iii)所示的烯烃底物的体积质量比可以为1~100ml/g;优选为5~50ml/g;进一步优选为10~50ml/g。
103、式(iii)所示的烯烃底物和式(iv)所示的2-重氮羰基化合物的摩尔比为0.1~20:1;基于pcn配体的钌络合物与式(iii)所示的烯烃底物的摩尔比为0.001~0.10:1。
104、在一些实施例中,式(iii)所示的烯烃底物和式(iv)所示的2-重氮羰基化合物的摩尔比为0.1~10:1;基于pcn配体的钌络合物与式(iii)所示的烯烃底物的摩尔比为0.01~0.05:1。
105、在一另些实施例中,式(iii)所示的烯烃底物和式(iv)所示的2-重氮羰基化合物的摩尔比为0.5~5:1;基于pcn配体的钌络合物与式(iii)所示的烯烃底物的摩尔比为0.03~0.05:1。
106、在一些实施例中,环丙烷化反应的反应温度为0~60℃,反应时间为1min~24h。
107、在另一些实施例中,环丙烷化反应的反应温度为10~30℃,反应时间为1~10min。
108、在一些实施例中,在所述的应用中,基于pcn配体的钌络合物结构如式(i)所示时,还需要加入agx对钌络合物进行活化;钌络合物与agx的摩尔比为1:0.5~5。
109、进一步的,钌络合物与agx的摩尔比为1:1~2.5。
110、所述的应用还包括以下后处理步骤:反应结束后,淬灭反应,过滤,除去溶剂,快速柱色谱分离,得到式(v)所示的环丙烷化合物。
111、所述的“淬灭反应”优选采用将反应液暴露在空气中进行淬灭反应。所述的“快速柱色谱分离”的方法和条件可以采用本领域中该类操作的常规方法和条件。
112、快速柱色谱分离时洗脱剂优选采用酯类溶剂与烷烃类溶剂的混合溶剂。所述的酯类溶剂与烷烃类溶剂的体积比优选1:1~200,进一步优选1:2~10。
113、所述的酯类溶剂优选乙酸乙酯,所述的烷烃类溶剂优选石油醚。
114、在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
115、与现有技术相比,本发明的有益效果为:
116、本发明基于pcn配体的钌络合物在烯烃对映选择性的环丙烷化反应中具有优良的催化活性,反应选择性和对映选择性优异,并且反应的收率较高,反应条件温和,反应速率快,反应效率高,且基于pcn配体的钌络合物的制备方法简单,原料廉价易得,后处理简单,对环境相对友好,有望用于大规模的工业化生产。
- 还没有人留言评论。精彩留言会获得点赞!