PRMT5衍生多肽及其应用
本发明属于抗肿瘤药物研发与治疗,具体涉及一种抗肿瘤prmt5衍生多肽及其应用。
背景技术:
1、蛋白精氨酸甲基化是最常见的翻译后修饰之一,主要指在蛋白精氨酸甲基化酶prmts(protein arginine methyltransferases)的调控下,将s腺苷甲硫氨酸上的甲基基团转移到蛋白质精氨酸侧链的胍基氮原子上。prmts可根据生成的甲基化精氨酸形式的不同分为三种类型:i型(prmt1,prmt2,prmt3,prmt4,prmt6,prmt8)主要催化生成单甲基精氨酸和非对称二甲基精氨酸,ii型(prmt5,prmt9)主要催化形成单甲基精氨酸和对称二甲基精氨酸,iii型(prmt7)主要催化生成单甲基精氨酸。
2、prmt5是主要的ii型蛋白精氨酸甲基化酶,在真核生物中广泛表达。prmt5的结构包括n端的三聚磷酸异构酶(triosephosphate isomerase,tim)结构域,中间的罗斯曼折叠(rossmann-fold)结构域以及c端的β-barrel结构域。prmt5通常与mep50结合,形成异八聚体复合物,从而维持其甲基化酶活性。作为一种表观遗传酶,prmt5参与多种生物学进程,包括转录调控、rna代谢以及细胞周期调控等。此外,prmt5在多种肿瘤中高表达,促进肿瘤细胞增殖分化以及侵袭迁移,维持肿瘤细胞干性。因此,prmt5作为抗癌药物的重要靶点受到关注,已有多种prmt5抑制剂进入临床试验,由于其特异性和安全性尚未得到改善,目前没有抑制剂被批准上市。
3、epha2属于受体酪氨酸激酶(receptor tyrosine kinases,rtk)超家族成员,是一个由976个氨基酸组成、分子量为130kd的跨膜糖蛋白。epha2蛋白由三个结构域构成:即n端的胞外结构域、跨膜结构域以及c端的胞内结构域。epha2的c端胞内结构域主要由蛋白激酶区和sam(sterile alpha motif)区组成。大量的研究表明,epha2在许多肿瘤中高表达,具有促进肿瘤细胞生长、侵袭和转移、增强肿瘤血管新生、维持肿瘤干性的作用,高表达的epha2也与肿瘤演进以及患者不良预后密切相关。
4、prmt5和epha2均是潜在的抗癌靶点,两个蛋白之间的相互作用及epha2的精氨酸甲基化修饰至今未见报道。本发明采用免疫共沉淀-高通量质谱分析技术(靶向蛋白质组学技术)筛选鼻咽癌细胞epha2的互作蛋白,发现prmt5是epha2的互作蛋白,并且epha2存在精氨酸甲基化修饰。免疫共沉淀实验证实prmt5是鼻咽癌细胞epha2的互作蛋白,在hek293细胞中外源性prmt5与epha2也存在相互作用,gst pull-down实验证实prmt5与epha2蛋白可直接相互作用。蛋白质互作是细胞生化反应网络的一个主要组成部分,参与调节细胞各种生理功能,如蛋白质互作通过调控蛋白质修饰、稳定性和亚细胞定位等调控细胞的功能及其信号传导。研究表明,蛋白质互作不仅与肿瘤密切相关,而且是重要的药物靶点,调控蛋白质互作的多肽有望成为新的抗癌药物。因此,基于prmt5与epha2是重要的肿瘤蛋白质以及两者相互作用,阻断prmt5与epha2相互作用很可能研发出新的抗肿瘤药物。
技术实现思路
1、本发明的目的是提供一种抗肿瘤的prmt5衍生多肽及其应用。本发明是基于我们发现了一种新的机理:prmt5通过n端251-324位氨基酸与epha2结合并在r816位点甲基化epha2,抑制cbl介导的epha2泛素化降解,稳定epha2促进肿瘤发生发展。进一步根据分子模拟对接结果,设计并发明了一种prmt5的279-298位氨基酸衍生多肽p20,p20多肽能特异性阻断prmt5与epha2的相互作用,降低epha2 r816位点的甲基化,增加cbl与epha2的结合,促进epha2的泛素化降解,靶向下调epha2的水平,发挥抑制鼻咽癌细胞干性、增加化疗敏感性,抑制体内肿瘤起始能力的作用。
2、主要
技术实现要素:
如下:
3、prmt5衍生多肽,是来源于prmt5蛋白的279-298位氨基酸,多肽序列为sylqyleylsqnrpppnaye。
4、所述的多肽:包括在多肽序列基础上通过n末端或c末端的修饰,氨基酸的缺失、替换、环化或手性变换所得到的具有抗肿瘤作用的多肽系列。
5、本发明第二个目的是提供一种鼻咽癌治疗制剂,包括所述的prmt5衍生多肽或者在prmt5衍生多肽序列基础上通过n末端或c末端的修饰,氨基酸的缺失、替换、环化或手性变换所得到的具有抗肿瘤作用的多肽系列。
6、本发明第三个目的是提供所述的抗肿瘤多肽在制备抗肿瘤药物中的用途。
7、所述肿瘤类型为鼻咽癌。
8、本发明第四个目的是提供所述的多肽在制备阻断prmt5结合epha2制剂中的应用。
9、本发明第五个目的是提供所述的多肽在制备降低epha2的r816位点精氨酸对称性甲基化制剂中的应用。
10、本发明第六个目的是提供所述的多肽在制备促进epha2与cbl结合制剂中的应用。
11、本发明第七个目的是提供所述的多肽在制备促进epha2泛素化降解制剂中的应用。
12、本发明采用靶向蛋白质组学技术筛选鼻咽癌细胞epha2的互作蛋白,发现prmt5是epha2的互作蛋白,免疫共沉淀证实prmt5是鼻咽癌细胞epha2的互作蛋白,并能甲基化epha2。邻位连接实验也证实鼻咽癌细胞prmt5与epha2存在相互作用。hek293细胞中外源性prmt5也能与epha2相互作用并甲基化epha2,gst pull-down实验证实prmt5与epha2蛋白可直接相互作用。体外甲基化实验证实prmt5可以甲基化epha2。见图1。
13、本发明发现在鼻咽癌细胞系中prmt5可以抑制epha2的泛素化降解,显著增加epha2的稳定性,延长epha2的半衰期。见图2。
14、本发明采用靶向蛋白质组学技术鉴定epha2的甲基化位点,免疫共沉淀实验证实prmt5使epha2的r816位点发生甲基化。见图3。
15、本发明发现了prmt5稳定epha2的机制:即prmt5通过甲基化epha2的r816位点,使epha2与e3泛素连接酶cbl的结合减少,抑制cbl介导的epha2泛素化降解,增加epha2的稳定性。见图4。
16、本发明确定了prmt5与epha2的相互作用区域:构建多种prmt5和epha2的截短突变体,采用免疫共沉淀方法分析区域截短的prmt5与epha2的相互作用,发现与prmt5与epha2相互作用区域位于prmt5的n端251-324位氨基酸以及epha2的707-807位氨基酸。进一步使用分子模拟对接的方法,用prmt5的251-324aa结构域和epha2的707-807aa结构域进行分子对接,发现epha2结合在prmt5的279-298位氨基酸。见图5。
17、综上所述,本发明发现在鼻咽癌细胞中prmt5与epha2结合并甲基化epha2的r816位点,抑制epha2的泛素化降解,稳定epha2。其中prmt5的n端251-324位氨基酸,尤其是279-298位氨基酸为prmt5与epha2结合的关键区域。研究结果为prmt5的n端279-298位氨基酸多肽作为鼻咽癌的治疗性多肽提供了理论和实验依据。
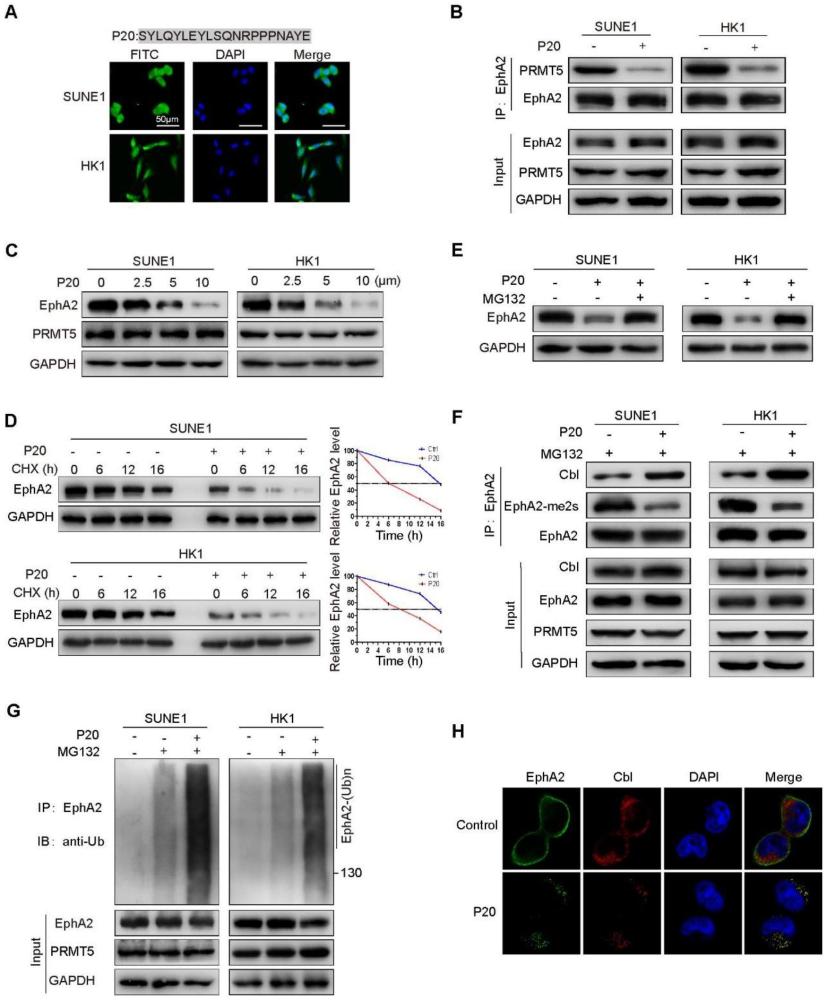
18、本发明发现体外合成的prmt5的n端279-298位氨基酸多肽p20能进入肿瘤细胞,可明显抑制细胞内prmt5与epha2的结合,降低epha2的r816位点的甲基化,促进cbl与epha2的结合,降低epha2的稳定性,导致epha2的泛素化降解,呈剂量依赖性下调epha2水平。见图6。
19、本发明发现p20多肽能通过促进鼻咽癌细胞epha2的泛素化降解,显著抑制鼻咽癌细胞干性特征,增加顺铂的化疗敏感性。见图7。
20、本发明发现p20多肽能显著抑制体内鼻咽癌细胞干性特征,从而抑制鼻咽癌细胞的肿瘤起始能力。见图8。
21、综上所述,本发明发现prmt5衍生肽p20可靶向降低epha2,抑制鼻咽癌的干性特征,增强化疗敏感性,抑制体内鼻咽癌细胞的肿瘤起始能力。
22、本发明通过一系列研究发现,鼻咽癌细胞中prmt5与epha2之间存在相互作用,prmt5通过抑制epha2泛素化降解而稳定epha2。其中prmt5的n端279-298位20个氨基酸是关键的epha2结合区域。体内和体外实验证实,prmt5 n端279-298位氨基酸多肽能进入鼻咽癌细胞,可抑制细胞内prmt5与epha2的结合,促进epha2的降解,抑制鼻咽癌细胞干性、增加化疗敏感性及抑制体内肿瘤起始能力,达到治疗肿瘤的效果。此多肽抗肿瘤作用明显,无明显的毒副作用。
- 还没有人留言评论。精彩留言会获得点赞!