靶向Claudin18.2嵌合抗原和嵌合转换开关受体、其修饰的免疫细胞及其用途的制作方法
本发明属于细胞免疫治疗,具体涉及靶向claudin 18.2嵌合抗原和嵌合转换开关受体、其修饰的免疫细胞及其用途。
背景技术:
1、紧密蛋白(claudin,cldn)是正常组织紧密连接中重要的一种蛋白质,具有4个跨膜结构域,其功能是参与细胞旁通透性和电导等过程的调节。claudin家族包含至少27个成员,其中claudin 18.2(cldn18.2)是claudin蛋白家族中的一员,它是一种具有高度组织表达特异性的跨膜蛋白,在正常组织中表达水平非常低,但在非恶性胃粘膜中高度选择性表达,与在邻近细胞表面表达的claudin 18.2-分子结合构成紧密连接复合体,形成选择性可渗透屏障,实现组织特异性渗透。这种紧密连接蛋白在恶性转化过程中会暴露在肿瘤细胞表面上,使其成为靶向癌症治疗的一个可接触的靶标。研究发现,在正常生理状态下,claudin 18.2仅在胃粘膜上已分化的上皮细胞中表达,而在其它的健康组织中均无表达。但在胃肠道肿瘤如胃癌、结直肠腺癌、食管癌、胰腺癌,以及肺癌、肺腺癌、肝癌、卵巢癌、肾癌等多种肿瘤中,claudin18.2却呈现高表达的现象。肿瘤细胞极性的紊乱可导致细胞表面claudin 18.2蛋白表位暴露,并出现异常激活。这一正常组织局限性表达而肿瘤中特异性高表达的特点使得claudin 18.2成为了理想的实体瘤治疗靶点。
2、现有的car-t细胞疗法在cldn18.2表达阳性的晚期胃肠道肿瘤临床试验中显示出治疗潜力,整体耐受性良好和安全可控。但是car-t疗法在胃肠道肿瘤等实体瘤中仍旧面临诸多挑战。肿瘤微环境中低ph、低氧、高渗透等环境会有免疫抑制效果,不利于car-t细胞的存活和抗肿瘤作用。同时肿瘤微环境中存在多种免疫抑制细胞,分泌转化生长因子β(tgf-β)促进肿瘤细胞生长转移和抑制细胞毒性t细胞。另一方面,t细胞的免疫活性存在内源性调节机制,活化的t细胞会上调表达多种免疫抑制分子例如pd-1,使t细胞进入耗竭状态而凋亡。
3、claudin 18.2作为治疗实体瘤的一个重要靶点,针对其car-t细胞的研究尚处于起步阶段,国内也尚未有该靶点的药物上市。鉴于此,不断改进和完善car的结构,创新和开发新的car-t细胞及其疗法、改变免疫被抑制的微环境、提高car-t细胞的特异性和抗肿瘤活性,不仅可以更精准地定位肿瘤靶点,而且能更高效地杀伤肿瘤,对于提高临床疗效具有重要的意义和广泛的应用价值。
技术实现思路
1、本发明的目的之一是提供一种靶向claudin 18.2的嵌合抗原受体、含有该嵌合抗原受体的免疫效应细胞,及其应用。所要解决的技术问题不限于所描述的技术主题,本领域技术人员通过以下描述可以清楚地理解本文未提及的其它技术主题。
2、为实现上述目的,本发明首先提供了嵌合抗原受体,所述嵌合抗原受体包括抗原结合结构域、跨膜结构域和胞内信号结构域,所述抗原结合结构域包括第一单域抗体和第二单域抗体,所述第一单域抗体包含氨基酸序列分别是seq id no.1的第47-54位的互补决定区cdr1、seq id no.1的第72-78位的互补决定区cdr2和seq id no.1的第116-130位的互补决定区cdr3;
3、所述第二单域抗体包含氨基酸序列分别是seq id no.1的第182-188位的互补决定区cdr1、seq idno.1的第206-215位的互补决定区cdr2和seq id no.1的第254-267位的互补决定区cdr3。
4、所述嵌合抗原受体、所述第一单域抗体和所述第二单域抗体均靶向claudin18.2。
5、所述第一单域抗体的名称可为claudin 18.2-vhh#223。所述第二单域抗体的名称可为claudin18.2-vhh#357。
6、所述互补决定区(cdr)的序列根据kabat编号系统定义。
7、所述单域抗体只有重链抗体的可变区(vhh),依次由框架区fr1、互补决定区cdr1、框架区fr2、互补决定区cdr2、框架区fr3、互补决定区cdr3和框架区fr4组成。
8、上述嵌合抗原受体中,所述第一单域抗体可为下述任一种:
9、a1)氨基酸序列如seq id no.1的第22-141位所示的蛋白质;
10、a2)将seq id no.1的第22-141位所示的氨基酸序列经过氨基酸残基的置换、缺失和/或添加得到的与a1)所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质;
11、a3)在a1)或a2)的n端和/或c端连接标签或信号肽得到的具有相同功能的融合蛋白质;
12、所述第二单域抗体可为下述任一种:
13、b1)氨基酸序列如seq id no.1的第157-278位所示的蛋白质;
14、b2)将seq id no.1的第157-278位所示的氨基酸序列经过氨基酸残基的置换、缺失和/或添加得到的与b1)所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质;
15、b3)在b1)或b2)的n端和/或c端连接标签或信号肽得到的具有相同功能的融合蛋白质。
16、进一步地,氨基酸序列的不一致处可在框架区(fr),例如在框架区中具有一个或几个氨基酸置换、缺失或添加。
17、所述框架区(framework region,fr)为本领域已知的,是指可变区(vhh)中除了cdr以外的区域,包括fr1、fr2、fr3和fr4。
18、所述几个可以是2、3、4、5、6、7、8、9、10或更多个。
19、进一步地,所述第二单域抗体可位于所述第一单域抗体的n端或c端。具体地,所述第二单域抗体位于所述第一单域抗体的c端。
20、进一步地,所述第一单域抗体和所述第二单域抗体可通过接头(linker)连接。
21、所述接头(linker)可为柔性肽接头,例如包括甘氨酸、丝氨酸、脯氨酸和/或赖氨酸残基的肽接头。所述肽接头可由1-40个氨基酸组成。
22、进一步地,所述接头(linker)包括但不限于:(g)n、(s)n、(gxs)n、(sxg)n、(gssgg)n(seq id no.11)、(ggsgg)n(seq id no.12)、(gsggsg)n(seq id no.13)、(gsgsgs)n(seqid no.14)、(ggqgg)n(seq id no.15)、(eaaak)n(seq id no.16)和iegrmd(seq idno.17),以及它们的各种组合。其中:n可以是1-10之间的任何整数;x可以是1-6之间的任何整数。在本发明的一个实施方案中,所述接头为(ggggs)3(seq id no.18)。
23、所述第一单域抗体(包括其抗原结合片段)和所述第二单域抗体(包括其抗原结合片段)可通过接头连接成靶向claudin 18.2两个不同表位的双表位单域抗体。所述双表位单域抗体构成本发明所述嵌合抗原受体的抗原结合结构域。
24、进一步地,所述嵌合抗原受体的抗原结合结构域从n端到c端依次可为所述第一单域抗体、所述接头、所述第二单域抗体。所述抗原结合结构域的氨基酸序列可如seq idno.1的第22-278位所示。
25、上述嵌合抗原受体中,所述胞内信号结构域包括共刺激结构域、激活结构域、干扰素和嵌合转换受体,所述嵌合转换受体包括pd-1的胞外区、tgfβ受体ii型的胞外区,以及cd27的跨膜区和胞浆区。
26、所述嵌合转换受体名称可为pd-1&trii&cd27,可用于将pd-1和tgfβ传导的免疫抑制性信号转换为cd27介导的t细胞活化信号,从而实现对肿瘤细胞的高效和持久性杀伤,提高car细胞抵御免疫抑制性肿瘤微环境的能力。
27、进一步地,所述嵌合转换受体可位于所述嵌合抗原受体的c末端。
28、进一步地,所述嵌合转换受体从n端到c端依次可为pd-1的胞外区、tgfβ受体ii型的胞外区、cd27的跨膜区和胞浆区。
29、进一步地,所述嵌合转换受体的氨基酸序列可如seq id no.1的第739-1144位所示。
30、所述干扰素可为i型干扰素(如ifnα(ifn-α)、ifnβ(ifn-β)或ifnω(ifn-ω))。
31、进一步地,所述干扰素可为ifnα。
32、进一步地,所述ifnα的氨基酸序列可如seq id no.1的第529-716位所示。
33、所述胞内信号结构域可包含一个、两个或更多个共刺激结构域。所述共刺激结构域可包含共刺激分子的整个细胞内部分,或其功能片段。“共刺激分子”可指在t细胞上与共刺激配体特异性结合,由此介导t细胞的共刺激反应(例如增殖)的同源结合配偶体。
34、所述共刺激结构域可以是来自共刺激分子的胞内信号传导结构域,例如所述共刺激结构域可来源于card11、cd2、cd7、cd27、cd28、cd30、icam-1(cd54)、lfa-1(cd11a)、cd134(ox40)、cd137(4-1bb)、2b4、cd150(slamf1)、cd270(hvem)、cd278(icos)或dap10的胞内信号传导结构域。
35、所述激活结构域可来源于cd3ζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b或cd66d的胞内信号传导结构域。
36、上述嵌合抗原受体中,所述共刺激结构域可来源于4-1bb,和/或,所述激活结构域可来源于cd3ζ。
37、进一步地,所述共刺激结构域可为4-1bb的胞内信号传导结构域。
38、进一步地,所述共刺激结构域的氨基酸序列可如seq id no.1的第348-394位所示。
39、进一步地,所述激活结构域可为cd3ζ的胞内信号传导结构域。
40、进一步地,所述激活结构域的氨基酸序列可如seq id no.1的第395-506位所示。
41、所述胞内信号结构域还可包括接头,用于连接所述cd3ζ、ifnα和嵌合转换受体。
42、进一步地,所述接头可为可裂解连接子。
43、进一步地,所述可裂解连接子包括p2a、f2a、t2a和e2a,或它们的任何组合,但不限于此。所述p2a的氨基酸序列可如seq id no.7所示。所述f2a的氨基酸序列可如seq idno.8所示。所述t2a的氨基酸序列可如seq id no.9所示。所述e2a的氨基酸序列可如seq idno.10所示。
44、在本发明的一个或多个实施方案中,所述可裂解连接子为p2a。
45、虽然本发明设计构建的嵌合抗原受体中采用了p2a作为连接接头,但本发明不限于该特定接头,本领域技术人员可对本发明嵌合抗原受体中的p2a进行替换,例如可采用与p2a具有相同“自我剪切”功能的f2a、t2a和e2a等。只要构建的嵌合抗原受体与本发明的嵌合抗原受体功能相同,均视为与本发明嵌合抗原受体等同的嵌合抗原受体。
46、所述胞内信号结构域从n端到c端依次可为共刺激结构域4-1bb、激活结构域cd3ζ、p2a、ifnα、p2a、嵌合转换受体pd-1&trii&cd27。
47、进一步地,所述胞内信号结构域的氨基酸序列可如seq id no.1的第348-1144位所示。
48、本文所述嵌合抗原受体中,所述跨膜结构域可来源于t细胞受体的α、β或ζ链、cd3ζ、cd8a(cd8α)、cd4、cd9、cd45、cd16、cd19、cd22、cd28、cd28t、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd152或cd154的跨膜结构域。
49、进一步地,所述跨膜结构域位于所述抗原结合结构域和所述胞内信号结构域之间,负责维持car分子在t细胞膜上的稳定性。
50、进一步地,所述跨膜结构域可为cd8a跨膜区(tm)。
51、本文所述嵌合抗原受体还可包括位于所述跨膜结构域n端的铰链结构域(hinge)。
52、进一步地,所述铰链结构域可来源于cd8a(cd8α)、cd4、cd5、cd7、cd28、cd134、cd137、icos、igg1、igg2、igg3、igg4、iga、igd、ige或igm的铰链区。
53、进一步地,所述铰链结构域可为cd8a铰链区(hinge)。
54、进一步地,所述cd8a铰链区(hinge)和跨膜区(tm)的氨基酸序列可如seq id no.1的第279-347位所示。
55、本文所述嵌合抗原受体还可包括位于所述抗原结合结构域n端的信号肽(signal)。
56、进一步地,所述信号肽可来源于cd4、cd8、cd8a、cd28、cd137和gm-csf的信号肽。
57、进一步地,所述信号肽可为人源cd8信号肽。所述人源cd8信号肽的氨基酸序列可如seq id no.1的第1-21位所示。
58、本文所述嵌合抗原受体自n-端至c-端依次可为信号肽(signal)、第一单域抗体、接头(linker)、第二单域抗体、cd8a铰链区、cd8a跨膜区、共刺激结构域4-1bb、激活结构域cd3ζ、可裂解连接子p2a、ifnα、可裂解连接子p2a、嵌合转换受体pd-1&trii&cd27。
59、进一步地,本文所述嵌合抗原受体可为下述任一种:
60、c1)氨基酸序列如seq id no.1的第22-1144位所示的蛋白质;
61、c2)将seq id no.1的第22-1144位所示的氨基酸序列经过氨基酸残基的置换、缺失和/或添加得到的与c1)所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质;
62、c3)在c1)或c2)的n端和/或c端连接标签或信号肽得到的具有相同功能的融合蛋白质。
63、进一步地,c3)中所述融合蛋白质的氨基酸序列可如seq id no.1所示。
64、氨基酸序列是seq id no.1的第22-1144位的蛋白质为不含有信号肽的嵌合抗原受体,含有信号肽的嵌合抗原受体的氨基酸序列可如seq id no.1所示。
65、本文所述置换可为保守置换。
66、a3)、b3)、c3)中所述连接可通过肽键(peptide bond)直接连接,或通过接头连接。
67、为了使本文所述嵌合抗原受体便于分离、纯化、检测和/或定位,可在所述嵌合抗原受体的氨基末端或羧基末端连接标签蛋白。所述标签包括但不限于:gst(谷胱甘肽巯基转移酶)标签蛋白、trx(硫氧还蛋白)标签蛋白、氮利用底物a(nusa)标签蛋白、his标签蛋白(his-tag)、mbp(麦芽糖结合蛋白)标签蛋白、flag标签蛋白、sumo标签蛋白、ha(流感血凝素)标签蛋白、myc标签蛋白、lacz标签蛋白、cbd(纤维素结合域)标签蛋白、噬菌体t7蛋白激酶(t7pk)标签蛋白、gfp(绿色荧光蛋白)、cfp(青色荧光蛋白)、yfp(黄绿色荧光蛋白)、mcherry(单体红色荧光蛋白)或avitag标签蛋白。本领域技术人员已知如何根据期望目的选择合适的标签蛋白。标签的使用不改变目的蛋白的功能,其目的在于分离、纯化、检测或示踪,因此适用于本技术的标签蛋白并不局限于特定种类。标签可以通过本领域已知的化学裂解法或酶法(如引入蛋白酶切位点利用tev蛋白酶切割去除标签)与目的蛋白进行分离。
68、本发明还提供了生物材料,所述生物材料可为下述任一种:
69、d1)编码本文中任一所述嵌合抗原受体的核酸分子;
70、d2)含有d1)所述核酸分子的表达盒;
71、d3)含有d1)所述核酸分子的重组载体;
72、d4)含有d1)所述核酸分子的重组微生物;
73、d5)含有d1)所述核酸分子的重组宿主细胞。
74、所述生物材料均可表达本文中任一所述嵌合抗原受体。
75、所述重组载体可为将编码本文中任一所述嵌合抗原受体的核酸分子(如seq idno.2所示的dna分子)克隆到骨架载体中得到的重组载体。虽然本发明提供的实施例利用的骨架载体是puc57载体和逆转录病毒载体,但本发明可不限于该特定载体。本领域技术人员可采用其它合适的载体,例如慢病毒载体、腺病毒载体、腺相关病毒载体、非病毒载体转位子系统、crispr-cas系统,或其他用于克隆或表达的骨架载体等。只要该载体能够克隆或表达编码本文中任一所述嵌合抗原受体的核酸分子即可。
76、进一步地,所述重组载体具体可为重组逆转录病毒载体mp71-claudin 18.2car-ic。所述mp71-claudin18.2car-ic是将逆转录病毒载体mp71的noti和ecori识别位点间的片段(小片段)替换为核苷酸序列是序列表中seq id no.2的dna片段,保持逆转录病毒载体mp71的其他核苷酸序列不变,得到的重组表达载体。
77、上述生物材料中,所述核酸分子可为下述任一种:
78、e1)编码序列或核苷酸序列如seq id no.2的第64-3432位或seq id no.2所示的dna分子;
79、e2)与seq id no.2的第64-3432位限定的核苷酸序列具有75%以上同一性,且编码氨基酸序列如seq id no.1的第22-1144位所示的嵌合抗原受体的dna分子;
80、e3)与seq id no.2限定的核苷酸序列具有75%以上同一性,且编码氨基酸序列如seq id no.1所示的嵌合抗原受体的dna分子。
81、seq id no.2所示的dna分子编码氨基酸序列为seq id no.1的嵌合抗原受体(包含信号肽)。
82、seq id no.2的第64-3432位所示的dna分子编码氨基酸序列为seq id no.1的第22-1144位所示的嵌合抗原受体(不包含信号肽)。
83、本领域普通技术人员可以很容易地采用已知的方法,例如定点突变(包括寡核苷酸引物介导的定点突变、pcr介导的定点突变和盒式突变等)或定向进化(包括易错pcr、dna改组和体外随机引发重组等)的方法,对本发明的编码本文中任一所述嵌合抗原受体的核苷酸序列进行突变。那些经过人工改造的、与本发明编码本文中任一所述嵌合抗原受体的核苷酸序列(如seq id no.2)具有75%以上同一性的核苷酸序列,只要编码本文中任一所述嵌合抗原受体且具有与本文中任一所述嵌合抗原受体相同的功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
84、本文所述核酸分子还可包括在seq id no.2所示核苷酸序列基础上经密码子偏好性改造得到的核酸分子。考虑到密码子的简并性以及不同物种密码子的偏爱性,本领域技术人员可以根据需要使用适合特定物种表达的密码子。
85、与本文任一所述嵌合抗原受体的序列具有改善的亲和力的变体可通过采用在本领域已知的方法来获得,并包括在本发明的保护范围内。例如,氨基酸置换可用于获得具有进一步改善的亲合力的嵌合抗原受体。或者,核苷酸序列的密码子优化也可用来改善用于产生嵌合抗原受体的表达系统中的翻译效率。
86、在某些实施方案中,可以在本发明任一所述嵌合抗原受体中的单域抗体的一个或多个互补决定区或框架区内发生置换、插入或删除,只要此类变化不实质性降低嵌合抗原受体结合抗原的能力。例如,可以对互补决定区和/或框架区做出保守变化(例如,保守替代,本领域技术人员所熟知,氨基酸的保守性取代不改变蛋白质的性质和功能),其不实质性降低结合亲和力。例如,此类变化可以在互补决定区中的抗原接触残基以外。
87、本发明还提供了修饰的免疫效应细胞,所述修饰的免疫效应细胞包含本文中任一所述的嵌合抗原受体或所述核酸分子。
88、所述修饰的免疫效应细胞可为本文中任一所述嵌合抗原受体修饰的免疫效应细胞(即car修饰的免疫效应细胞,car细胞),其表达本文中任一所述的嵌合抗原受体。
89、进一步地,所述免疫效应细胞可包括t细胞、nk细胞、b细胞、巨噬细胞、树突状细胞(dc)、外周血单核细胞(pbmc)和单核细胞(mc)。
90、所述免疫效应细胞还可包括(或来源于)能够在体内或体外被诱导分化为免疫效应细胞的干细胞,例如成体干细胞、胚胎干细胞、脐带血干细胞、祖细胞、骨髓干细胞、诱导多能干细胞(ipsc)、全能干细胞或造血干细胞(hsc)。
91、所述免疫效应细胞可以是自体的,也可以是非自体的(同种异体的、同基因的或异种的)。进一步地,所述免疫效应细胞是自体的或同种异体的。
92、进一步地,所述修饰的免疫效应细胞可包括car-t细胞、car-nk细胞、car-nkt细胞、car-γδt细胞、car-αβt细胞、car-调节性t细胞(car-treg细胞)、car-mait细胞、car-b细胞、car-巨噬细胞(car-m细胞)、car-树突状细胞(car-dc细胞)、car-外周血单核细胞(car-pbmc细胞)、car-单核细胞(car-mc细胞)、car-ipsc细胞和car-psc细胞但不限于此。
93、进一步地,所述免疫效应细胞可为t细胞。
94、所述t细胞可包括cd8+t细胞、cd4+t细胞、调节性t细胞(treg)、初始t细胞、效应t细胞、记忆t细胞(包括干性记忆t细胞、中央记忆t细胞和效应记忆t细胞)、αβt细胞、γδt细胞、自然杀伤性t细胞(natural killer t cell,nkt细胞)和黏膜相关恒定t细胞(mucosal-associated invariant t cells,mait细胞)等但不限于此。
95、进一步地,所述t细胞可来源于肿瘤患者或健康志愿者。
96、进一步地,所述t细胞可来源于外周血、单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、感染部位组织、腹水、胸腔积液、脾组织和肿瘤但不限于此。
97、所述t细胞可以使用本领域技术人员已知的多种技术(例如密度梯度分离技术、黏附分离法、磁珠分离技术、流式细胞分选技术等)分离获得。
98、进一步地,所述修饰的免疫效应细胞可为car-t细胞。
99、进一步地,所述car-t细胞可为claudin 18.2car-ic t细胞。
100、所述claudin 18.2car-ic t细胞是通过基因工程体外重组的方法将本发明构建的嵌合抗原受体的基因转入t细胞中稳定表达得到的car-t细胞。
101、进一步地,所述claudin 18.2car-ic t细胞含有和/或表达seq id no.2或seq idno.2的第64-3432位所示的dna分子。
102、所述claudin 18.2car-ic t细胞可具有下述至少任一种特性:
103、(1)分泌t细胞特异性效应分子ifn-γ;
104、(2)特异性杀伤claudin 18.2阳性肿瘤细胞;
105、(3)抑制claudin 18.2阳性肿瘤细胞增殖;
106、(4)抑制claudin 18.2阳性肿瘤生长;
107、(5)抗肿瘤微环境的免疫抑制作用和/或t细胞耗竭作用;
108、(6)将pd-1和tgfβ传导的免疫抑制性信号转换为cd27介导的t细胞活化信号。
109、本发明还提供了本文中任一所述的嵌合抗原受体、所述生物材料或本文中任一所述的修饰的免疫效应细胞在制备具有如下任一种功能的产品中的用途:
110、f1)预防或治疗肿瘤;
111、f2)预防或治疗claudin 18.2靶点相关疾病;
112、f3)杀伤claudin 18.2阳性的肿瘤细胞;
113、f4)抑制claudin 18.2阳性的肿瘤细胞增殖;
114、f5)抑制claudin 18.2阳性的肿瘤生长;
115、f6)抗肿瘤微环境的免疫抑制作用和/或t细胞耗竭作用;
116、f7)将pd-1和tgfβ传导的免疫抑制性信号转换为cd27介导的t细胞活化信号。
117、本文所述肿瘤或claudin 18.2靶点相关疾病可为claudin18.2阳性肿瘤。
118、进一步地,所述claudin18.2阳性肿瘤可为claudin18.2阳性实体肿瘤。
119、进一步地,所述claudin18.2阳性实体肿瘤可为claudin18.2阳性消化系统肿瘤。
120、进一步地,所述claudin18.2阳性肿瘤可为claudin18.2阳性癌症,也可为claudin18.2阳性的间皮瘤。
121、进一步地,所述癌症可选自胃癌、食管癌、胰腺癌、结直肠腺癌、肺癌、肺腺癌、肝癌、肾癌、卵巢癌、支气管癌、乳腺癌、膀胱癌、头颈癌、胆囊癌、胆管癌和胃食管交界处(gej)腺癌。
122、进一步地,所述癌症包括早期癌症、中期癌症、中晚期癌症、晚期癌症、复发性癌症、转移性癌症等。
123、本发明还提供了本文中任一所述的嵌合抗原受体或所述生物材料在制备修饰的免疫效应细胞(如car-t细胞)中的用途。
124、本发明还提供了用于预防或治疗claudin 18.2靶点相关疾病的药物组合物,所述药物组合物包括本文中任一所述的嵌合抗原受体、所述生物材料或本文中任一所述的修饰的免疫效应细胞,以及一种或多种药学上可接受的载体。
125、所述药学上可接受的载体选自稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、防腐剂、稳定剂、吸收促进剂、吸附载体、表面活性剂、润滑剂、烟雾化剂、悬浮剂、增塑剂和分散剂。
126、所述药物组合物的剂型可包括吸入制剂、口服制剂和注射制剂但不限于此。所述吸入制剂可为吸入气雾剂、吸入粉雾剂、吸入喷雾剂、吸入液体制剂、吸入雾化剂、吸入用冻干粉针剂或鼻喷剂。所述口服制剂可为片剂、粉剂、胶囊剂、颗粒剂、丸剂、散剂、膏剂、固体饮料或口服液。所述注射制剂可为注射液或注射用粉针剂。
127、为了将所述药物组合物制成注射用制剂,如溶液剂、乳剂、冻干粉针剂和混悬剂,可以使用本领域常用的所有稀释剂(载体),例如,水、盐水、磷酸盐缓冲盐水、乙醇、聚乙二醇、1,3-丙二醇、乙氧基化的异硬脂醇、多氧化的异硬脂醇、聚氧乙烯山梨醇脂肪酸酯等。另外,为了制备等渗注射液,可以向注射用制剂中添加适量的氯化钠、葡萄糖或甘油等载体,此外,还可以添加常规的助溶剂、缓冲剂、ph调节剂等载体。
128、所述药物组合物还可包括细胞冻存液。所述细胞冻存液用于将细胞进行冷冻保存,防止在冻融过程中形成冰晶对细胞造成伤害,其主要成分可包括:二甲基亚砜、氯化钠、人血白蛋白、右旋糖酐葡萄糖、右旋糖和/或血浆电解质-a等。
129、所述药物组合物可具有下述至少一种用途:(1)用于预防或治疗claudin 18.2靶点相关疾病;(2)杀伤claudin 18.2阳性的肿瘤细胞;(3)抑制claudin 18.2阳性的肿瘤细胞增殖;(4)抑制claudin 18.2阳性的肿瘤生长;(5)抗肿瘤微环境的免疫抑制作用和/或t细胞耗竭作用;(6)将pd-1和tgfβ传导的免疫抑制性信号转换为cd27介导的t细胞活化信号。
130、所述药物组合物的活性成分可为本文中任一所述的修饰的免疫效应细胞(如claudin 18.2car-ic t细胞)。
131、所述药物组合物可根据本领域中熟知并且通常实践的方法制备。参见例如,remington:the science and practice of pharmacy,第22版,loyd v.allen等人编,pharmaceutical press(2012)。所述药物组合物优选在gmp或cgmp条件下制造。
132、本发明还提供了用于制备car-t细胞的试剂盒,所述试剂盒可包括本文中任一所述的嵌合抗原受体或所述生物材料。
133、进一步地,所述试剂盒还可包括下述试剂中的一种或几种:淋巴细胞分离液、cd3/cd28单克隆抗体包被的磁珠(cd3/cd28磁珠)、磷酸盐缓冲液(如杜氏磷酸盐缓冲液)、细胞培养基、il-2、il-7、il-15、il-21、抗生素、细胞冻存液和病毒载体。
134、所述试剂盒的各种试剂组分可以存在于分开的容器中,或者可以全部或部分预组合成试剂混合物。
135、所述试剂盒的组分可以溶液形式提供,例如水溶液的形式提供。在以水溶液状态存在的情况下,这些成分的浓度或含量是本领域技术人员能够根据不同需求而方便地确定的。例如,用于储存的目的时,组分的浓度可以较高的形式存在,当处于工作状态或使用时,可通过稀释上述较高浓度的溶液来将浓度降低至工作浓度。
136、本发明还提供了制备本文中任一所述的修饰的免疫效应细胞的方法,所述方法包括:将编码本文中任一所述嵌合抗原受体的核酸分子导入免疫效应细胞中表达,得到所述修饰的免疫效应细胞。
137、进一步地,所述导入的方法可包括磷酸钙共沉淀法、阳离子聚合物法(如deae-葡聚糖转染法)、阳离子脂质体法、电穿孔法(即电转染法)、显微注射、基因枪法或病毒介导法(如逆转录病毒感染法、腺病毒感染法、慢病毒感染法)等但不限于此。
138、进一步地,所述免疫效应细胞可为t细胞,所述修饰的免疫效应细胞可为car-t细胞。
139、进一步地,所述car-t细胞的制备方法可包括如下步骤:
140、(1)将编码本文中任一所述嵌合抗原受体的核酸分子克隆到病毒载体中,得到重组病毒载体;
141、(2)将所述重组病毒载体导入包装细胞进行包装,得到重组病毒;
142、(3)将所述重组病毒感染(转染)人的t细胞,得到所述car-t细胞。
143、进一步地,所述核酸分子可为核苷酸序列如seq id no.2或seq id no.2的第64-3432位所示的claudin18.2car-ic基因。
144、进一步地,所述病毒载体可包括杆状病毒、逆转录病毒、慢病毒、腺病毒、腺相关病毒、痘病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)和疱疹病毒(如单纯疱疹病毒)但不限于此。优选逆转录病毒、腺病毒、腺相关病毒或慢病毒。
145、进一步地,所述病毒载体可为逆转录病毒载体(如逆转录病毒载体mp71)。
146、进一步地,所述包装细胞用于包装缺乏编码病毒包装所需蛋白质的至少一种基因的病毒载体质粒,其可为病毒包装成为重组病毒提供全面的病毒蛋白,且其本身不能产生任何形式的病毒颗粒。提供病毒包装所缺乏的蛋白质或多肽的任何细胞都可被考虑用作包装细胞。合适的包装细胞是本领域技术人员熟知的,例如eco细胞、pg13细胞、hek293细胞、cho细胞、293t细胞、293细胞、mdck细胞、nih3t3细胞、pa317细胞、cos细胞、hela细胞、vero细胞、psicrip细胞等。
147、在本发明的一个或多个实施方案中,所述包装细胞为pg13细胞和phoenix-eco细胞。
148、上述制备方法中,在所述步骤(1)之前还可包括外周血单个核细胞(pbmc)的分离提取步骤,以及t细胞的分离与活化步骤。
149、所述单个核细胞(pbmc)的分离可采用本领域已知的密度梯度离心法分离pbmc,该方法利用细胞比重差异,通过使用蔗糖多聚体(ficoll)试剂对细胞进行分离。
150、所述t细胞的分离与活化可通过偶联磁珠的cd3/cd28单克隆抗体实现对t细胞及其亚群的有效富集。同时,cd3是t细胞的表面标志物,cd28是t细胞激活的第二信号,cd3/cd28磁珠还可有效激活t细胞。cd3/cd28磁珠法分离和活化t细胞的技术是本领域技术已知的。
151、上述制备方法中,在所述步骤(3)之后还可包括所述car-t细胞的扩大培养和检测步骤。
152、本发明还提供了预防或治疗claudin 18.2靶点相关疾病的方法,所述方法包括向患有claudin 18.2靶点相关疾病的受试者施用本文中任一所述的修饰的免疫效应细胞或所述药物组合物。
153、上述方法中,所述修饰的免疫效应细胞可为本文中任一所述嵌合抗原受体修饰的t细胞。
154、进一步地,所述修饰的免疫效应细胞可为本发明所述car-t细胞(如claudin18.2car-ic t细胞)。
155、进一步地,所述car-t细胞可以是自体的或同种异体的。
156、进一步地,所述方法可包括如下步骤:
157、(1)从受试者(包括患者或健康志愿者)样本(如外周血)中分离提取单个核细胞(pbmc);
158、(2)从所述pbmc中分离活化t细胞;
159、(3)利用本发明任一所述的嵌合抗原受体的基因对所述t细胞进行基因修饰,得到car-t细胞;
160、(4)将所述car-t细胞进行扩大培养和质量检测,得到质量合格的car-t细胞;
161、(5)将所述质量合格的car-t细胞施用于所述患有claudin 18.2靶点相关疾病的受试者。
162、进一步地,所述样本可来源于外周血、骨髓、淋巴结组织、脐带血、胸腺组织、感染部位组织、腹水、胸腔积液、脾组织和肿瘤但不限于此。
163、上述方法中,所述claudin 18.2靶点相关疾病可为claudin18.2阳性肿瘤。
164、上述方法中,所述claudin18.2阳性肿瘤可为claudin18.2阳性实体肿瘤。
165、进一步地,所述实体肿瘤可为消化系统肿瘤(如胃癌、食管癌、胰腺癌、结直肠腺癌)。
166、上述方法中,所述claudin18.2阳性肿瘤可为claudin18.2阳性癌症或claudin18.2阳性的间皮瘤。
167、上述方法中,所述癌症选自胃癌、食管癌、胰腺癌、结直肠腺癌、肺癌、肺腺癌、肝癌、肾癌、卵巢癌、支气管癌、乳腺癌、膀胱癌、头颈癌、胆囊癌、胆管癌和胃食管交界处腺癌。
168、上述方法中,所述癌症可包括早期癌症、中期癌症、中晚期癌症、晚期癌症、复发性癌症和转移性癌症。
169、上述方法中,所述施用的量可为治疗有效量。所述治疗有效量可指(i)治疗或预防特定疾病、病况或障碍;(ii)减轻、改善或消除特定疾病、病况或障碍的一种或多种症状;或(iii)预防或延迟本文中所述的特定疾病、病况或障碍的一种或多种症状发作的所述药物的用量。治疗有效量可以通过在已知的体外或体内(例如动物模型)系统中测试而确定。
170、进一步地,本文所述治疗有效量可为每kg体重约(0.3~35)×106个、(0.3~30)×106个、(0.3~25)×106个、(0.3~20)×106个、(0.3~15)×106个、(0.3~10)×106个、(0.3~9)×106个、(0.3~8)×106个、(0.3~7)×106个、(0.3~6)×106个、(0.3~5)×106个、(0.3~4)×106个、(0.3~3)×106个、(0.3~2)×106个、(0.3~1)×106个、(1~35)×106个、(1~30)×106个、(1~25)×106个、(1~20)×106个、(1~15)×106个、(1~10)×106个、(1~9)×106个、(1~8)×106个、(1~7)×106个、(1~6)×106个、(1~5)×106个、(1~4)×106个、(1~3)×106个、(1~2)×106个、(2~35)×106个、(2~30)×106个、(2~25)×106个、(2~20)×106个、(2~15)×106个、(2~10)×106个、(2~9)×106个、(2~8)×106个、(2~7)×106个、(2~6)×106个、(2~5)×106个、(2~4)×106个、(2~3)×106个、(4~35)×106个、(4~30)×106个、(4~25)×106个、(4~20)×106个、(4~15)×106个、(4~10)×106个、(4~9)×106个、(4~8)×106个、(4~7)×106个、(4~6)×106个或(4~5)×106个免疫效应细胞(如本发明的car-t细胞),优选可为每kg体重(1~10)×106个、进一步优选每kg体重(1~9)×106个、(2~9)×106个、(1~5)×106个或(2~5)×106个免疫效应细胞(如本发明的car-t细胞)。
171、进一步地,所述施用包括但不限于肌肉注射、皮下注射、皮内注射、透皮注射、静脉注射、动脉注射、腹腔注射、腹膜内注射、鞘内注射、微针注射、瘤内注射、粘膜给药、口服、口鼻腔喷入、雾化吸入、体内植入和体外携带装置给药。
172、优选的施用方式(给药途径)是胃肠外(如静脉内、肌肉内、腹腔内、胸骨内、皮下和关节内)给药。技术人员应理解,给药途径将根据预期目的而发生变化。在某些实施方案中,本发明的修饰的免疫效应细胞(如car-t细胞)或药物组合物可通过注射或连续输注(包括但不限于静脉内、腹膜内、皮内、皮下、肌肉内、眼内和门静脉内)进行施用。
173、在一些实施方式中,本发明提供的预防或治疗方法还可与其他疗法(包括手术、化疗、放疗、免疫疗法、基因疗法、dna疗法、rna疗法、纳米疗法、病毒疗法、辅助疗法等)联合应用,例如可采用第二治疗剂进行治疗,所述第二治疗剂可以是抗肿瘤药物、抗炎药物、免疫抑制剂或其他具有治疗活性的药物,包括但不限于吉非替尼、伊马替尼、埃克替尼、索拉菲尼、英夫利昔单抗、阿达木单抗、利妥昔单抗、依沙利铂和氟尿嘧啶。
174、本发明所述修饰的免疫效应细胞(如car-t细胞)或药物组合物可与第二治疗剂分开(通过不同途径同时或基本上同时施用)、依次(在不同时间施用,施用途径可以相同也可以不同)或同时(通过相同途径同时或基本上同时施用)施用于所述受试者。
175、本发明还提供了一种抑制claudin18.2阳性肿瘤细胞生长或杀伤claudin18.2阳性肿瘤细胞的方法,所述方法包括使所述claudin18.2阳性肿瘤细胞与本文中任一所述的修饰的免疫效应细胞或所述药物组合物接触。
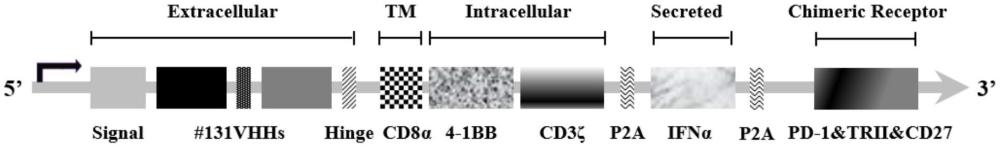
176、进一步地,所述方法可为体外方法或体内方法。
177、本发明所述用途和方法的目的可以是疾病诊断目的、疾病预后目的和/或疾病治疗目的,它们的目的也可以是非疾病诊断目的、非疾病预后目的和非疾病治疗目的;它们的直接目的可以是获取疾病诊断结果、疾病预后结果和/或疾病治疗结果的中间结果的信息,它们的直接目的可以是非疾病诊断目的、非疾病预后目的和/或非疾病治疗目的。
178、本文所述产品可包括试剂、试剂盒、制剂、药物和药物组合物等。
179、本文所述受试者可为人类或非人类动物。在某些实施方案中,所述受试者患有claudin 18.2靶点相关疾病。
180、本文所述非人类动物可为非人类哺乳动物。
181、本文所述非人类哺乳动物可为小鼠、大鼠、豚鼠、仓鼠、猪,犬,羊,猴,兔、猫、牛、马中的任意一种但不限于此。
182、本技术的发明人经过广泛而深入的研究,设计了一种靶向claudin 18.2的嵌合抗原受体(car)。该car采用了双表位的设计,并且融合了干扰素和嵌合转换开关受体(cr),其结构如图1所示。该car的抗原结合结构域由2个单域抗体通过接头连接而成的靶向claudin18.2两个不同表位的双表位单域抗体构成,主要负责识别并特异性结合肿瘤表面抗原claudin 18.2,该双表位的设计优化了car-t细胞亲和力,能够提升抗肿瘤效果。在car的n端带有一段信号肽,用于引导抗原结合结构域的肽链转移到细胞外,从而识别肿瘤细胞表面抗原claudin 18.2。铰链区(hinge)连接胞外抗原结合结构域和跨膜区,可以促进car分子在t细胞膜表面的稳定表达,为抗原结合结构域提供一定的灵活性,避免空间位阻影响。跨膜区(tm)用于将抗原结合结构域锚定在细胞膜上。胞内信号结构域从n端到c端依次包括共刺激结构域4-1bb、激活结构域cd3ζ、ifnα、嵌合转换受体pd-1&trii&cd27。cd3ζ和4-1bb分别为car-t细胞的活化提供第一信号和第二信号,使car-t细胞在被抗原刺激后能够充分活化从而杀伤肿瘤细胞。ifnα用于广谱抗瘤和重塑肿瘤免疫微环境激活免疫应答。嵌合转换受体pd-1&trii&cd27用于将肿瘤微环境中的免疫抑制信号转化为car-t细胞中的cd27激活信号,增强杀瘤效果。pd-1可以结合肿瘤细胞上的pd-l1用于阻断t细胞上的pd-1信号通路和抑制t细胞衰竭,trii胞外区可以结合tgfβ,阻断tgfβ抑制通路,进而抑制肿瘤微环境,增强免疫细胞浸润。本发明的设计的car赋予了car-t细胞更强的肿瘤杀伤能力、抵抗免疫抑制性肿瘤微环境的能力,以及更强的体内持久性。
183、本发明成功构建了靶向claudin 18.2的car-t细胞,实验证明,本发明的car-t细胞能够很好地分泌t细胞特异性效应分子ifn-γ,有效地特异性杀伤claudin 18.2阳性细胞,而对claudin 18.2阴性细胞无杀伤作用,尤其是对claudin 18.1(与claudin 18.2结构极其相似,同源性高达92%)阳性的细胞没有杀伤作用。本发明的car-t细胞在体外对肿瘤细胞具有很好的杀伤活性,能够有效地特异性杀伤claudin 18.2阳性肿瘤细胞,同时还具有良好的体内杀瘤活性,小鼠体内可以显著清除肿瘤细胞,抑制肿瘤生长,3周左右肿瘤完全消失,显示出了在对抗claudin 18.2阳性癌症方面的显著潜力,具有广阔的临床应用前景。
184、术语定义
185、在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
186、术语“表达盒”通常是指包含足以表达目的基因的核酸元件的核酸构建体。典型的表达盒包含启动子、mcs(多克隆位点,multiple cloning site)和终止子。表达盒还可以包括目的基因、标记基因(如tk基因、dhfr基因、cat基因和neo基因)核糖体识别和结合位点(sd)、转录因子结合位点(tfbs)、增强子、沉默子、阻遏子、内含子、加poly(a)信号序列和/或mrna剪接信号序列等。表达盒中各元件之间可以直接连接或通过接头间接连接。
187、术语“载体(vector)”通常是指能够把外源dna或目的基因运载进入宿主细胞进行扩增和/或表达的载体,所述载体可以是克隆载体也可以是表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得扩增和/或表达。本领域技术人员可以根据基因工程的目的和受体细胞的性质选择合适的载体。所述载体包括但不限于:质粒(plasmid)、噬菌体(phage,如λ噬菌体或m13噬菌体)、黏粒(cosmid,即柯斯质粒)、噬菌粒(phagemid)、穿梭载体(shuttle vector,如酵母表达载体)、ti质粒、人工染色体(如酵母人工染色体(yac)、细菌人工染色体(bac)、p1人工染色体(pac)或ti质粒人工染色体(tac))、病毒载体(如杆状病毒载体、逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、痘病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)、疱疹病毒(如单纯疱疹病毒))。一种载体可以含有多种控制表达的元件,包括但不限于启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。
188、术语“微生物”通常包括细菌、病毒、真菌、放线菌、立克次氏体、支原体、衣原体、螺旋体、藻等。例如所述细菌可来自埃希氏菌属(escherichia sp.)(如大肠杆菌)、欧文氏菌属(erwinia sp.)、土壤杆菌属(agrobacterium sp.)(如根癌农杆菌)、黄杆菌属(flavobacterium sp.)、产碱菌属(alcaligenes sp.)、假单胞菌属(pseudomonas sp.)和芽胞杆菌属(bacillus sp.)(如芽孢杆菌)等。所述病毒可包括轮状病毒、杆状病毒、逆转录病毒(如慢病毒)、腺病毒、腺相关病毒、痘病毒、乳头瘤病毒、流感病毒、乳头多瘤空泡病毒(如sv40)和疱疹病毒(如单纯疱疹病毒)等。所述真菌可来自酵母菌属(saccharomycessp.)(如酿酒酵母、甲醇酵母、毕赤酵母)、镰刀菌属(fusarium sp.)、丝核菌属(rhizoctonia sp.)、轮枝菌属(verticillium sp.)、青霉属(penicillium sp.)、曲霉属(aspergillus sp.)和头孢霉(cephalosporium sp.)等。所述放线菌可来自链霉菌属(streptomyces sp.)(如链霉菌)。所述藻可来自蓝藻门(cyanophyta)(如蓝藻)、墨角藻属(fucus sp.)、曲壳藻属(achnanthes sp.)、茧形藻属(amphiprora sp.)、双眉藻属(amphora sp.)、纤维藻属(ankistrodesmus sp.)、星胞藻属(asteromonas sp.)和黄金色藻属(boekeloviasp.)等。
189、术语“宿主细胞”也称为受体细胞,通常是指可用于导入载体的任何类型的细胞,例如植物细胞和动物细胞。所述宿主细胞可理解为不仅是指特定的受体细胞,而且也指这种细胞的后代,且由于天然的、偶然的或有意的突变和/或改变,该子代可以不必与原始的亲代细胞完全一致,但仍包括在宿主细胞的范围中。合适的宿主细胞为本领域已知的,其中:所述植物细胞可为拟南芥(arabidopsis thaliana)、烟草(nicotiana tabacum)、玉米(zea mays)、水稻(oryza sativa)、小麦(triticum aestivum)等植物细胞但不限于此;所述动物细胞可为哺乳动物细胞(例如中国仓鼠卵巢细胞(cho细胞)、中国仓鼠卵巢细胞亚株(cho-k1细胞)、非洲绿猴肾细胞(vero细胞)、sv40转化的非洲绿猴肾细胞(cos细胞)、幼仓鼠肾细胞(bhk细胞)、小鼠乳腺癌细胞(c127细胞)、人胚胎肾细胞(hek293细胞)、人hela细胞、成纤维细胞、骨髓细胞系、t细胞或nk细胞等)、禽类细胞(例如鸡或鸭细胞)、两栖类细胞(例如非洲爪蟾(xenopus laevis)细胞或大鲵(andrias davidianus)细胞)、鱼类细胞(例如草鱼、鲤鱼、虹鳟鱼或鲶鱼细胞)、昆虫细胞(例如sf21细胞、sf-9细胞或hi-5)等但不限于此。
190、术语“重组载体”通常是指将外源目的基因与载体在体外连接构建而成的重组体dna分子,可以任何合适的方式构建,只要构建的重组载体可携带外源目的基因进入受体细胞、并为外源目的基因提供在受体细胞的复制、整合、扩增和/或表达能力即可。
191、术语“重组微生物”通常是指对目的微生物的基因进行操作和修饰,从而得到功能发生变化的重组微生物。如将外源目的基因或重组载体导入目的微生物,或直接对目的微生物的内源基因进行基因编辑。
192、术语“重组宿主细胞”通常是指对宿主细胞的基因进行操作和修饰,从而得到功能发生变化的重组宿主细胞。如将外源目的基因或重组载体导入宿主细胞,或直接对宿主细胞的内源基因进行基因编辑。
193、术语“连接”通常是指两个或更多个分子的缔合。连接可以是共价的或非共价的。本文中所述连接可通过肽键(peptide bond)直接连接,或通过连接子(接头)连接。
194、术语“接头(linker)”也可称为连接肽、肽接头或连接子,用于融合、偶联、连接(link)或接合(join)两个蛋白质或多肽,可防止空间位阻。linker为两个融合蛋白间起连接作用的氨基酸链,具有一定的柔性以允许两侧的蛋白完成各自独立的功能。应当理解,接头的存在是任选的,柔性接头的长度也是可以调节的,以允许融合蛋白的正确折叠或实现最佳生物活性。接头的特征及其对特定目的的适用性在本领域是已知的,本领域技术人员可以独立地选择和优化每个肽接头。
195、术语“信号肽”通常是指引导新合成的蛋白质向分泌通路转移的短肽链(长度一般为5-30个氨基酸)。本发明所述嵌合抗原受体的抗原结合区前面(n端)可带有一段信号肽(signal)。car结构的信号肽可引导抗原结合区肽链转移到细胞外,从而识别肿瘤细胞表面抗原。所述信号肽可以是来源于cd4、cd8、cd8a、cd28、cd137和gm-csf的信号肽。
196、术语“同一性”通常是指两个(核苷酸或氨基酸)序列在比对中在相同位置处具有相同残基的程度,并且通常表示为百分数。本文所述同一性可指氨基酸序列或核苷酸序列的同一性。具有完全相同序列的两个拷贝具有100%同一性。本领域技术人员知晓,可使用国际互联网上的同一性检索站点测定氨基酸序列或核苷酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,perresidue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索以对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。此外可以使用序列分析软件(如clc main workbench和megaligntm)进行测定,例如使用缺省参数的计算机程序blast,尤其是blastp或tblastn。本文所述75%以上同一性可为至少75%、80%、85%、90%或95%以上的同一性。本文所述80%以上的同一性可为至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以上的同一性。
197、术语"保守置换(保守性取代)"通常是指将一个氨基酸残基用另一个具有相似理化性质的侧链的氨基酸残基替代。例如,可以在疏水侧链氨基酸残基间(例如met、ala、val、leu和ile)、中性亲水侧链残基间(例如cys、ser,thr、asn和gln)、酸性侧链残基间(例如asp、glu)、碱性侧链氨基酸间(例如his、lys和arg)或芳香侧链残基间(例如trp、tyr和phe)进行保守置换。本领域己知保守置换通常不会引起蛋白构象结构的显著变化,对蛋白质的功能通常不会产生质的影响,因此能够保留蛋白质的生物活性。
198、术语“单域抗体(sdab)”也称为纳米抗体(nanobody),通常是指只由一个h链v区组成的抗体,也可称为vhh抗体。单域抗体与抗原结合的能力极其稳定性,与完全抗体基本一致。在本文中,除非上下文明确指出,否则当提及术语“单域抗体”时,其不仅包括完整单域抗体,而且包括单域抗体的抗原结合片段。抗原结合片段是指包含单域抗体的片段的多肽,其保持特异性结合单域抗体所结合的相同抗原的能力,和/或与单域抗体竞争对抗原的特异性结合,其也被称为“抗原结合部分”。在一些实施方案中,所述单域抗体的“抗原结合片段”与全长单域抗体相比可在n端或c端处截短以使其仅包含部分fr1和/或fr4,或缺少那些骨架区中的一个或两个,只要其实质上保持抗原结合和特异性即可。
199、术语“互补决定区”或“cdr”通常是指抗体可变区中负责抗原结合的氨基酸残基。cdr可根据本领域已知的各种编号系统进行定义,例如可按照kabat编号系统、chothia编号系统或imgt编号系统中的定义。对于给定的抗体,本领域技术人员很容易地鉴别各编号系统所定义的cdr。并且,不同编号系统之间的对应关系是本领域技术人员熟知的。
200、术语“框架区(framework region,fr)”通常是指抗体可变区中除了如上定义的cdr残基以外的那些氨基酸残基。
201、术语“表位”通常是指抗原上被抗体的互补位结合的任何抗原决定簇。包括线性表位和构象表位。表位可以通过本领域熟知的任何方法确定,例如常规免疫测定法、抗体竞争性结合测定法或x射线晶体学或相关结构测定方法(例如核磁共振光谱)。
202、术语“导入”通常是指将外源基因转入受体细胞如真核受体细胞或原核受体细胞中。导入的方法没有特别限制,任何已知的转化方法只要能将目的基因(如本发明dna分子)转入受体细胞中即可。所述导入的方法可包括以下任一种:(1)通过化学转化法(如ca离子诱导的转化法、聚乙二醇介导的转化法或金属阳离子介导的转化法等)或物理转化法(如电穿孔转化法)将目的基因或含有目的基因的重组载体导入宿主菌。(2)通过噬菌体转导的方法将目的基因转导进入宿主菌。(3)通过物理或化学方法将目的基因直接转入植物受体细胞,如化学刺激法、电击法、脂质体介导法、显微注射法、基因枪法、激光微束法、花粉管通道法、超声波法、气枪法和涡流法等。(4)以载体为媒介将目的基因转入植物受体细胞,如农杆菌ti质粒载体(包括ti质粒衍生的载体如共整合载体系统和双元载体系统)介导法。(5)通过磷酸钙共沉淀法、阳离子聚合物法(如deae-葡聚糖转染法)、阳离子脂质体法、电穿孔法(即电转染法)、显微注射、基因枪法或病毒介导法(如逆转录病毒感染法、腺病毒感染法、慢病毒感染法)等将目的基因导入离体动物细胞(转染)。(6)通过显微注射法、逆转录病毒载体法、体细胞核移植法、精子载体法或胚胎干细胞法等将目的基因导入在体动物细胞。
203、术语“claudin18.2阳性肿瘤”通常是指表达claudin18.2蛋白的肿瘤。检测肿瘤claudin18.2蛋白表达的方法是本领域技术人员熟知的,例如可以通过基于抗原抗体特异性反应的免疫学检测法(如免疫组织化学法、facs等)测定claudin18.2蛋白的表达,也可以通过实时荧光定量pcr、northern blotting或rna原位杂交的方法来测定claudin18.2mrna的表达。
204、术语“预防”通常是指为了阻止或延迟疾病或病症或症状在受试者体内的发生而实施的方法。
205、术语“治疗”通常是指为了获得有益或所需临床结果而实施的方法。有益或所需的临床结果包括但不限于症状的减轻、疾病程度的减弱、疾病范围的缩小、疾病的稳定(即不再恶化)、疾病进展的延迟或减缓、疾病状态的改善或减轻以及缓解(不论是部分缓解还是完全缓解),无论是可检测还是不可检测的。此外,治疗还可以指与受试者未接受治疗时的预期生存期相比延长生存期。
206、术语“可裂解连接子(也称为可剪切连接子)”通常是指包含裂解位点,以使得当表达时可选择性地裂解以便产生两个或两个以上产物的连接子。所述可裂解连接子包括p2a、f2a、t2a和e2a,或它们的任何组合,但不限于此。
207、术语“嵌合抗原受体(chimeric antigen receptor,car)”通常是指人工构建的融合基因编码的跨膜分子,能引导免疫细胞特异性地追踪识别和清除表达相关靶配体的肿瘤细胞,具有高度靶向性。car的基本结构可以划分为四部分,由细胞外向细胞内方向,分别是胞外肿瘤抗原结合区(抗原结合结构域)、铰链区(铰链结构域)、跨膜区(跨膜结构域)和可提供t细胞活化信号的胞内信号区(胞内信号结构域)。制备嵌合抗原受体以及包含该嵌合抗原受体的免疫效应细胞(例如t细胞)的方法是本领域已知的,可包括用至少一种编码car的核酸分子(car基因)转染细胞,并在细胞中表达所述核酸分子。例如,可将编码本发明的car的核酸分子构建到表达载体(如逆转录病毒载体)中,所述表达载体能够在宿主细胞例如t细胞中表达,以制备所述car。
208、术语“嵌合转换受体(chimeric switch receptor,csr)”也称为嵌合转换开关受体,通常是指通过基因工程手段,控制被修改的t细胞在受到抑制分子的抑制信号时,转化为激活信号,使t细胞仍然能够在抑制环境中保持攻击力。csr通过识别抑制性受体的配体,从而将原有的免疫抑制性信号转变为免疫活化性信号,激活免疫细胞,提升car-t细胞的抗肿瘤活性。
209、术语“car细胞”在本文中也称为修饰的免疫效应细胞,通常是指通过分子生物学和基因工程技术,将嵌合抗原受体(car)的基因(car基因)导入免疫效应细胞,将car表达在免疫效应细胞表面,从而获得特异性识别并杀伤靶细胞的一类基因修饰的免疫效应细胞。相对于car-t细胞而言,car细胞不局限于特定的受体细胞类型,car细胞可以包括car-t细胞、car-nk细胞、car-nkt细胞、car-γδt细胞、car-αβt细胞、car-调节性t细胞(car-treg细胞)、car-mait细胞、car-b细胞、car-巨噬细胞(car-m细胞)、car-树突状细胞(car-dc细胞)、car-外周血单核细胞(car-pbmc细胞)、car-单核细胞(car-mc细胞)、car-ipsc细胞和car-psc细胞等但不限于此。
210、术语“car-t细胞(嵌合抗原受体t细胞)”通常是指表达嵌合抗原受体(car)的t细胞,其可以特异性地识别和杀伤表达被嵌合抗原受体识别的靶抗原的细胞。car-t细胞可通过各种载体在体外将car基因转入t细胞中来制备。car-t细胞通过car分子特异性识别肿瘤抗原后即发生活化,通过释放穿孔素、颗粒酶b、细胞因子ifn-γ等实现对肿瘤细胞的特异性杀伤作用。car-t细胞的定义涵盖t淋巴细胞的所有类别和亚类,包括cd8+t细胞、cd4+t细胞、调节性t细胞(treg)、初始t细胞、效应t细胞、记忆t细胞(包括干性记忆t细胞、中央记忆t细胞和效应记忆t细胞)、αβt细胞、γδt细胞、自然杀伤性t细胞(natural killer t cell,nkt细胞)和黏膜相关恒定t细胞(mucosal-associated invariant t cells,mait细胞)等。
211、术语“抗原结合区”也称为抗原结合结构域,通常是指嵌合抗原受体中与靶抗原特异性结合的部分,负责肿瘤抗原的识别,可以包含抗体轻链可变区(vl)、抗体重链可变区(vh)、抗体fab片段、抗体fab’片段、单链抗体可变区(scfv)、单域抗体(sdab)等。抗原结合区前面(n端)可带有一段信号肽。
212、术语“铰链区(hinge)”也称铰链结构域,通常是指用于连接胞外抗原结合区和跨膜区的任何寡肽或多肽,是car位于细胞外的一段肽链。选择合适的铰链区可以提高抗原识别区的柔韧性,降低抗原和car之间的空间约束,从而促进car-t细胞与靶细胞的突触形成。所述铰链区位于跨膜区的n端和抗原结合区的c端,可来源于cd8a(cd8α)、cd4、cd5、cd7、cd28、cd134、cd137、icos、igg1、igg2、igg3、igg4、iga、igd、ige或igm的铰链区。
213、术语“跨膜区(transmembrane domain,td)”也称跨膜结构域,用于连接嵌合抗原受体的抗原结合区和胞内信号区,主要负责维持car分子在t细胞膜上的稳定性。其可以是天然的或合成的,也可以源自任何膜结合蛋白或跨膜蛋白,通常由同源或异源二聚体膜蛋白组成。本发明嵌合抗原受体的跨膜区可以是本领域已知的任何蛋白结构,只要其能够在细胞膜(特别是真核细胞膜)中热力学稳定。所述跨膜区可来源于t细胞受体的α、β或ζ链、cd3ζ、cd8a(cd8α)、cd4、cd9、cd45、cd16、cd19、cd22、cd28、cd28t、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd152或cd154的跨膜结构域。
214、术语“胞内信号区(也称为胞内信号结构域)”通常是指嵌合抗原受体中将抗原刺激转化为t细胞活化信号的部分。胞内信号区可包含激活结构域和/或共刺激结构域。所述激活结构域可来源于cd3ζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b或cd66d的胞内信号传导结构域。所述共刺激结构域可以是来自共刺激分子的胞内信号传导结构域,例如所述共刺激结构域可来源于card11、cd2、cd7、cd27、cd28、cd30、icam-1(cd54)、lfa-1(cd11a)、cd134(ox40)、cd137(4-1bb)、2b4、cd150(slamf1)、cd270(hvem)、cd278(icos)或dap10的胞内信号传导结构域。所述细胞内信号区可包含一个、两个或更多个共刺激结构域。所述共刺激结构域可包含所述共刺激分子的整个细胞内部分,或其功能片段。“共刺激分子”是指在t细胞上与共刺激配体特异性结合,由此介导t细胞的共刺激反应(例如增殖)的同源结合配偶体。
215、术语“免疫效应细胞”通常是指参与免疫应答、执行免疫效应功能(例如细胞毒性细胞杀伤活性、分泌细胞因子、诱导adcc和/或cdc)的免疫细胞。所述免疫效应细胞包括t细胞(如cd8+t细胞、cd4+t细胞、调节性t细胞(treg)、初始t细胞、效应t细胞、记忆t细胞(包括干性记忆t细胞、中央记忆t细胞和效应记忆t细胞)、αβt细胞、γδt细胞、自然杀伤性t细胞(natural killer t cell,nkt细胞)和黏膜相关恒定t细胞(mucosal-associatedinvariant t cells,mait细胞)等)、nk细胞、b细胞、巨噬细胞、树突状细胞(dc)、外周血单核细胞(pbmc)和单核细胞(mc)。本文所述免疫效应细胞还可包括能够在体内或体外被诱导分化为免疫效应细胞的干细胞,例如成体干细胞、胚胎干细胞、脐带血干细胞、祖细胞、骨髓干细胞、诱导多能干细胞(ipsc)、全能干细胞或造血干细胞(hsc)。本文所述免疫效应细胞可以从干细胞分化而得,例如从成体干细胞、胚胎干细胞、脐带血干细胞、祖细胞、骨髓干细胞、诱导多能干细胞(ipsc)、全能干细胞或造血干细胞(hsc)分化而成的免疫效应细胞。所述免疫效应细胞可以是自体的,也可以是非自体的(同种异体的、同基因的或异种的),优选是自体的或同种异体的。在本发明的一个实施方案中,所述免疫效应细胞是t细胞。t细胞存在于多种来源中,包括但不限于外周血、单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、感染部位组织、腹水、胸腔积液、脾组织和肿瘤。可以使用本领域技术人员已知的多种技术(例如密度梯度分离技术、黏附分离法、磁珠分离技术、流式细胞分选技术等)分离获得t细胞。
216、术语“自体的”通常是指来自同一受试者的细胞。
217、术语“同种异体的”通常是指与比较中的细胞在遗传上不同的相同物种的细胞。
218、术语“同基因的”通常是指与比较中的细胞在遗传上相同的不同受试者的细胞。
219、术语“异种的”通常是指与比较中的细胞不同物种的细胞。
- 还没有人留言评论。精彩留言会获得点赞!