糖基化外泌体与蛋白标志物联合在制备诊断或预后评估肿瘤的产品中的应用
本发明涉及生物医药,具体涉及糖基化外泌体与蛋白标志物联合在制备诊断或预后评估肿瘤的产品中的应用。
背景技术:
1、目前,临床的肿瘤检测技术主要依赖组织活检,然而组织活检具有创伤性,难以动态检测,甚至有引起肿瘤播散的风险,液体活检(liquid biopsy)是一种新兴的无创检测方法,近年来在癌症的早期诊断、治疗检测和预后评估中受到了广泛关注和研究。其中,外泌体(exosome)是由所有类型细胞主动分泌,能够在血液中稳定大量存在的脂质双分子层纳米颗粒,参与细胞通讯、细胞迁移、肿瘤细胞增长等多种过程,完成细胞间物质及信息的传递。外泌体与肿瘤、慢性感染性疾病、自身免疫病等多种疾病相关,当机体发生病变时,细胞分泌的外泌体的成分、含量、性质等都可能发生改变。
2、糖基化是蛋白质的重要翻译后修饰之一,是通过糖基转移酶在内质网和高尔基体上发生的过程,它能将糖苷连接到其他糖分子、蛋白质或脂质上。肿瘤细胞相较于非肿瘤细胞表现出更为异常的糖基化变化。这些特定蛋白质和脂质的糖基化水平增加,增强了肿瘤在分子水平上的异质性,同时促进了其发展。糖基化外泌体在肿瘤的诊断或预后评估中的研究重点主要是糖链结构的变化,cn105628934a中针对血清样本,采用特定的凝集素组合制备诊断肺癌类型的测试载体,以不同糖蛋白的糖链结构作为肺癌亚型的诊断标准,有效鉴别出肺癌的类型及分期。zhang等(zhang j,qin y,jiang q,et al.glycopatternalteration of glycoproteins in gastrointestinal cancer cell lines and theircell-derived exosomes[j].j proteome res,2022,21(8):1876-1893.)根据橙黄网胞盘菌凝集素可特异性识别核心岩藻糖和分支岩藻糖结构,发现与对照相比,肝癌和结直肠癌的细胞和外泌体中岩藻糖α1-6n-乙酰葡萄氨糖水平降低,胃癌细胞和外泌体中岩藻糖α1-6n-乙酰葡萄氨糖水平升高。
3、糖链结构直接参与了多种疾病的病理生理过程,但在不同肿瘤中糖链结构发生的改变不同,这显然难以将单一糖链结构的变化拓展至其他的肿瘤中。
4、因此,本技术利用特定凝集素分离糖基化外泌体,检测蛋白标志物实现精准化肿瘤诊断,对于临床研究具有重要意义。
技术实现思路
1、针对现有技术的不足,本发明利用特定凝集素分离特定糖基化外泌体,然后检测其蛋白标志物的表达水平实现肿瘤的早期诊断,解决了现有技术中每种抗原都需要生产对应抗体的复杂性,更提高了诊断效果。最令人意外的是,通过采用不同的算法分析特定凝集素分离的外泌体上蛋白标志物的表达可以显著提到诊断效果,auc甚至可以接近1。
2、本发明的第一方面,提供了一种糖基化外泌体与蛋白标志物联合在制备诊断或预后评估肿瘤的产品中的应用。
3、所述糖基化的类型包括n-糖基化、o-糖基化、c-糖基化或糖基磷脂酰肌醇锚定中的一种或两种以上。
4、所述糖基化的结构包括fuc、sia、man、glcnac、galnac或gal中的一种或两种以上;
5、优选的,所述糖基化的结构为sia、man或galnac中的一种或两种以上。
6、在本发明的一个具体实施方式中,所述的糖基化为n-糖基化的sia、o-糖基化的glcnac、n-糖基化的galnac和n-糖基化的man。
7、所述的蛋白标志物为现有技术中肿瘤的蛋白标志物,例如在肿瘤患者和非肿瘤患者的肿瘤细胞、外泌体、血液或血浆中表达水平具有显著差异的蛋白,又例如在肿瘤患者的肿瘤细胞、外泌体、血液或血浆中特异性表达,在非肿瘤患者不表达的蛋白。例如包括但不限于epcam、cea、ca19-9、ca12、dsg3、galnac-t3、fat2、icam-1、cd44、pd-1、pd-l1、il-3、ido1、gbp1、irf1、ifit1、ifit2或gzmb中的一种或两种以上,优选的,所述的蛋白标志物为epcam。
8、所述的糖基化外泌体与蛋白标志物联合包括获取糖基化外泌体,然后检测蛋白标志物。
9、所述的诊断或预后评估肿瘤包括分离样本中糖基化外泌体,并检测糖基化外泌体的蛋白标志物。
10、所述的样本包括血清、血浆、唾液、胃液、细胞培养上清、脑脊液或淋巴液中的一种或两种以上。
11、优选的,所述的细胞包括肿瘤细胞和/或上皮细胞。优选为上皮来源的肿瘤细胞。
12、在本发明的一个具体实施方式中,所述的样本为血浆。
13、所述的分离样本中糖基化外泌体包括使用凝集素分离糖基化外泌体。
14、所述的凝集素包括cpogad298n、dba或npa中的一种或两种以上;优选的,所述的凝集素为cpogad298n、dba和npa。
15、所述的cpogad298n特异性识别的糖基化为n-糖基化的sia和/或o-糖基化的glcnac。
16、所述的dba特异性识别的糖基化为n-糖基化的galnac。
17、所述的npa特异性识别的糖基化为n-糖基化的man。
18、所述的使用凝集素分离糖基化外泌体包括制备凝集素-固相载体偶联复合物。
19、所述的制备凝集素-固相载体偶联复合物包括:
20、步骤一:将edc、nhs与固相载体混合均匀,离心后去上清;
21、步骤二:将凝集素经超声溶解后,加入步骤一的混合物中,离心后去上清,获得凝集素-固相载体偶联复合物。
22、其中,凝集素与固相载体以(0.5-3):(5-20)的质量比混合,优选的,所述的凝集素与固相载体以1:10的质量比混合。
23、所述的固相载体包括酶标板、膜载体、微球或磁珠。
24、所述的步骤一中离心的离心力为2000-4000rpm,优选的,所述的离心力为2500-3500rpm,例如2000rpm、2200rpm、2400rpm、2600rpm、2800rpm、3000rpm、3200rpm、3400、3600、3800、4000rpm。
25、所述的步骤一中离心的时间为1-10min,优选的,所述的离心时间为2-8min,例如1min、2min、3min、4min、5min、6min、7min、8min、9min、10min。
26、所述步骤二中超声的时间为0.1-5min,优选的,所述的超声的时间为0.5-5min,例如0.1min、0.5min、1min、2min、3min、4min、5min。
27、步骤二中将凝集素经超声溶解后,加入步骤一的混合物中后,在摇床上震荡摇匀0.5-3h,优选的,所述的震荡摇匀的时间为0.5-2h,例如0.5h、1h、1.5h、2h、2.5h、3h。
28、步骤二中离心的离心力为2000-4000,所述的离心力为2500-3500rpm,例如2000rpm、2200rpm、2400rpm、2600rpm、2800rpm、3000rpm、3200rpm、3400、3600、3800、4000rpm。
29、所述的步骤二中离心的时间为1-10min,优选的,所述的离心时间为2-8min,例如1min、2min、3min、4min、5min、6min、7min、8min、9min、10min。
30、优选的,分离样本中糖基化外泌体包括将偶联凝集素的固相载体与样本混合反应,然后离心。
31、所述偶联凝集素的固相载体与样本以质量体积比为0.01-1mg:10-100μl(优选0.05-0.2mg:30-80μl)混合。
32、所述反应的时间为0.5-2h,例如0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2h。
33、分离外泌体中离心的温度优选为20-30℃,优选22-27℃,例如20、21、22、23、24、25、26、27、28、29或30℃。
34、分离外泌体中离心的离心力为3000-8000rpm,优选4000-6000rpm,例如3000rpm、3200rpm、3400rpm、3600rpm、3800rpm、4000rpm、4200rpm、4400、4600、4800、5000rpm、5200rpm、5400rpm、5600rpm、5800rpm、6000rpm、6200rpm、6400、6600、6800rpm、7000rpm、7200rpm、7400rpm、7600rpm、7800rpm、8000rpm等。
35、分离外泌体的单次离心时间为3-10min,优选4-7min,例如3、4、5、6、7、8、9或10min。
36、分离外泌体的离心次数为1-10次,例如1、2、3、4、5、6、7、8、9或10。
37、所述的诊断或预后评估肿瘤包括利用肿瘤的诊断模型,所述的诊断模型利用k最邻近算法、逻辑回归、支持向量机、极端梯度提升算法或最小绝对收缩和选择算法中的任一种算法依据蛋白标志物表达数据构建。优选的,所述的机器学习为极端梯度提升算法。
38、所述的算法的特征为凝集素分离的外泌体上蛋白标志物的表达水平。
39、所述的肿瘤包括胃癌、肝癌、肺癌、胶质母细胞瘤、膀胱癌、乳腺癌、结直肠癌、胰腺癌、食管癌、结肠癌、卵巢癌或肉瘤。
40、所述的产品包括但不限于试剂、试纸、试剂盒或生物芯片。
41、本发明的第二方面,提供了一种肿瘤的诊断模型,所述的诊断模型包括:
42、s1:数据接收单元,所述的数据包括糖基化外泌体的蛋白标志物的表达水平。
43、优选的,所述的糖基化外泌体为使用cpogad298n、dba和npa从样本中分离获得;
44、优选的,所述的蛋白标志物为epcam。
45、s2:数据分析单元,所述的数据分析单元包括利用k最邻近算法、逻辑回归、支持向量机、极端梯度提升算法或最小绝对收缩和选择算法中的任一种算法对数据分析。
46、优选利用极端梯度提升算法对数据分析。
47、所述的数据分析单元包括模型构建模块和存储模块。
48、所述的模型构建模块包括将数据接收单元接收的数据分为训练集和测试集。
49、所述的模型构建模块包括利用k最邻近算法、逻辑回归、支持向量机、极端梯度提升算法或最小绝对收缩和选择算法中的任一种算法依据训练集数据构建诊断模型。
50、利用构建的诊断模型对测试集数据进行鉴别,确定是否为肿瘤患者。
51、所述的存储模块用于存储构建的诊断模型。
52、本发明的第三方面,提供了一种第二方面所述的诊断模型在制备诊断或预后评估肿瘤的产品中的应用。
53、所述的肿瘤包括胃癌、肝癌、肺癌、胶质母细胞瘤、膀胱癌、乳腺癌、结直肠癌、胰腺癌、食管癌、结肠癌、卵巢癌或肉瘤。
54、所述的产品包括试剂、试纸、试剂盒或生物芯片。
55、本发明的第四方面,提供了一种诊断试剂盒,所述的诊断试剂盒包括凝集素-固相载体偶联复合物以及检测蛋白标志物表达水平的试剂。
56、所述的凝集素包括cpogad298n、dba或npa中的一种或两种以上。
57、所述的固相载体包括酶标板、膜载体、微球或磁珠。
58、所述的凝集素-固相载体偶联复合物通过凝集素与固相载体以(0.5-3):(5-20)的质量比混合,优选的,所述的凝集素与固相载体以1:10的质量比混合。
59、本发明的第五方面,提供了一种凝集素与蛋白标志物联合在制备诊断或预后评估肿瘤的产品中的应用。
60、所述的凝集素包括cpogad298n、dba或npa中的一种或两种以上;优选的,所述的凝集素为cpogad298n、dba和npa。
61、所述的蛋白标志物为外泌体上的蛋白标志物。
62、所述的凝集素与蛋白标志物联合包括用凝集素提取样本中的糖基化外泌体,然后检测糖基化外泌体上蛋白标志物的表达水平。
63、优选还包括采用算法对蛋白质的表达水平进行分析。
64、所述的算法包括但不限于k最邻近算法、逻辑回归、支持向量机、极端梯度提升算法或最小绝对收缩和选择算法中的任一种。
65、本发明的第六方面,提供了一种肿瘤的诊断或预后评估的方法,所述的方法包括检测糖基化外泌体上蛋白标志物的表达水平。
66、所述的方法还包括通过算法对蛋白质的表达水平进行分析。
67、所述的算法包括但不限于k最邻近算法、逻辑回归、支持向量机、极端梯度提升算法或最小绝对收缩和选择算法中的任一种。
68、优选的,所述的方法包括使用凝集素分离糖基化外泌体(优选分离血清、血浆、唾液、胃液、肿瘤细胞培养上清、脑脊液或淋巴液中的外泌体),并检测糖基化外泌体的蛋白标志物。
69、优选的,所述的方法包括使用第二方面的诊断模型进行肿瘤的诊断或预后评估。
70、所述的糖基化的类型包括n-糖基化、o-糖基化、c-糖基化或糖基磷脂酰肌醇锚定中的一种或两种以上。
71、所述糖基化的结构包括fuc、sia、man、glcnac、galnac或gal中的一种或两种以上;
72、所述的蛋白标志物为现有技术中肿瘤的蛋白标志物,例如在肿瘤患者和非肿瘤患者的肿瘤细胞、外泌体、血液或血浆中表达水平具有显著差异的蛋白,又例如在肿瘤患者的肿瘤细胞、外泌体、血液或血浆中特异性表达,在非肿瘤患者不表达的蛋白。例如包括但不限于epcam、cea、ca19-9、ca12、dsg3、galnac-t3、fat2、icam-1、cd44、pd-1、pd-l1、il-3、ido1、gbp1、irf1、ifit1、ifit2或gzmb中的一种或两种以上,优选的,所述的蛋白标志物为epcam。
73、所述的凝集素包括cpogad298n、dba或npa中的一种或两种以上;优选的,所述的凝集素为cpogad298n、dba和npa。
74、本发明所述的“诊断”是指以查明患者过去、诊断时或将来是否患有疾病或病症,或者是查明疾病的进展或将来可能的进展。所述的患者可以为人或非人动物,所述的非人动物可以为野生动物、动物园动物、经济动物、宠物、实验动物等等。优选的,所述的非人哺乳动物包括但不限于猪、牛、羊、马、驴、狐、貉、貂、骆驼、狗、猫、兔、鼠(例如大鼠、小鼠、豚鼠、仓鼠、沙鼠、龙猫、松鼠)或猴等等。
75、本发明所述的“预后评估”指评估患者对治疗的反应,及将来患病的风险度。
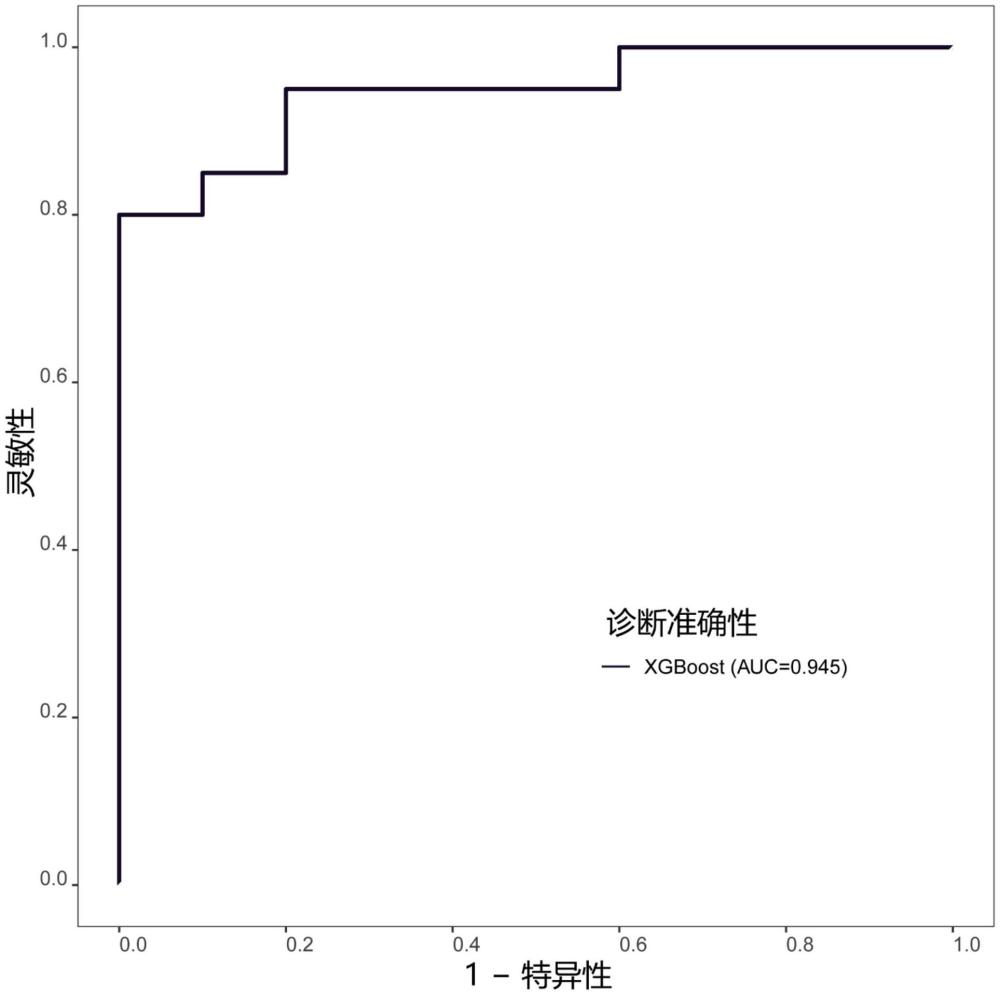
76、本发明所述的“肿瘤”可以是任何不良的细胞增殖(或本身表现为不良细胞增殖的任何疾病)、赘生物,或不良细胞增殖、赘生物或肿瘤的倾向性或风险增加。其可以是良性或恶性的,也可以是原发性或继发性(转移性)。赘生物可以是细胞的任何异常生长或增殖,并且可以位于任何组织中。组织的实例包括肾上腺、肾上腺髓质、肛门、阑尾、膀胱、血液、骨、骨髓、脑、乳腺、盲肠、中枢神经系统(包括或排除大脑)、小脑、子宫颈、结肠、十二指肠、子宫内膜、上皮细胞(例如肾上皮细胞)、胆囊、食道、神经胶质细胞、心脏、回肠、空肠、肾、泪腺、喉、肝、肺、淋巴、淋巴结、淋巴母细胞、上颌骨、纵隔、肠系膜、子宫肌层、鼻咽、网膜、口腔、卵巢、胰腺、腮腺、周围神经系统、腹膜、胸膜、前列腺、唾液腺、乙状结肠、皮肤、小肠、软组织、脾、胃、睾丸、胸腺、甲状腺、舌、扁桃体、气管、子宫、外阴、白细胞。进一步优选的,所述的肿瘤选自前列腺癌、乳腺癌、肝癌、胶质瘤(例如神经胶质瘤)、肠癌、宫颈癌、非小细胞肺癌、肺癌、胰腺癌、胃癌、膀胱癌、皮肤癌、横纹肌癌、舌鳞癌、鼻咽癌、卵巢癌、胎盘绒毛癌、淋巴瘤(例如非霍奇金淋巴瘤、霍奇金淋巴瘤、皮肤t细胞淋巴瘤)、白血病、直肠腺癌、成神经管细胞瘤、脑膜瘤、神经纤维瘤(例如神经纤维肉瘤)、室管膜瘤、神经鞘瘤、星形细胞瘤、黑色素瘤、间皮瘤、骨髓瘤、慢性粒细胞白血病、急性髓性白血病、骨髓增生异常综合征、慢性淋巴细胞白血病、表皮样癌、结肠癌、胸腺癌、血液癌、头颈癌或口咽癌。
77、本技术简写与全称对照见表1。
78、表1
79、
80、本发明的有益效果:本发明的有益效果:
81、(1)本发明基于凝集素能够识别并结合特定的糖基化结构,血浆中外泌体表面的凝集素亲和糖基化模式显示出高度的异质性,能够广泛捕获不同类型但具有相同糖基化修饰的外泌体,无需像抗体那样开发针对每种外泌体的特定抗体。相较于目前最佳的抗原-抗体捕获方法,凝集素亲和糖基化具备广泛的捕获能力,能有效节约成本和时间,并且不受抗原表位暴露程度的限制。
82、(2)cpogad298n、dba和npa三种凝集素联合分离糖基化外泌体检测糖基化外泌体表面蛋白标志物表达水平进行诊断的效果可以大幅提高单独一种凝集素分离糖基化外泌体检测糖基化外泌体表面蛋白标志物表达水平的诊断效果。
83、(3)优化不同算法对特定糖基化外泌体的蛋白标志物水平数据分析,筛选出对联合三种凝集素分离的糖基化外泌体的蛋白标志物表达水平利用极端梯度提升算法(xgboost)构建的模型诊断效能最佳,auc为0.945。
- 还没有人留言评论。精彩留言会获得点赞!