一种基于诱导多能干细胞技术的胶原蛋白生物合成方法与流程
本发明属于胶原蛋白生物合成,具体涉及一种基于诱导多能干细胞技术的胶原蛋白生物合成方法。
背景技术:
1、胶原蛋白是一种重要的结构蛋白质,广泛存在于人体的结缔组织中,包括皮肤、骨骼、肌腱和韧带,约占人体总蛋白质的30%,它的作用包括维持皮肤弹性和光滑度、促进伤口愈合、支持骨骼健康、增强关节健康和提高肌肉质量,来源包括动物性食品如肉类、鱼类和家禽,尤其是富含结缔组织的部位,骨汤和肉汤以及鸡蛋的蛋壳膜,也可以通过市场上的胶原蛋白补充剂来补充,随着年龄的增长,人体内的胶原蛋白合成速度减慢,导致皮肤松弛、皱纹增多和关节疼痛等问题,因此适当补充胶原蛋白,保持健康的生活方式和饮食习惯能够帮助延缓这些衰老迹象。
2、现有的胶原蛋白生物合成方法合成的胶原蛋白在使用时易出现免疫排斥反应,采用胚胎干细胞合成胶原蛋白涉及胚胎的使用,存在伦理争议,成纤维细胞的胶原蛋白合成效率较低,为此我们提出一种基于诱导多能干细胞技术的胶原蛋白生物合成方法来解决上述问题。
技术实现思路
1、本发明的目的是提供一种基于诱导多能干细胞技术的胶原蛋白生物合成方法,能够利用供体细胞合成胶原蛋白,避免免疫排斥,实现个性化医疗,减少伦理争议,优化培养和基因调控提高合成效率和质量,严格质量控制确保遗传稳定性和多能性,能测试评估生物活性和机械性能,多种提取纯化技术确保高纯度,质量检测确保符合天然标准。
2、本发明采取的技术方案具体如下:
3、一种基于诱导多能干细胞技术的胶原蛋白生物合成方法,所述包括胶原蛋白生物合成方法具体包括以下步骤:
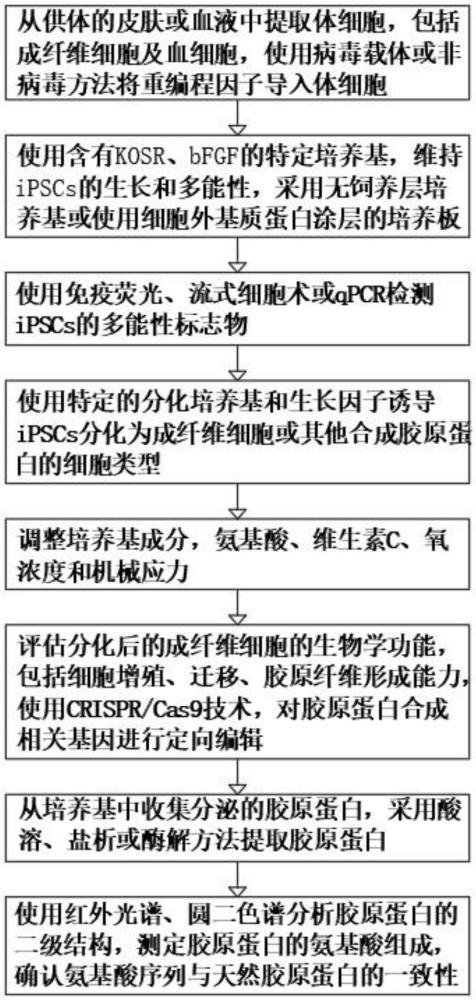
4、步骤1.细胞重编程:从供体的皮肤或血液中提取体细胞,包括成纤维细胞及血细胞,使用病毒载体或非病毒方法将重编程因子导入体细胞,所述病毒载体为逆转录病毒或腺相关病毒,所述重编程因子包括oct4、sox2、klf4、c-myc,在适当的培养基和条件下,体细胞重编程为ipscs,ipscs形成特征性的细胞集落;
5、步骤2.ipscs培养与扩增:使用含有kosr、bfgf的特定培养基,维持ipscs的生长和多能性,采用无饲养层培养基或使用细胞外基质蛋白涂层的培养板,定期传代培养ipscs;
6、步骤3.细胞鉴定与质量控制:使用免疫荧光、流式细胞术或qpcr检测ipscs的多能性标志物,通过核型分析和全基因组测序,确认ipscs的遗传稳定性,通过体外分化实验或体内成瘤实验,评估ipscs的多能性;
7、步骤4.定向分化:使用特定的分化培养基和生长因子诱导ipscs分化为成纤维细胞或其他合成胶原蛋白的细胞类型,通过调整培养基成分、细胞密度、培养温度和氧浓度,优化分化条件,使用免疫荧光和qpcr检测成纤维细胞的分化标志物;
8、步骤5.胶原蛋白合成与分泌:调整培养基成分,氨基酸、维生素c、氧浓度和机械应力,通过基因编辑技术或小分子化合物,调控胶原蛋白合成相关基因的表达,定期采集培养基样本,使用elisa或westernblot检测胶原蛋白的分泌情况;
9、步骤6.功能测试与优化:评估分化后的成纤维细胞的生物学功能,包括细胞增殖、迁移、胶原纤维形成能力,使用crispr/cas9技术,对胶原蛋白合成相关基因进行定向编辑,通过拉伸试验、剪切试验,评估合成的胶原蛋白纤维的力学性能;
10、步骤7.胶原蛋白的提取和纯化:从培养基中收集分泌的胶原蛋白,采用酸溶、盐析或酶解方法提取胶原蛋白,使用离心、透析、凝胶过滤层析、离子交换层析技术纯化胶原蛋白,去除杂质,通过sds-page、电泳、质谱检测纯化胶原蛋白的纯度和分子量;
11、步骤8.质量检测:使用红外光谱、圆二色谱分析胶原蛋白的二级结构,测定胶原蛋白的氨基酸组成,确认其氨基酸序列与天然胶原蛋白的一致性,通过细胞培养实验,评估胶原蛋白对细胞粘附、增殖和分化的影响。
12、在一种优选方案中,所述细胞重编程还包括使用胰蛋白酶或胶原酶消化皮肤样本以分离成纤维细胞,或使用密度梯度离心法从血液样本中分离单核细胞,将分离出的细胞接种在培养皿中,使用含有生长因子的培养基培养,待细胞增殖至适合的密度后进行重编程,重编程因子包括oct4、sox2、klf4和c-myc,将重编程因子载体与体细胞共孵育,方法包括病毒感染、质粒电转或脂质体转染,将导入重编程因子的体细胞接种于含有饲养层的培养皿中,使用kosr培养基进行初期培养。
13、在一种优选方案中,所述ipscs培养与扩增还包括采用无饲养层培养基,在培养板上涂覆细胞外基质蛋白,提供适合ipscs附着和生长的表面,使用前将基质蛋白稀释并均匀涂覆在培养板表面,室温孵育30分钟,将ipscs悬浮液接种到预处理好的无饲养层培养板上,使用无饲养层培养基进行培养,使用dispase酶、accutase酶轻轻消化细胞集落,使其分散成单细胞悬液或小集落,通过离心和重新悬浮,将消化后的细胞转移到新鲜的培养基中,按照适当的稀释比例,将细胞悬液接种到新的无饲养层培养板上,定期更换培养基,移除废物和代谢产物,补充新鲜营养物质,控制培养环境的温度、湿度和co2浓度,确保其稳定在37℃、95%相对湿度和5%co2,每天观察细胞生长情况,记录细胞形态和密度,避免细胞过度融合或分化,定期检测ipscs的多能性标志物,oct4、sox2、nanog表达水平,定期进行核型分析和全基因组测序,定期检测培养基中的微生物污染。
14、在一种优选方案中,所述细胞鉴定与质量控制还包括从培养皿中收集ipscs,进行细胞固定和透化处理,使用4%多聚甲醛溶液固定细胞10-15分钟,然后用pbs清洗,使用0.1%triton x-100在室温下处理5-10分钟,使细胞膜通透,用5%bsa或10%正常山羊血清在室温下封闭1小时,将抗多能性标志物的主要抗体按照推荐浓度稀释,加入到封闭好的样本中,在4℃下孵育过夜,用pbs清洗后,加入带有荧光标签的二抗,在室温下孵育1小时,避光处理,用荧光显微镜观察染色结果,确认多能性标志物的表达,将ipscs消化成单细胞悬液,调整细胞浓度,将细胞与荧光标记的一抗混合,在4℃下孵育30分钟,用pbs洗涤细胞,去除未结合的抗体,使用流式细胞仪检测多能性标志物的荧光强度,分析细胞的多能性。
15、在一种优选方案中,所述定向分化还包括根据实验需求确定ipscs的目标分化方向,选择适合目标细胞类型的基础培养基,根据目标细胞类型添加特定的生长因子和小分子,系统地调整培养基中各成分的浓度和组合,对各生长因子和小分子的浓度进行梯度试验,不同生长因子和小分子的组合实验,寻找协同作用,在分化过程中,根据细胞生长情况适时传代,在分化过程中定期收集细胞样本,用于标志物检测,使用4%多聚甲醛固定细胞,0.1%triton x-100透化,使用特异性的成纤维细胞标志物抗体进行一抗和二抗孵育,观察成纤维细胞标志物的表达,评估分化效果,计算分化效率,评估在特定条件下成功分化的细胞比例,通过胶原蛋白合成检测、迁移和增殖实验评估分化细胞的功能特性,对分化细胞进行长期培养,观察其稳定性和功能保持情况。
16、在一种优选方案中,所述胶原蛋白合成与分泌还包括通过调整培养箱的氧浓度来模拟低氧条件,促进胶原蛋白合成,模拟细胞在体内所受的机械应力,通过使用生物反应器或专门设计的培养基架施加机械应力,促进成纤维细胞的胶原蛋白合成和分泌。
17、在一种优选方案中,所述功能测试与优化还包括使用crispr/cas9技术精确调控胶原蛋白合成相关基因的表达,设计针对目标基因的单导rna,并构建crispr/cas9载体,将crispr/cas9载体转染到成纤维细胞中,通过核酸电转或脂质体转染法提高转染效率,筛选编辑成功的细胞株,使用qpcr和western blot验证目标基因的表达情况,筛选能够调控胶原蛋白合成相关基因表达的小分子化合物,通过添加这些小分子化合物来提高胶原蛋白的合成和分泌,在细胞培养过程中定期收集培养基样本,用于胶原蛋白分泌检测,将收集到的培养基样本离心去除细胞和杂质,使用特异性胶原蛋白的elisa试剂盒,通过标准曲线定量分析培养基中的胶原蛋白浓度,将培养基样本进行蛋白质浓缩处理,进行sds-page电泳,将蛋白质转移到pvdf膜上,使用针对胶原蛋白的特异性一抗和hrp标记的二抗进行孵育,使用化学发光底物进行显色,观察并记录胶原蛋白的表达情况,对检测结果进行统计分析,计算胶原蛋白的合成和分泌量。
18、在一种优选方案中,所述胶原蛋白的提取和纯化还包括将从培养基中收集到的细胞和培养基样本离心,去除细胞残渣,将上清液加入稀盐酸,在4℃下搅拌过夜,使胶原蛋白溶解,使用氢氧化钠中和酸性溶液,然后进行冷冻干燥或透析浓缩胶原蛋白溶液,将提取的胶原蛋白溶液进行超速离心,去除细小杂质,使用分子量截断膜进行透析,去除小分子杂质和盐分,选择适当的离子交换层析柱,将胶原蛋白溶液加载到平衡好的离子交换层析柱上,使用梯度盐溶液洗脱,收集洗脱液中的胶原蛋白组分。
19、在一种优选方案中,所述质量检测还包括取适量纯化后的胶原蛋白,干燥成薄膜或与kbr混合制成压片,使用傅里叶变换红外光谱仪进行扫描,获得红外光谱图,分析特征吸收峰,确认胶原蛋白的二级结构,将胶原蛋白样本用6m hcl在110℃下水解24小时,生成单个氨基酸,将水解产物干燥,重溶于适当的稀释液中,将水解后的样本加载到氨基酸分析柱上,使用hplc分离和检测各个氨基酸,通过标准品对比,确定样本中各个氨基酸的含量,确认其氨基酸序列与天然胶原蛋白的一致性,将纤维细胞、骨髓间充质干细胞接种在涂有胶原蛋白的培养板上,通过显微镜观察和计数粘附细胞数量,评估胶原蛋白的细胞粘附能力,通过细胞粘附、增殖和分化实验,确认胶原蛋白的生物活性,确保其在实际应用中的有效性。
20、在一种优选方案中,所述细胞鉴定与质量控制还包括从ipscs中提取总rna,使用trizol试剂或rna提取试剂盒,用逆转录酶将提取的rna逆转录为cdna,计特异性的引物,使用sybr green或taqman探针进行qpcr检测,定量分析多能性基因的表达水平,将ipscs培养至适当密度,使用秋水仙素处理1-2小时,以阻止细胞分裂中期,用低渗溶液处理细胞,使其膨胀,然后用甲醇-冰醋酸固定,将固定的细胞滴在载玻片上,进行giemsa染色,制备染色体片,在显微镜下观察染色体形态,分析核型是否正常,从ipscs中提取基因组dna,使用dna提取试剂盒,使用测序文库构建试剂盒,制备测序文库,使用高通量测序技术进行全基因组测序,分析数据以检测染色体异常和基因突变。
21、本发明取得的技术效果为:
22、ipscs可以分化成几乎所有类型的细胞,包括成纤维细胞,这为胶原蛋白的合成提供了丰富的细胞来源,通过定向分化,可以在体外精确控制成纤维细胞的生成和功能,使其更有效地合成胶原蛋白,使用供体自身的细胞进行重编程和分化,避免了免疫排斥反应的风险,这使得个性化医疗成为可能,可以为每个患者提供量身定制的胶原蛋白合成方案;
23、与胚胎干细胞不同,ipscs不涉及胚胎的使用,减少了伦理争议,使用体细胞重编程,不会破坏胚胎,符合伦理要求,通过优化培养条件和基因调控技术,可以显著提高成纤维细胞的胶原蛋白合成效率,获得高质量、高产量的胶原蛋白,ipscs技术允许严格的质量控制,通过核型分析、全基因组测序和多能性标志物检测,确保ipscs和分化后的细胞具有良好的遗传稳定性和多能性,细胞鉴定和质量控制步骤确保所用细胞符合实验和生产要求;
24、在胶原蛋白合成后,可以进行全面的功能测试,包括细胞增殖、迁移和胶原纤维形成能力的评估,这些测试确保合成的胶原蛋白具有良好的生物活性和机械性能,满足实际应用的需求,通过多种提取和纯化技术,可以高效分离和纯化胶原蛋白,确保最终产品的纯度和质量,质量检测方法确保胶原蛋白的结构和组成符合天然标准。
- 还没有人留言评论。精彩留言会获得点赞!