硒代、硫代或氧代那可丁衍生物及其合成与在肿瘤治疗中的应用
本发明属于医药,涉及一类硒代、硫代或氧代那可丁衍生物及其合成与在肿瘤治疗中的应用。
背景技术:
1、受到各种致癌因素的影响,机体组织的特定细胞无法正常调控基因表达,进而导致分化受阻、不可控性增殖,最终形成恶性肿瘤。这些肿瘤细胞的生长过程往往不受正常细胞周期调控机制的制约,无法被机体免疫系统识别,因此会不断地恶性增殖并侵蚀周围组织,最终导致机体营养的耗尽和死亡。研究表明,恶性肿瘤的发生受多种因素影响。内源性因素包括遗传、细胞周期调控异常、内分泌紊乱、精神因素等;外源性因素包括化学物质、放射性物质、以及病毒或细菌感染等。
2、天然产物是是药物先导物的主要来源之一。统计表明,从1981年至2010年的近30年中,fda批准上市的药物中,34%来源于天然产物,这一趋势在抗肿瘤药物中更为明显。尤其需要指出的是,抗肿瘤天然产物往往具有结构三维立体性强、作用机制多样、毒副作用可控等优势,在降低耐药性发生、治疗恶性肿瘤这种复杂疾病方面具有独特优势。那可丁(noscapine)是从罂粟中分离得到的苯酞四氢异喹啉类生物碱,其在罂粟中的含量仅次于吗啡。虽然与吗啡来源相同,却无任何成瘾性呼吸抑制的副作用,最早在临床上作为非处方止咳药使用,安全可靠,可口服给药。1998年,那可丁被发现对各种实体瘤,如肺癌和结肠癌等,表现出一定的抑制活性。同时,可透过血脑屏障,用于脑部神经胶质瘤的治疗。初步研究表明,其主要作用机制为微管蛋白抑制剂,通过与微管蛋白结合,干扰其动态平衡,致使细胞停滞于有丝分裂g2/m期并诱导细胞凋亡,产生抗肿瘤作用。然而活性不佳、水溶性较差、药代动力学性质不合理等缺陷的存在,制约了其在进一步抗肿瘤新药创制中的应用。
3、
4、研究表明,有机硒可以通过推高活性氧(reactive oxygen species,ros)的生成等方式发挥抗肿瘤作用,且在抗肿瘤化合物中引入有机硒结构具有协同增效的作用。致力于提高抗肿瘤活性,前期我们团队通过“硒引入”策略,合成了一系列9′位含硒基团取代那可丁衍生物。当在硒原子上直接连接疏水基团,且和那可丁母核之间存在亚甲基时,抗肿瘤活性普遍高于母体化合物那可丁,具有进一步开发的潜力(如上结构所示)。这类化合物已经申请中国专利,并获得授权(zl201910387757.3)。然而构效关系不明确、水溶性欠佳等问题的存在,不利于该类化合物在新药创制中的应用。
技术实现思路
1、为了解决现有那可丁衍生物水溶性不佳的问题,发明人进一步研究,将硒取代那可丁结构式中9′位含硒取代基进行变化,以及将硒原子换成硫原子或氧原子;或将含硒基团从9′位转至6′位或7位;或在保持9′位含硒取代基不变,进行6′位、7位和1位的基团变化,经过变化后的部分那可丁衍生物具有潜在较佳的水溶性和对肿瘤的活性抑制;这些研究为进一步相关新药创制奠定了基础。
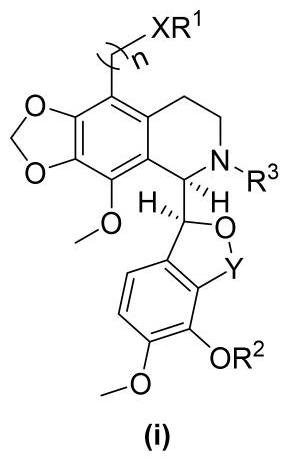
2、本发明第一个方面公开了一种硒代、硫代或氧代那可丁衍生物,所述硒代、硫代或氧代那可丁衍生物的结构通式如通式(i)所示:
3、
4、其中,x基团为硫原子、硒原子或氧原子。
5、y基团为亚甲基、氘代亚甲基、羰基。
6、n为0、1、2或3。
7、r1、r2、r3基团分别独立地选自烷基、环烷基、芳基、杂芳基、苄基或取代苄基。
8、优选地,所述烷基为c1-c12烷基、氘代烷基、氧原子取代烷基、氮原子取代烷基、氟原子取代烷基;
9、所述环烷基为c1-c8环烷基、氧原子取代烷基、氮原子取代烷基、氟原子取代烷基;
10、所述芳基为苯基、取代苯基、联苯基、萘基或取代萘基;
11、所述杂芳基为吡啶基、取代吡啶基、噻吩基、取代噻吩、喹啉基、取代喹啉基、异喹啉基、取代异喹啉基、苯并噻唑基、取代苯并噻唑基、苯并咪唑基、取代苯并咪唑基、苯并恶唑基、取代苯并恶唑基、吡嗪基、取代吡嗪基、哒嗪基或取代哒嗪基。
12、本发明第二个方面公开了一种硒代、硫代或氧代那可丁衍生物,所述硒代、硫代或氧代那可丁衍生物的结构通式如通式(ii)和(iii)所示:
13、
14、其中,n为1,2或3。
15、r4基团为烷基、环烷基、氰基、芳基或取代芳基。
16、优选地,所述烷基为c1-c12烷基和氘代烷基,所述环烷基为c1-c8环烷基和氘代环烷基。
17、进一步优选,所述硒代那可丁衍生物为以下化合物:
18、本发明第三个方面公开了上述那可丁衍生物的制备方法:
19、1.化合物s1-s27的制备方法:
20、
21、reagents and conditions:(a)paraformaldehyde,conc.hcl,50℃,overnight,98%;(b)pbr3,dcm,0℃to rt,2h;(c)r1sese r1,nabh4,etoh,rt,2h,n2,12%-40%,2steps
22、(1)将那可丁1(1.8g,4.4mmol)溶于50ml浓盐酸中,缓慢加入多聚甲醛(4g,133.2mmol),升温至50℃反应12h。反应完成后在冰浴下逐滴滴加氨水至ph 10。随后用乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=1:1)得化合物2,收率98%。1h nmr(400mhz,chloroform-d)δ6.91(d,j=8.3hz,1h),6.14(d,j=8.2hz,1h),5.88(s,2h),5.45(d,j=4.3hz,1h),5.23(s,1h),4.56(s,2h),4.31(d,j=4.3hz,1h),4.01(s,3h),3.92(s,3h),3.79(s,3h),2.71–2.53(m,2h),2.46(s,3h),2.39–2.27(m,1h),1.96–1.86(m,1h).
23、(2)化合物2(1.62g,3.7mmol)溶于37ml二氯甲烷中,冰浴下缓慢加入三溴化磷(1g,3.7mmol),之后室温反应2h。反应结束后加入冰水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩得粗产物3,无需纯化直接用于下一步反应。
24、(3)将芳基二硒醚(0.4mmol)与硼氢化钠(0.015g,0.4mmol)于反应瓶中,氮气保护下加入1ml无水乙醇,搅拌30min后加入化合物3(101.3mg,0.2mmol)反应2h。反应结束加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标产物s1-s27。
25、2.化合物s28-s34的制备方法:
26、
27、reagents and conditions:(a)paraformaldehyde,conc.hcl,50℃,overnight,98%;(b)socl2,dcm,0℃to rt,2h;(c)ksecn,mecn,80℃,5min,73%,2steps;(d)r1clorr1f,nabh4,etoh,reflux,12h,n2,11%-77%.
28、将那可丁1(1.8g,4.4mmol)溶于50ml浓盐酸中,缓慢加入多聚甲醛(4g,133.2mmol),升温至50℃反应12h。反应完成后在冰浴下逐滴滴加氨水至ph 10。随后用乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=1:1)得化合物2,收率98%。1h nmr(400mhz,chloroform-d)δ6.91(d,j=8.3hz,1h),6.14(d,j=8.2hz,1h),5.88(s,2h),5.45(d,j=4.3hz,1h),5.23(s,1h),4.56(s,2h),4.31(d,j=4.3hz,1h),4.01(s,3h),3.92(s,3h),3.79(s,3h),2.71–2.53(m,2h),2.46(s,3h),2.39–2.27(m,1h),1.96–1.86(m,1h).
29、将化合物2(1.62g,3.7mmol)溶于37ml二氯甲烷中,冰浴下缓慢加入0.5ml二氯亚砜,之后室温反应2h。反应结束后室温下快速真空浓缩蒸除溶剂,得粗产物4,无需纯化直接用于下一步反应。
30、将粗产物4溶解于74ml乙腈中,室温加入硒氰酸钾(0.8g,5.6mmol)后迅速置于80℃油浴中搅拌5min,随后快速冷却至室温,加水稀释,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=1:1)得化合物5,收率73%。1hnmr(400mhz,chloroform-d)δ7.01(d,j=8.3hz,1h),6.20(d,j=8.2hz,1h),5.99(d,j=2.5hz,2h),5.52(d,j=4.2hz,1h),4.45–4.35(m,2h),4.18(d,j=11.4hz,1h),4.09(s,3h),4.03(s,3h),3.86(s,3h),2.76–2.67(m,1h),2.54(s,3h),2.53–2.47(m,1h),2.47–2.37(m,1h),1.97–1.83(m,1h).13c nmr(100mhz,cdcl3)δ168.1,152.3,147.9,147.8,141.1,140.9,133.4,130.4,119.9,118.5,118.2,117.6,107.6,101.5,101.3,81.5,62.3,60.9,59.4,56.8,48.9,45.8,23.9,23.3.ms(esi-tof)m/z calcd.for c24h25n2o7se[m+h]+533.1,found 533.1.
31、称取化合物5(0.11g,0.2mmol)与硼氢化钠(0.015g,0.4mmol)于反应瓶中,氮气保护下加入1ml无水乙醇,搅拌30min后继续加入氟代或氯代烷烃(0.4mmol),回流反应12h。反应结束降至室温,加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标产物s28-s34。
32、3.化合物s35-s49的制备方法:
33、
34、reagents and conditions:(a)paraformaldehyde,conc.hcl,50℃,overnight,98%;(b)socl2,dcm,0℃to rt,2h;(c)ksecn,mecn,80℃,5min,73%,2steps;(d)1-bromocycloheptaner,nabh4,etoh,rt,2h,n2,42%;(e)memgbr,bnoh,toluene,120℃,4h,n2;(f)r2br,k2co3,acetone,reflux,12h,7%-29%,2steps.
35、(1)将那可丁1(1.8g,4.4mmol)溶于50ml浓盐酸中,缓慢加入多聚甲醛(4g,133.2mmol),升温至50℃反应12h。反应完成后在冰浴下逐滴滴加氨水至ph 10。随后用乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=1:1)得化合物2,收率98%。1h nmr(400mhz,chloroform-d)δ6.91(d,j=8.3hz,1h),6.14(d,j=8.2hz,1h),5.88(s,2h),5.45(d,j=4.3hz,1h),5.23(s,1h),4.56(s,2h),4.31(d,j=4.3hz,1h),4.01(s,3h),3.92(s,3h),3.79(s,3h),2.71–2.53(m,2h),2.46(s,3h),2.39–2.27(m,1h),1.96–1.86(m,1h).
36、(2)将化合物2(1.62g,3.7mmol)溶于37ml二氯甲烷中,冰浴下缓慢加入0.5ml二氯亚砜,之后室温反应2h。反应结束后室温下快速真空浓缩蒸除溶剂,得粗产物4,无需纯化直接用于下一步反应。
37、(3)将粗产物4溶解于74ml乙腈中,室温加入硒氰酸钾(0.8g,5.6mmol)后迅速置于80℃油浴中搅拌5min,随后快速冷却至室温,加水稀释,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=1:1)得化合物5,收率73%。1hnmr(400mhz,chloroform-d)δ7.01(d,j=8.3hz,1h),6.20(d,j=8.2hz,1h),5.99(d,j=2.5hz,2h),5.52(d,j=4.2hz,1h),4.45–4.35(m,2h),4.18(d,j=11.4hz,1h),4.09(s,3h),4.03(s,3h),3.86(s,3h),2.76–2.67(m,1h),2.54(s,3h),2.53–2.47(m,1h),2.47–2.37(m,1h),1.97–1.83(m,1h).13c nmr(100mhz,cdcl3)δ168.1,152.3,147.9,147.8,141.1,140.9,133.4,130.4,119.9,118.5,118.2,117.6,107.6,101.5,101.3,81.5,62.3,60.9,59.4,56.8,48.9,45.8,23.9,23.3.ms(esi-tof)m/z calcd.for c24h25n2o7se[m+h]+533.1,found 533.1.
38、(4)称取化合物4(0.11g,0.2mmol)与硼氢化钠(0.015g,0.4mmol)于反应瓶中,氮气保护下加入1ml无水乙醇,搅拌30min后继续加入溴代环庚烷(0.4mmol)反应2h。反应结束加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=3:1)得化合物6,收率42%。1h nmr(400mhz,cdcl3)δ6.97(d,j=8.3hz,1h),6.03(d,j=8.2hz,1h),5.96(m,2h),5.52(d,j=4.1hz,1h),4.40(d,j=4.2hz,1h),4.09(s,3h),4.02(s,3h),3.85(s,3h),3.70(m,2h),3.19–3.09(m,1h),2.68–2.59(m,1h),2.53(s,4h),2.40–2.29(m,1h),2.19–2.07(m,2h),1.87–1.75(m,1h),1.70(m,4h),1.55(m,3h),1.53–1.39(m,3h);13c nmr(100mhz,cdcl3)δ168.3,152.1,147.6,146.5,141.1,139.2,133.4,130.8,120.0,118.5,117.9,117.8,112.3,100.8,81.9,63.3,62.3,60.9,59.5,56.8,49.6,46.3,44.5,41.7,36.1,36.1,28.1,28.0,26.9,23.7,16.7.hrms(esi-tof)m/zcalcd.for c30h38no7se[m+h]+604.1808,found 604.1802.
39、(5)将甲基溴化镁(2.42ml,1.4m的四氢呋喃甲苯溶液,3.4mmol)在氮气保护条件下缓慢滴加至溶有苯甲醇(1.4ml,13.5mmol)的1ml甲苯溶液中,室温反应5min后置于120℃油浴中,加入溶有6(1.44g,2.4mmol)的2ml甲苯溶液,120℃下反应4h。随后冷却至室温,加入饱和柠檬酸水溶液搅拌至反应液暗红色褪去,加少量水稀释,石油醚:乙酸乙酯(1:1)混合溶剂萃取三次,水相用饱和碳酸钠溶液调节ph到9,之后加入乙酸乙酯萃取三次,有机相用10%柠檬酸钠溶液萃取两次,10%酒石酸钾钠溶液萃取两次,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后得粗产物7,无需纯化可直接用于下一步反应。
40、(6)将上一步得到的粗产物7溶于24ml丙酮溶液中,分别加入溴代烷烃(4.8mmol)和碳酸钾(663mg,4.8mmol),回流温度下反应12h。反应结束后冷却至室温,加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得化合物s35-s49。
41、4.化合物s50-s52的制备方法:
42、
43、reagents and conditions:(a):(i)hatu,dipea,dcm,rt,12h;(i)tfa,dcm,rt,1h,20%-47%,2steps.
44、将dipea(0.39g,3mmol)缓慢加入溶有hatu(0.76g,2mmol)、boc保护的氨基酸(2mmol)以及化合物s39(0.63g,1mmol)的dcm(20ml)溶液中,室温搅拌过夜。反应结束后,加水稀释,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后继续加入(10ml)dcm溶解,室温搅拌的过程中缓慢滴加tfa(5ml),反应1h后用饱和碳酸氢钠水溶液中和反应体系至ph 7,随后二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得化合物s50-s52。
45、5.化合物s53-s55的制备方法:
46、
47、reagents and conditions:(a):sncl4,tmsn3,dcm,rt,24h,n2,74%-91%;(b)cui,dipea,dcm,rt,16h,n2,48%-63%;(c)33%menh3 in etoh,rt,1h,6%-24%.
48、(1)将乙酰基保护的糖8(2.6mmol)溶于100ml二氯甲烷中,在氮气保护下向该溶液中加入tmsn3(0.34ml,2.60mmol)和1m的sncl4溶液(0.5ml,0.5mmol)。反应溶液在室温下搅拌24h。随后二氯甲烷稀释,饱和碳酸氢钠溶液洗涤,饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂得到油状粗产物叠氮基糖9。
49、(2)将化合物s37(126mg,0.2mmol)和叠氮基糖9(0.24mmol)置于反应瓶中,加入cui(1.9mg,0.01mmol)后用橡胶塞密封,对反应瓶置换氮气三次,随后加入dipea(25.9mg,0.2mmol),室温反应16h。反应结束后加水稀释,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后加入2ml 33%的menh3乙醇溶液,室温搅拌1h,随后减压蒸除溶剂,柱层析纯化得化合物s53-s55。
50、6.化合物s56-s69的制备方法:
51、
52、reagents and conditions:(a):(i)m-cpba,chcl3,-5℃,1h;(ii)feso4·7h2o,meoh,-5℃,8h,60%,2steps;(b)troccl,k2co3,mecn,rt,1h;(c)formaldehyde(37%-40%),conc.hcl,1,4-dioxane,50℃,overnight;(d)socl2,dcm,0℃to rt,2h;(e)ksecn,mecn,80℃,5min;(f)1-bromocycloheptaner,nabh4,etoh,rt,2h,n2;(g)zn dust,acoh,rt,12h,n2,12%,6steps;(h)for s56,cd3i,khco3,mecn,rt,1h,53%;for s57 and s60-s61,rbr,khco3,mecn,reflux,12h,39%-58%;for s58-s59,acetone or cyclopentanone,na(cn)bh3,acoh,meoh,rt,16h,61%-67%;for s62,(i)tert-butyl 4-bromobutanoate,khco3,mecn,reflux,12h;(ii)tfa,dcm,rt,2h,39%,2steps;for s63-s66,ch3nh2·hcl orcd3nh2·hcl or(ch3)2nh·hcl or meoh,bis(trichloromethyl)carbonate,tea,dcm,rt,12h,46%-57%;for s67:(i)tert-butoxycarbonylglycine,hatu,dipea,dcm,rt,12h;(ii)4m hcl in 1,4-dioxane,rt,1h,41%,2steps;for s68:(i)boc-l-serine,hatu,dipea,dcm,rt,12h;(ii)tfa,dcm,rt,1h,35%,2steps;for s69:(i)4-tert-butoxy-4-oxobutanoic acid,hatu,dipea,dcm,rt,12h;(ii)tfa,dcm,rt,1h,40%,2steps.
53、化合物17的制备方法:
54、(1)在-5℃下将m-cpba(2.8g,16.0mmol)缓慢加入溶有那可丁1(3.3g,8.0mmol)的80ml氯仿溶液中,在该温度下反应1h。随后加入冰的氯仿/异丙醇(3/1)溶液,用冰的10%氢氧化钠溶液、冰水以及冰的10%盐酸溶液洗涤有机相各两次,之后无水硫酸钠干燥,过滤浓缩得白色至淡黄色泡沫状固体。接着将其溶于80ml甲醇中,加入feso4·7h2o(4.4g,16.0mmo),在-5℃下搅拌8h,之后减压蒸除溶剂,反应混合物加入氯仿溶解,分别用0.1medta溶液和1m naoh溶液洗涤有机相各三次,之后无水硫酸钠干燥,过滤浓缩柱层析纯化(石油醚:乙酸乙酯=1:1)得化合物11,收率60%。1h nmr(400mhz,chloroform-d)δ6.93(d,j=8.3hz,1h),6.33(s,1h),6.00–5.92(m,3h),5.91(d,j=4.0hz,1h),4.85(d,j=4.0hz,1h),4.09(s,3h),4.06(s,3h),3.84(s,3h),2.69–2.59(m,1h),2.54–2.42(m,1h),2.36–2.26(m,1h),2.26–2.10(m,1h).
55、(2)向溶有11(4g,10mmol)的乙腈(100ml)溶液中滴加troccl(3.2g,15mmol),加毕后再分批加入k2co3(2.1g,15mmol),室温反应1h。反应结束后,减压蒸除溶剂,dcm溶解,加水稀释后用dcm萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后得到粗产物12。无需纯化,可直接用于下一步反应。
56、(3)将粗产物12用250ml 1,4-二氧六环溶液溶解,升温至50℃,剧烈搅拌下缓慢加入250ml浓盐酸,而后加入750ml 37%-40%的甲醛水溶液,于50℃下反应12h。反应完成后在冰浴下逐滴滴加氨水至ph 9-10。随后用乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后得粗产物13,无需纯化,直接用于下一步反应。
57、(4)将粗产物13溶于100ml二氯甲烷中,冰浴下缓慢加入1.4ml二氯亚砜,之后室温反应2h。反应结束后室温下快速真空浓缩蒸除溶剂,得粗产物14,无需纯化直接用于下一步反应。
58、(5)将粗产物14溶解于200ml乙腈中,室温加入硒氰酸钾(2.2g,15mmol)后迅速置于80℃油浴中搅拌5min,随后快速冷却至室温,加水稀释,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩得到粗产物15。
59、(6)粗产物15与硼氢化钠(567mg,15mmol)于反应瓶中,氮气保护下加入100ml无水乙醇,搅拌30min后继续加入溴代环庚烷(2.66g,15mmol)反应2h。反应结束加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩得粗产物16。
60、(7)将16(0.77g,1mmol)与活化后的锌粉(65.4mg,1mmol)一同置于反应瓶中,氮气置换三次后,向瓶内加入10mlacoh,随后在氮气氛围中反应12h。反应结束后,缓慢加入饱和碳酸氢钠溶液至反应体系ph到7,随后乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=2:1)得产物17,6步总产率12%。1h nmr(400mhz,chloroform-d)δ6.93(d,j=8.3hz,1h),6.03–5.96(m,2h),5.90(d,j=8.2hz,1h),5.85(d,j=4.2hz,1h),4.85(d,j=4.1hz,1h),4.09(s,3h),4.06(s,3h),3.84(s,3h),3.80–3.60(m,2h),3.20–3.09(m,1h),2.73–2.63(m,1h),2.60–2.48(m,1h),2.34–2.10(m,5h),1.79–1.64(m,4h),1.59–1.36(m,5h).13c nmr(150mhz,cdcl3)δ170.8,168.6,152.2,148.0,146.6,141.2,130.5,118.7,117.8,117.7,113.1,100.9,80.7,62.3,59.6,56.7,56.7,52.8,41.7,41.7,39.2,38.1,36.1,36.1,35.2,28.0,26.9,26.9,26.9,25.4,21.6,16.8.hrms(esi-tof)m/z calcd.for c29h35no780se[m+h]+590.1652,found 590.1665.
61、化合物s56-s57和s60-s62的制备方法:
62、将化合物17(117mg,0.2mmol)溶于2ml乙腈溶液中,分别加入卤代烷烃(0.4mmol)和碳酸氢钾(40mg,0.4mmol),回流温度下反应12h。反应结束后冷却至室温,加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标化合物s56-s57和s60-s62。
63、化合物s58-s59的制备方法:
64、将化合物17(117mg,0.2mmol)和相应的丙酮(23.2mg,0.4mmol)或环戊酮(33.6mg,0.4mmol)溶于2ml meoh溶液中,向其中加入na(cn)bh3(25.1mg,0.4mmol)和2.5μlacoh,随后室温反应16h。反应结束后加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标化合物s58-s59。
65、化合物s63-s66的制备方法:
66、将化合物17(117mg,0.2mmol)和三光气(89.0mg,0.3mmol)溶于2ml dcm中,缓慢加入tea(61.0mg,0.6mmol),室温反应1h后,再分别加入相应的ch3nh2·hcl(40.5mg,0.6mmol)或cd3nh2·hcl(42.3mg,0.6mmol)或(ch3)2nh·hcl(48.9mg,0.6mmol)或2ml meoh,继续反应12h。反应结束后,加水淬灭,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标化合物s63-s66。
67、化合物s67-s69的制备方法:
68、将化合物17(117mg,0.2mmol)与相应的boc保护的氨基酸(0.4mmol)溶于2mldcm中,依次加入hatu(152.1mg,0.4mmol)和dipea(51.7mg,0.4mmol),室温反应12h。反应结束后,加水淬灭,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后,继续用2mldcm溶解,加入0.6ml 4m hcl的1,4-二氧六环溶液或0.6ml tfa,室温搅拌1h,随后减压蒸除溶剂,柱层析纯化得目标化合物s67-s69。
69、7.化合物s70-s71的制备方法:
70、
71、reagents and conditions:(a)nabh4,bf3·et2o,thf,0℃to reflux,2h,74%;(b)nabd4,bf3·et2o,thf,0℃to reflux,2h,77%.
72、将nabh4(40mg,1mmol)或nabd4(41.9mg,1mmol)溶于4ml thf溶液中,冷却至-5℃后,向其中滴加溶有6(0.30g,0.50mmol)的2.5ml bf3·et2o溶液,在该温度下搅拌1h,然后回流反应2h。反应结束后置于冰浴中,用10%hcl淬灭,继续搅拌1h。随后加入2.5m naoh溶液至ph 8,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=1:2)得目标产物s70-s71。
73、8.化合物s72-s95的制备方法:
74、
75、reagents and conditions:(a)r1sh,k2co3,mecn,reflux,12h,64%-78%;(b)
76、将化合物3(2.53g,5mmol)溶于乙腈(50ml)中,依次加入硫醇衍生物(10mmol)和碳酸钾(1.38g,10mmol),随后反应升温回流12h。反应结束加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标产物s72-s95。
77、9.化合物s96-s102的制备方法:
78、
79、reagents and conditions:(a)pbr3,dcm,rt,2h,66%;(b)3,4-difluorothiophenol,tea,dcm,rt,12h,92%;(c)zn,acoh,rt,n2,12h,32%;(d)for s96,acetone,na(cn)bh3,acoh,meoh,rt,16h,42%;for s97-s99,cd3i or rbr,k2co3,mecn,rt,12h,26%-73%;for s100-s101,ch3nh2·hcl or(ch3)2nh·hcl,bis(trichloromethyl)carbonate,tea,dcm,rt,12h,26%-35%;for s102,ethyl isothiocyanate,k2co3,mecn,rt,12h,37%.
80、化合物20的制备方法:
81、(1)将化合物13溶于50ml二氯甲烷中,并在0℃条件下反应。缓慢向其中加入(4.06g,15mmol)的三溴化磷,随后让温度逐渐回升至室温,持续反应2至3小时。完成后,加水淬灭,用二氯甲烷萃取2~3次,随后饱和食盐水洗涤有机相,无水硫酸钠干燥,过滤并浓缩。最后,以石油醚与乙酸乙酯按5:1的比例作为洗脱溶剂,通过柱层析法对目标化合物进行纯化,得到目标化合物18,收率66%。
82、(2)在25ml的干燥圆底烧瓶中,准确称取化合物18(66.5mg,0.1mmol),并放入一个磁力搅拌子。向烧瓶中加入1ml二氯甲烷以溶解化合物。接着添加3,4-二氟苯硫酚(22.2mg,0.2mmol),并向反应体系中加入溶剂体积的10%三乙胺(0.1ml),在室温下搅拌反应12小时。完成反应后,用二氯甲烷萃取2~3次,随饱和食盐水洗涤有机相,无水硫酸钠干燥,过滤并浓缩。最后,以石油醚与乙酸乙酯按4:1的比例作为洗脱溶剂,通过柱层析法对目标化合物进行纯化,得到目标化合物19,收率为92%。
83、(3)在25ml干燥圆底烧瓶中放入磁力搅拌子,并精确称取n-troc化合物19(73.1mg,0.1mmol)。随后,向烧瓶中添加经10%盐酸溶液活化的锌粉(13.1mg,0.2mmol),进行三次氮气置换以排除氧气。接着,加入1ml的乙酸溶液,将反应混合物在室温下搅拌12小时。反应完成后,将混合物转移至冰浴中冷却,并在搅拌下逐渐加入10%氢氧化钠溶液,调节ph值至10。完成后,用二氯甲烷萃取2~3次,随后饱和食盐水洗涤有机相,无水硫酸钠干燥,过滤并浓缩。以石油醚与乙酸乙酯按3:1的比例作为洗脱溶剂,通过柱层析法对目标化合物进行纯化,得目标化合物20,收率32%。1h nmr(400mhz,cdcl3)δ7.26–7.16(m,1h),7.14–7.04(m,2h),6.92(d,j=8.2hz,1h),5.95(d,j=8.2hz,1h),5.91–5.82(m,3h),4.86(d,j=4.0hz,1h),4.09(s,3h),4.05–3.95(m,2h),4.02(s,3h),3.84(s,3h),2.73–2.68(m,1h),2.65–2.53(m,1h),2.65–2.53(m,1h),2.29–2.22(m,1h).
84、化合物s96的制备方法:
85、将化合物20(111.4mg,0.2mmol)和相应的丙酮(23.2mg,0.4mmol)溶于2ml meoh溶液中,向其中加入na(cn)bh3(25.1mg,0.4mmol)和2.5μlacoh,随后室温反应16h。反应结束后加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标化合物s96,收率42%。1h nmr(400mhz,cdcl3)δ7.16–7.11(m,1h),7.04–6.96(m,1h),6.91(d,j=8.1hz,1h),6.23–6.19(m,1h),5.81(d,j=1.4hz,1h),5.79(d,j=1.4hz,1h),5.38–5.31(m,1h),4.51(d,j=5.0hz,1h),4.02(s,3h),4.00–3.88(m,2h),3.95(s,3h),3.79(s,3h),3.16–3.04(m,1h),2.59–2.54(m,1h),2.51–2.45(m,1h),2.42–2.33(m,1h),1.79–1.70(m,1h),0.98(d,j=6.6hz,3h),0.87(d,j=6.6hz,3h).
86、化合物s97-s99的制备方法:
87、在25ml干燥圆底烧瓶中,准确称取化合物20(55.7mg,0.1mmol)。向烧瓶中加入1ml乙腈。随后添加相应的卤代烷烃(0.2mmol),加入完成后,分批加入碳酸氢钾(20.0mg,0.2mmol)。将整个反应体系置于设定温度的油浴中,持续搅拌反应12小时。反应完成后,首先过滤清除碳酸氢钾,然后使用旋转蒸发器清除乙腈。接着,加入水和二氯甲烷进行2~3次萃取,分离出有机相,饱和食盐水洗涤,无水硫酸钠干燥,过滤并浓缩,柱层析纯化得到目标化合物s96-s99。
88、化合物s100-s101的制备方法:
89、将化合物20(111.4mg,0.2mmol)和三光气(89.0mg,0.3mmol)溶于2ml dcm中,缓慢加入tea(61.0mg,0.6mmol),室温反应1h后,再分别加入相应的ch3nh2·hcl(40.5mg,0.6mmol)或(ch3)2nh·hcl(48.9mg,0.6mmol),继续反应12h。反应结束后,加水淬灭,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标化合物s100-s101。
90、化合物s102的制备方法:
91、将化合物20(111.4mg,0.2mmol)溶于2ml乙腈溶液中,分别加入硫代异氰酸乙酯(34.86mg,0.4mmol)和碳酸氢钾(40mg,0.4mmol),回流温度下反应12h。反应结束后冷却至室温,加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标化合物s102,收率37%。1h nmr(400mhz,cdcl3)δ7.43(d,j=8.3hz,1h),7.25–7.15(m,2h),7.14–7.02(m,2h),6.77(s,1h),6.16(d,j=2.2hz,1h),5.85(s,1h),5.70(d,j=3.1hz,2h),3.99(s,3h),3.98(s,2h),3.89(s,3h),3.84–3.65(m,2h),3.66–3.57(m,1h),3.56(s,3h),3.45–3.38(m,1h),3.29–3.17(m,1h),3.04–2.93(m,1h),1.29(t,j=7.3hz,3h).
92、10.化合物s103的制备方法:
93、
94、reagents and conditions:(a)dipea,dcm,50℃,2h,74%.
95、向溶有化合物2(88.7mg,0.2mmol)和溴代环庚烷(70.8mg,0.4mmol)的2mldcm中加入dipea(77.5mg,0.6mmol),升温至50℃反应2h,随后减压蒸除溶剂后柱层析纯化(石油醚:乙酸乙酯=2:1)得目标产物s103,收率74%。1h nmr(600mhz,chloroform-d)δ6.97(d,j=8.1hz,1h),6.19(d,j=8.1hz,1h),5.98–5.90(m,2h),5.60(s,1h),4.51–4.33(m,3h),4.08(s,3h),3.95(s,3h),3.85(s,3h),3.53–3.37(m,1h),2.79–2.59(m,2h),2.55(s,3h),2.48–2.34(m,1h),1.95–1.84(m,2h),1.77–1.56(m,10h).13c nmr(150mhz,cdcl3)δ152.2,147.7,140.1,133.3,118.3,118.0,111.3,100.8,79.4,62.3,61.1,60.8,59.3,56.7,45.8,33.9,29.7,28.4,27.2,23.0,23.0,14.1,8.6,1.0.hrms(esi-tof)m/z calcd.for c30h37no8[m+h]+540.2592,found 540.2599.
96、11.化合物s104-s114的制备方法:
97、
98、reagents and conditions:(a)rarylseseraryl,k2s2o8,tfa,rt,overnight,57%-78%.
99、分别称取那可丁(0.22g,0.5mmol)、过硫酸钾(0.054g,0.2mmol)和二硒醚(0.2mmol)溶于5ml三氟乙酸中,室温反应16h。反应结束后加水搅拌30min,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=3:1)得目标产物s104-s114。
100、12.化合物s115-s117的制备方法:
101、
102、reagents and conditions:(a)bromide,khco3,ki,ch3cn,80℃,12h;(b)ksecn,mecn,80℃,1h,32%-54%.
103、在干燥的25ml圆底烧瓶中,准确称取化合物11(39.9mg,0.1mmol),将1ml乙腈缓慢加入烧瓶中溶解底物。之后逐步加入所需量的双取代卤代烷(0.15mmol)。随后分批加入碳酸氢钾(15mg,0.15mmol)。将烧瓶置于80℃油浴中,回流反应12小时。反应结束后,过滤掉碳酸氢钾,浓缩有机相,柱层析法纯化,得中间体。随后将中间体用1ml乙腈溶解,加入硒氰酸钾(28.8mg,0.2mmol)。室温下反应1小时。反应完毕后,真空浓缩蒸除溶剂,并通过柱层析法纯化,最终得目标化合物s115-s117。
104、13.化合物s118-s123的制备方法:
105、
106、reagents and conditions:(a)rbr,nabh4,dipea,etoh,50℃,2h,n2,20%-59%.
107、称取化合物s115(0.11g,0.2mmol)与硼氢化钠(0.015g,0.4mmol)于反应瓶中,氮气保护下加入1ml无水乙醇,搅拌30min后继续加入溴代烷烃(0.4mmol)和n,n-二异丙基乙胺(0.039mg,0.3mmol),升温至50℃反应2h。反应结束加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标产物s118-s123。
108、14.化合物s125-s130的制备方法:
109、
110、reagents and conditions:(a)memgbr,bnoh,toluene,120℃,4h,n2;(b)1,3-dibromopropane,k2co3,acetone,reflux,12h,66%,2steps;(c)ksecn,mecn,reflux,4h,95%;(d)rbr,nabh4,dipea,etoh,50℃,2h,n2,26%-47%.
111、化合物s124的制备方法:
112、将甲基溴化镁(2.42ml,1.4m的四氢呋喃甲苯溶液,3.4mmol)在氮气保护条件下缓慢滴加至溶有苯甲醇(1.4ml,13.5mmol)的1ml甲苯溶液中,室温反应5min后置于120℃油浴中,加入溶有那可丁1(1g,2.4mmol)的2ml甲苯溶液,120℃下反应4h。随后冷却至室温,加入饱和柠檬酸水溶液搅拌至反应液暗红色褪去,加少量水稀释,石油醚:乙酸乙酯(1:1)混合溶剂萃取三次,水相用饱和碳酸钠溶液调节ph到9,之后加入乙酸乙酯萃取三次,有机相用10%柠檬酸钠溶液萃取两次,10%酒石酸钾钠溶液萃取两次,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后得粗产物21,无需纯化可直接用于下一步反应。
113、将上一步得到的粗产物21溶于24ml丙酮溶液中,分别加入1,3-二溴丙烷(970mg,4.8mmol)和碳酸钾(663mg,4.8mmol),回流温度下反应12h。反应结束后冷却至室温,加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=3:1)得化合物22,收率66%。1h nmr(400mhz,chloroform-d)δ6.88(d,j=8.2hz,1h),6.23(s,1h),5.99(d,j=8.2hz,1h),5.89–5.83(m,2h),5.50(d,j=4.2hz,1h),4.37–4.23(m,3h),3.97(s,3h),3.78(s,3h),3.76–3.63(m,2h),2.57–2.49(m,1h),2.47(s,3h),2.33–2.20(m,4h),1.85–1.73(m,1h).hrms(esi-tof)m/z calcd.for c24h26brno7[m+h]+520.0965,found 520.0970.
114、ksecn(0.46g,3.2mmol)加入溶有化合物22(0.83g,1.6mmol)的16ml乙腈溶液中,回流温度下反应4h,反应结束后减压蒸除溶剂,加水稀释,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化(石油醚:乙酸乙酯=2:1)得化合物s124,产率95%。1h nmr(400mhz,chloroform-d)δ6.97(d,j=8.3hz,1h),6.31(s,1h),6.09(d,j=8.2hz,1h),5.99–5.90(m,2h),5.59(d,j=4.1hz,1h),4.46–4.26(m,3h),4.04(s,3h),3.86(s,3h),3.57(t,j=6.5hz,2h),2.68–2.56(m,1h),2.54(s,3h),2.44–2.29(m,4h),1.92–1.85(m,1h).13c nmr(150mhz,cdcl3)δ168.4,152.6,148.5,145.8,140.9,140.4,134.0,118.4,117.9,102.3,102.3,100.8,82.0,71.6,60.8,59.4,59.4,56.6,30.8,27.2,27.2.hrms(esi-tof)m/z calcd.for c25h26n2o780se[m+h]+547.0978,found 547.0986.
115、化合物s125-s130的制备方法:
116、称取化合物s124(0.11g,0.2mmol)与硼氢化钠(0.015g,0.4mmol)于反应瓶中,氮气保护下加入1ml无水乙醇,搅拌30min后继续加入溴代烷烃(0.4mmol)和n,n-二异丙基乙胺(0.039mg,0.3mmol),升温至50℃反应2h。反应结束加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,过滤浓缩后柱层析纯化得目标产物s125-s130。
117、本发明第四个方面公开了上述的硒代、硫代或氧代那可丁衍生物在制备预防或治疗癌症药物中的应用。其中药物中以上述的硒代、硫代或氧代那可丁衍生物作为活性成分。优选地,药物组合物还包括药学上可接受的载体和辅剂。
- 还没有人留言评论。精彩留言会获得点赞!