一种蒽类化合物及其制备方法和应用
本发明涉及有机电致发光器件显示,具体是一种蒽类化合物及其制备方法和应用。
背景技术:
1、有机发光二极管(oled)是一种将电能转换为光能的装置,具有高效率、高对比度、响应速度快以及柔性等优点,是新一代显示技术,其器件结构通常由阳极、空穴注入层、空穴传输层、电子阻挡层、发光层、空穴阻挡层、电子传输层、电子注入层和阴极等构成,它的发光原理为:空穴从阳极注入后经空穴注入层、空穴传输层和电子阻挡层而进入发光层,同时电子从阴极注入后经电子注入层、电子传输层和空穴阻挡层而进入发光层,然后空穴与电子在发光层复合形成25%的单线态激子和75%的三线态激子,其中单线态激子可以直接辐射发光,而受自旋反转禁阻制约三线态激子难以直接辐射发光。
2、蓝光oled器件一直存在性能较差的问题,其直接制约oled面板的显示效果。决定oled器件性能的关键功能层是发光层,其通常由主体和染料构成,主体的作用包括注入电荷、传输电荷、产生激子以及转化激子等,因此主体的能级结构、传输特性以及激发态行为对oled器件的性能有决定性作用。蓝光oled器件常用主体是三线态-三线态湮灭(tta)型主体,其突出特征在于可以将两个不可发光的三线态激子转化为一个可发光的单线态激子,从而转化利用辐射发光禁阻的三线态激子,同时其具有三线态能级低的优势,可以有效避免产生破坏器件的高能激发态。
3、目前常用的tta型主体为蒽类衍生物,其存在两方面的问题:一方面是现在多数蒽类tta主体空穴传输迁移率过高而电子传输能力较差,导致载流子传输不平衡;另一方面是为了提升蒽类材料的载流子传输特性通常需要接入具有供电子或者吸电子特性的基团,然而这些基团的引入会改变蒽本身的能级结构和激发态特征,严重影响tta主体转化利用三线态激子的能力,这两方面的原因直接导致蓝光器件效率下降以及驱动电压升高。
技术实现思路
1、有鉴于此,本发明所要解决的技术问题在于提供一种蒽类化合物及其制备方法和应用,本发明提供的蒽类化合物用作蓝光电致发光器件的主体材料,所得的电致发光器件具有高的发光效率和低的驱动电压。
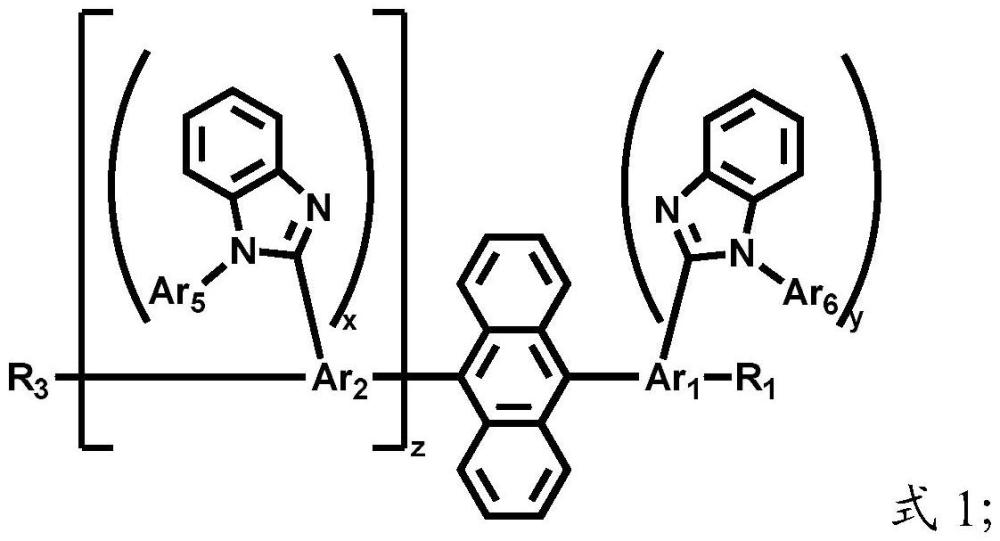
2、本发明提供了一种蒽类化合物,具有式1结构:
3、
4、其中,所述x和y独立地为1或2;
5、所述z为0或1;
6、所述ar1和ar2独立地包括c6~c60的芳基;
7、所述ar5和ar6独立地包括c6~c60的芳基或者c3~c29的杂芳基;
8、所述r1和r3独立地包括c1~c10的烷基、c6~c60的芳基、c6~c60的氘代芳基、c3~c60的杂芳基或者c3~c60的氘代杂芳基;
9、所述r1位于所述ar1上连接的所有ar6取代苯并咪唑基团的邻位;
10、所述r3位于所述ar2上连接的所有ar5取代苯并咪唑基团的邻位。
11、本发明提供的蒽类化合物具有式1结构,其以蒽基为结构主体,中央苯环上未被稠合的两个c分别连接有ar1基团和ar2基团,所述ar1基团上连接有r1基团和ar6取代苯并咪唑基团,所述ar2基团上连接有r3基团和ar5取代苯并咪唑基团。本发明所述z为0或1,当所述z为0时,所述r3直接与式1中的蒽基结构主体连接,而所述ar2及其上连接的ar5取代苯并咪唑基团不存在。
12、本发明所述ar1基团上连接有r1基团和ar6取代苯并咪唑基团,所述y代表所述ar1基团上连接的所述ar6取代苯并咪唑基团的数量,所述y为1或2。特别地,当y为2时,所述ar1基团上连接的2个所述ar6取代苯并咪唑基团可以相同或者不相同。
13、本发明所述ar2基团上连接有r3基团和ar5取代苯并咪唑基团;所述x代表所述ar2基团上连接的所述ar5取代苯并咪唑基团的数量,所述x为1或2。特别地,当x为2时,所述ar2基团上连接的2个所述ar5取代苯并咪唑基团可以相同或者不相同。
14、本发明所述r1和r3独立地包括c1~c10的烷基、c6~c60的芳基、c6~c60的氘代芳基、c3~c60的杂芳基或者c3~c60的氘代杂芳基。
15、优选地,所述r1和r3独立地包括c1~c5的烷基、苯基、氘代苯基、氰基取代的苯基、氰基取代的氘代苯基、c6~c10芳基取代的苯基、氘代c6~c10芳基取代的苯基、萘基、氘代萘基、c6~c10芳基取代的萘基、氘代c6~c10芳基取代的萘基、联苯基、氘代联苯基、c6~c10芳基取代的联苯基、氘代c6~c10芳基取代的联苯基、蒽基、氘代蒽基、c6~c10芳基取代的蒽基、氘代c6~c10芳基取代的蒽基、菲基、氘代菲基、c6~c10芳基取代的菲基、氘代c6~c10芳基取代的菲基、c3~c16杂芳基或c3~c16氘代杂芳基。
16、更优选地,所述r1和r3独立地包括具有式r-1~式r-48结构的基团中的一种;
17、
18、
19、其中,所述d为取代与之相连的芳基上的氢原子的氘原子,所述n代表取代数,所述n为0~13的整数。表明键可连接至其它基团上的合适的原子。
20、其中,所述dn代表具有式r-4~式r-6、r-9~式r-10、r-25~式r-44结构的基团各自的苯环上的h被n个氘原子取代,所述n为0~13的整数,并且所述n的数量不超过具有式r-4~式r-6、r-9~式r-10、r-25~式r-44结构的基团各自的苯环上的h的数量。非限制性实例包括:具有式r-4-a结构的基团或具有式r-5-a结构的基团;
21、
22、其中,表明键可连接至其它基团上的合适的原子。
23、本发明所述r1位于所述ar1上连接的所有ar6取代苯并咪唑基团的邻位;所述r3位于所述ar2上连接的所有ar5取代苯并咪唑基团的邻位。具体而言,当所述ar1基团上连接的所述ar6取代苯并咪唑基团只有1个时,所述r1与所述ar1基团上连接有所述ar6取代苯并咪唑基团的c的邻位上的2个c中的任一相连;当所述ar1基团上连接的所述ar6取代苯并咪唑基团有2个时,则该2个所述ar6取代苯并咪唑基团必然为间位,所述r1与所述ar1基团上连接有2个所述ar6取代苯并咪唑基团的c的共同邻位上的c相连。本发明所述r3与所述ar2上连接的所有ar5取代苯并咪唑基团的位置关系同理,不再赘述。
24、本发明所述ar5和ar6独立地包括c6~c60的芳基或者c3~c29的杂芳基。优选地,所述ar5和ar6独立地包括c6~c12的芳基或者c3~c11的杂芳基。更优选地,所述ar5和ar6独立地包括苯基、萘基、联苯基、氰基取代的苯基、三氟甲基取代的苯基或者氮杂芳基。在本发明的一些实施例中,所述ar5和ar6独立地包括具有式a-1~式a-25结构的基团中的一种:
25、
26、其中,表明键可连接至其它基团上的合适的原子。
27、本发明所述ar1和ar2独立地包括c6~c60的芳基。优选地,所述ar1和ar2独立地包括c6~c31的芳基。更优选地,当所述y为1时,所述ar1包括具有式2结构的基团;当所述y为2时,所述ar1包括具有式3结构的基团;
28、
29、其中,所述q为0或1;
30、所述ar3包括c6~c54的芳基,优选包括c6~c25的芳基,更优选包括苯基、萘基、蒽基、菲基、联苯基、芴基或螺二芴基;
31、当所述x为1时,所述ar2包括具有式4结构的基团;当所述x为2时,所述ar2包括具有式5结构的基团;
32、
33、其中,所述p为0或1;
34、所述ar4包括c6~c54的芳基,优选包括c6~c25的芳基,更优选包括苯基、萘基、蒽基、菲基、联苯基、芴基或螺二芴基;
35、其中,表明键可连接至其它基团上的合适的原子。
36、在本发明中,对于所述ar1基团而言,当式1中所述y为1时,所述ar1基团包括具有式2结构的基团,由于本发明式1中所述r1位于所述ar1上连接的所有ar6取代苯并咪唑基团的邻位,因此从式2苯环中画出的2个必然与式2苯环上的2个相互为邻位的c相连并且分别与式1中的所述r1基团和所述ar6取代苯并咪唑基团相连,而从ar3中画出的1个则与式1中的蒽基主体结构基团相连。非限制性实例包括式2-a所示结构的基团:
37、
38、当式1中所述y为2时,所述ar1基团包括具有式3结构的基团,由于本发明式1中所述r1位于所述ar1上连接的所有ar6取代苯并咪唑基团的邻位,因此从式3苯环中画出的3个中必然有2个与式3苯环上相互为间位的2个c相连并且与式1中的所述ar6取代苯并咪唑基团相连,还有1个则与所述2个c的共同邻位的c相连并且与式1中的所述r1基团相连。非限制性实例包括式2-b所示结构的基团:
39、
40、在本发明中,当所述ar1基团包括具有式2结构的基团并且q为0时,所述ar1基团为具有式2-c结构的基团。当所述ar1基团包括具有式3结构的基团并且q为0时,所述ar1基团为具有式2-d结构的基团:
41、
42、当所述ar1基团为具有式2-c结构的基团时,由于本发明式1中所述r1位于所述ar1上连接的所有ar6取代苯并咪唑基团的邻位,因此所述式2-c中从苯环中画出的3个中必然有2个与所述苯环上相互为邻位的c相连并分别与式1中的所述r1基团和所述ar6取代苯并咪唑基团相连,还有1个则与所述苯环上剩余的任意c相连并与式1中的蒽基主体结构基团相连。非限制性实例包括具有式2-e结构的基团;
43、
44、当所述ar1基团为具有式2-d结构的基团时,由于本发明式1中所述r1位于所述ar1上连接的所有ar6取代苯并咪唑基团的邻位,因此所述式2-c中从苯环中画出的4个中必然有2个与所述苯环上间位的2个c相连并且与式1中的所述ar6取代苯并咪唑基团相连,有1个则与所述间位的2个c的共同邻位c相连并且与式1中的所述r1基团相连,还有1个则与所述苯环上剩余的任意c相连并与式1中的蒽基主体结构基团相连。非限制性实例包括具有式2-f结构的基团;
45、
46、在本发明中,对于所述ar2基团而言,和上述ar1基团同理,不再赘述。
47、在本发明的某些实施例中,所述ar1和所述ar2独立地包括具有式a-1~式a-32所示结构的基团中的一种;
48、。
49、
50、在本发明的某些实施例中,本发明提供的蒽类化合物具有式h-1~式h-195结构中的一种;
51、
52、
53、
54、
55、
56、
57、
58、
59、
60、
61、
62、
63、
64、
65、
66、本发明还提供了上述任一技术方案所述的蒽类化合物的制备方法,包括以下步骤:
67、s1)将具有式6结构的化合物和具有式7结构的化合物反应,得到具有
68、式8结构的化合物;
69、
70、其中,x1和x2独立地包括cl或br;所述ar1、ar6、r1和y均和上述一样,不再赘述;
71、s2)将步骤s1)中具有式8结构的化合物硼酸化后和具有式9结构的化合物反应,得到所述蒽类化合物;
72、
73、其中,x3包括cl或br;所述ar2、ar5、r3和x均和上述一样,不再赘述。
74、本发明首先将具有式6结构的化合物和具有式7结构的化合物反应,得到具有式8结构的化合物。具体而言,本发明将具有式6结构的化合物和具有式7结构的化合物按照1:1的摩尔比在溶剂中反应,得到具有式8结构的化合物;所述溶剂无特殊限定,例如可以包括苯甲醚。
75、本发明得到具有式8结构的化合物后,将所述具有式8结构的化合物硼酸化。具体而言,在保护气体氛围下,将所述具有式8结构的化合物和硼酸化试剂、助催化剂和钯催化剂在溶剂中反应,使得所述具有式8结构的化合物硼酸化;所述反应的温度为60~110℃;所述反应的时间为10h~15h。在本发明的一些实施例中,所述具有式8结构的化合物和硼酸化试剂、助催化剂和钯催化剂的用量摩尔比例为(7~20):35:35:0.7。在本发明的某些实施例中,所述硼酸化试剂包括联硼酸频那醇酯、联硼酸新戊二醇酯、双联邻苯二酚硼酸酯中的至少一种;所述助催化剂包括醋酸钾、碳酸钾、碳酸钠、磷酸钾中的至少一种;所述钯催化剂包括pd(dppf)cl2、pd(dtbpf)cl2、pd-132中的至少一种;所述溶剂包括二氧六环、甲苯中的至少一种。
76、本发明将所述具有式8结构的化合物硼酸化后,将得到的产物和具有式9结构的化合物反应,得到所述蒽类化合物。具体而言,将所述具有式8结构的化合物硼酸化后得到的产物和具有式9结构的化合物、钯催化剂及碱性添加剂在溶剂下反应,得到所述蒽类化合物;所述反应的温度为100℃~120℃,所述反应的时间为22h~26h。在本发明的某些实施例中,所述硼酸化后得到的产物、具有式6结构的化合物、钯催化剂及碱性添加剂的摩尔比例为(5~15):(5~15):0.4:150,其中所述硼酸化后得到的产物和具有式8结构的化合物按照1:1的摩尔比例进行反应。在本发明的某些实施例中,所述碱性添加剂包括碳酸钾、醋酸钾、磷酸钾中的至少一种;所述钯催化剂包括pd-132、pd(dppf)cl2中的至少一种。
77、上述蒽类化合物的制备方法的路线如下:
78、
79、在本发明的第一实施方式中,上述蒽类化合物的制备方法中所述具有式7结构的化合物具体为当q不为0时,其由以下方法制备得到:
80、a1)将式(i-1)所示结构的化合物和式(i-2)所示结构的化合物进行反应,得到式(i-3)所示结构的化合物;
81、
82、b1)将步骤a1)中得到的式(i-3)所示的化合物与式(i-4)所示结构的化合物进行反应,得到式(i-5)所示结构的化合物;
83、
84、c1)将步骤b1)中得到的式(i-5)所示结构的化合物和x2-(ar3)q-b(oh)2进行反应,得到具有式7结构的化合物。
85、上述第一实施方式中,当q为0时,无需再进行步骤c1),步骤b1)所得的式(i-5)所示结构的化合物即为具有式7结构的化合物。上述第一实施方式中,所述x2、ar3、r1和q均和上述一样,不再赘述。
86、上述步骤a1)具体为:将式(i-1)所示结构的化合物、式(i-2)所示结构的化合物和焦亚硫酸钠在溶剂中进行反应得到式(i-3)所示结构的化合物;所述反应的温度为90~110℃,所述反应的时间为9h~11h。在本发明的某些实施例中,所述式(i-1)所示结构的化合物、式(i-2)所示结构的化合物、焦亚硫酸钠和溶剂比例为(40~80)mmol:(40~80)mmol:(80~160)mmol:(100~200)ml,其中所述式(i-1)所示结构的化合物和式(i-2)所示结构的化合物的用量摩尔比为1:1。在本发明的某些实施例中,所述溶剂包括n,n-二甲基甲酰胺。
87、得到式(i-3)所示结构的化合物后进行步骤b1),上述步骤b1)具体为:将所得到的式(i-3)所示的化合物、式(i-4)所示结构的化合物、钯催化剂和碱性添加剂在溶剂中进行反应,得到式(i-5)所示结构的化合物;所述反应的温度为100℃~120℃,所述反应的时间为22h~26h。在本发明的某些实施例中,所得到的式(i-3)所示的化合物、式(i-4)所示结构的化合物、钯催化剂、碱性添加剂和溶剂的比例为(5~30)mmol:(5~30)mmol:0.4mmol:150mmol:90ml,其中所得到的式(i-3)所示的化合物和式(i-4)所示结构的化合物按照1:1的摩尔比例进行反应。在本发明的某些实施例中,所述碱性添加剂包括碳酸钾、醋酸钾、磷酸钾中的至少一种;所述钯催化剂包括pd-132、pd(dppf)cl2、pd(dtbpf)cl2中的至少一种。
88、得到式(i-5)所示结构的化合物后进行步骤c1),上述步骤c1)具体为:将所得到的式(i-5)所示结构的化合物、x2-(ar3)q-b(oh)2、碱性添加剂和溶剂进行反应,得到具有式7结构的化合物;所述反应的温度为100℃~120℃,所述反应的时间为22h~26h。在本发明的某些实施例中,所得到的式(i-5)所示结构的化合物、x2-(ar3)q-b(oh)2、碱性添加剂和溶剂的比例为(5~30)mmol:(5~30)mmol:0.4mmol:150mmol:90ml。在本发明的某些实施例中,所述碱性添加剂包括碳酸钾、醋酸钾、磷酸钾中的至少一种;所述钯催化剂包括pd-132、pd(dppf)cl2、pd(dtbpf)cl2中的至少一种。
89、上述第一实施方式制备具有式7结构的化合物的路线如下:
90、
91、在上述第一实施方式中,当r1为苯取代苯并咪唑时,可以通过将式(z-1a)所示结构的化合物和按照1:2摩尔比反应得到式(i-5)所示结构的化合物,然后再进行后续步骤得到所述具有式7结构的化合物;
92、
93、在本发明的第二实施方式中,上述蒽类化合物的制备方法中所述具有式7结构的化合物具体为当q不为0时,其由以下方法制备得到:
94、a2)将式(ii-1)所示结构的化合物和式(ii-2)所示结构的化合物进行反应,得到式(ii-3)所示结构的化合物;
95、
96、b2)将步骤a2)中得到的式(ii-3)所示的化合物与式(ii-4)所示结构的化合物进行反应,得到式(ii-5)所示结构的化合物;
97、
98、c2)将步骤b2)中得到的式(ii-5)所示结构的化合物和x2-(ar3)q-b(oh)2进行反应,得到具有式7结构的化合物。
99、上述具有式7结构的化合物的制备方法中,当q为0时,无需再进行步骤c2),步骤b2)所得的式(ii-5)所示结构的化合物即为具有式7结构的化合物。上述第二实施方式中,所述x2、ar3、r1和q均和上述一样,不再赘述。
100、上述第二实施方式的步骤a2)和上述第一实施方式的步骤a1)相比,除了将式(i-1)所示结构的化合物和反应所得的产物(式(i-3)所示结构的)分别替换为式(ii-1)所示结构的化合物和式(ii-3)所示结构的化合物,其它均相同,不再赘述。
101、上述第二实施方式的步骤b2)和上述第一实施方式的步骤b1)相比,除了将式(i-3)所示的化合物和反应所得的产物(式(i-5)所示结构的化合物)分别替换为式(ii-3)所示的化合物和式(ii-5)所示的化合物,以及所得到的式(ii-3)所示的化合物和式(ii-4)所示结构的化合物按照1:2的摩尔比例进行反应,其它均相同,不再赘述。
102、上述第二实施方式的步骤c2)和上述第一实施方式的步骤c1)相比,除了将式(i-5)所示结构的化合物替换为式(ii-5)所示结构的化合物,以及反应所得的产物不同外,其它均相同,不再赘述。
103、上述第二实施方式制备具有式7结构的化合物的路线如下:
104、
105、在上述第二实施方式中,当r1为苯取代苯并咪唑时,可以通过将式(z-2a)所示结构的化合物和按照1:2摩尔比反应得到式(z-3a)所示结构的化合物,然后将得到的式(z-3a)所示结构的化合物进行甲酰化得到式(z-4a)所示的化合物,再将得到的式(z-4a)所示的化合物和按照1:1摩尔比反应得到式(ii-5)所示结构的化合物,最后进行后续步骤得到所述具有式7结构的化合物;
106、
107、在本发明的第三实施方式中,上述蒽类化合物的制备方法中所述具有式9结构的化合物具体为此时z为1,当p不为0时,其由以下方法制备得到:
108、a3)将式(a-1)所示结构的化合物和式(a-2)所示结构的化合物进行反应,得到式(a-3)所示结构的化合物;
109、
110、b3)将步骤a3)中得到的式(a-3)所示的化合物与式(a-4)所示结构的化合物进行反应,得到式(a-5)所示结构的化合物;
111、
112、c3)将步骤b3)中得到的式(a-5)所示的化合物与x3-(ar4)p-b(oh)2进行反应,得到具有式9结构的化合物。
113、上述第三实施方式中,当p为0时,无需再进行步骤c3),步骤b3)所得的式(a-5)所示结构的化合物即为具有式9结构的化合物。上述第三实施方式中,所述x3、ar4、r3和p均和上述一样,不再赘述。
114、上述步骤a3)具体为:将式(a-1)所示结构的化合物、式(a-2)所示结构的化合物和焦亚硫酸钠在溶剂中进行反应得到式(a-3)所示结构的化合物;所述反应的温度为90~110℃,所述反应的时间为9h~11h。在本发明的某些实施例中,所述式(a-1)所示结构的化合物、式(a-2)所示结构的化合物、焦亚硫酸钠和溶剂比例为(40~80)mmol:(40~80)mmol:(80~160)mmol:(100~200)ml,其中所述式(a-1)所示结构的化合物和式(a-2)所示结构的化合物的用量摩尔比为1:1。在本发明的某些实施例中,所述溶剂包括n,n-二甲基甲酰胺。
115、得到式(a-3)所示结构的化合物后进行步骤b3),上述步骤b3)具体为:将所得到的式(a-3)所示的化合物、式(a-4)所示结构的化合物、钯催化剂和碱性添加剂在溶剂中进行反应,得到式(a-5)所示结构的化合物;所述反应的温度为100℃~120℃,所述反应的时间为22h~26h。在本发明的某些实施例中,所得到的式(a-3)所示的化合物、式(a-4)所示结构的化合物、钯催化剂、碱性添加剂和溶剂的比例为(5~30)mmol:(5~30)mmol:0.4mmol:150mmol:90ml,其中所得到的式(a-3)所示的化合物和式(a-4)所示结构的化合物按照1:1的摩尔比例进行反应。在本发明的某些实施例中,所述碱性添加剂包括碳酸钾、醋酸钾、磷酸钾中的至少一种;所述钯催化剂包括pd-132、pd(dppf)cl2、pd(dtbpf)cl2中的至少一种。
116、得到式(a-5)所示结构的化合物后进行步骤c3),上述步骤c3)具体为:将所得到的式(a-5)所示结构的化合物、x3-(ar4)p-b(oh)2、碱性添加剂和溶剂进行反应,得到具有式9结构的化合物;所述反应的温度为100℃~120℃,所述反应的时间为22h~26h。在本发明的某些实施例中,所得到的式(a-5)所示结构的化合物、x3-(ar4)p-b(oh)2、碱性添加剂和溶剂的比例为(5~30)mmol:(5~30)mmol:0.4mmol:150mmol:90ml。在本发明的某些实施例中,所述碱性添加剂包括碳酸钾、醋酸钾、磷酸钾中的至少一种;所述钯催化剂包括pd-132、pd(dppf)cl2、pd(dtbpf)cl2中的至少一种。
117、上述第三实施方式制备具有式9结构的化合物的路线如下:
118、
119、在上述第三实施方式中,当r3为苯取代苯并咪唑时,可以通过将式(z-1b)所示结构的化合物和按照1:2摩尔比反应得到式(a-5)所示结构的化合物,然后再进行后续步骤得到所述具有式9结构的化合物;
120、
121、在本发明的第四实施方式中,上述蒽类化合物的制备方法中所述具有式9结构的化合物具体为此时z为1,当p不为0时,其由以下方法制备得到:
122、a4)将式(b-1)所示结构的化合物和式(b-2)所示结构的化合物进行反应,得到式(b-3)所示结构的化合物;
123、
124、b4)将步骤a4)中得到的式(b-3)所示的化合物与式(b-4)所示结构的化合物进行反应,得到式(b-5)所示结构的化合物;
125、
126、c4)将步骤b4)中得到的式(b-5)所示的化合物与x3-(ar4)p-b(oh)2进行反应,得到具有式9结构的化合物。
127、上述第四实施方式中,当p为0时,无需再进行步骤c4),步骤b4)所得的式(b-5)所示结构的化合物即为具有式9结构的化合物。上述第四实施方式中,所述x3、ar4、r3和p均和上述一样,不再赘述。
128、上述第四实施方式的步骤a4)和上述第三实施方式的步骤a3)相比,除了将式(a-1)所示结构的化合物和反应所得的产物(式(a-3)所示结构的)分别替换为式(b-1)所示结构的化合物和式(b-3)所示结构的化合物,其它均相同,不再赘述。
129、上述第四实施方式的步骤b4)和上述第一实施方式的步骤b3)相比,除了将式(a-3)所示的化合物和反应所得的产物(式(a-5)所示结构的化合物)分别替换为式(b-3)所示的化合物和式(b-5)所示的化合物,以及所得到的式(b-3)所示的化合物和式(b-4)所示结构的化合物按照1:2的摩尔比例进行反应,其它均相同,不再赘述。
130、上述第四实施方式的步骤c4)和上述第一实施方式的步骤c3)相比,除了将式(a-5)所示结构的化合物替换为式(b-5)所示结构的化合物,以及反应所得的产物不同外,其它均相同,不再赘述。
131、上述第四实施方式制备具有式9结构的化合物的路线如下:
132、
133、在上述第四实施方式中,当r3为苯取代苯并咪唑时,可以通过将式(z-2b)所示结构的化合物和按照1:2摩尔比反应得到式(z-3b)所示结构的化合物,然后将得到的式(z-3a)所示结构的化合物进行甲酰化得到式(z-4b)所示的化合物,再将得到的式(z-4b)所示的化合物和按照1:1摩尔比反应得到式(b-5)所示结构的化合物,最后进行后续步骤得到所述具有式9结构的化合物;
134、
135、
136、本发明提供了上述任一技术方案所述的蒽类化合物作为电子传输型主体材料在电致发光器件中的应用。
137、本发明还提供了电致发光器件,包括阳极、阴极以及位于所述阳极和所述阴极之间的有机薄膜层;所述有机薄膜层包括上述任一技术方案所述的蒽类化合物。具体而言,所述有机薄膜层包括发光层;所述发光层包括上述任一技术方案所述的蒽类化合物和蓝光染料;所述蓝光染料包括传统荧光染料和多重共振热活化延迟荧光染料。
138、本发明还提供了上述任一技术方案所述的蒽类化合物作为电子传输型主体材料在平面显示设备、柔性显示设备或照明光源中的应用。
139、本发明提供了一种蒽类化合物及其制备方法和应用。本发明提供的蒽类化合物包含电子传输单元苯并咪唑,可以促进器件发光层中的电子注入与传输,促进空穴与电子的电荷传输平衡,降低驱动电压;通过在苯并咪唑电子传输单元邻位引入空间位阻基团,增大了蒽单元与苯并咪唑的扭转角从而降低了两者的共轭程度,避免了苯并咪唑的拉电子作用改变蒽单元的激发态特征,保证其高效三线态激子上转化性质,保证了蒽基的高激子利用率和蓝光发射;同时苯并咪唑作为优良的电子传输单元可以有效提升主体电子传输能力,促进电致发光器件的电荷传输平衡。正是基于上述的作用原理,本发明提供的蒽类化合物用作蓝光染料的电子传输型主体材料,所得的电致发光器件表现出高的发光效率和低的驱动电压。试验表明,本发明提供的蒽类化合物用作蓝光染料的电子传输型主体材料,所得的电致发光器件的启亮电压低至2.7v,最大外量子效率高达12%以上。
- 还没有人留言评论。精彩留言会获得点赞!