串联式多光响应元件及设计方法及应用
本发明涉及一种串联式多光响应元件,特别是涉及串联式多光响应元件及设计方法及应用,属于串联式多光响应元件。
背景技术:
1、在花青素的合成途径的下游结构基因中,二氢黄酮醇-4-还原酶(dfr)与黄酮醇合成酶(fls)存在底物竞争关系,从而对花青素的积累产生影响,是花青素合成途径中的最为关键的两种酶类,茶树中花青素的积累受光照影响较为明显,如紫外线辐射会抑制fls的表达水平,使代谢通量向花青素合成转移,促进花青素的积累。
2、常规的酵母单杂交通常是以基因的启动子序列为杂交诱饵来筛选与其作用的蛋白,但通常所得到的结果缺乏针对性,通常无法得到想要的结果,为了克服现有技术的上述不足,提供串联式多光响应元件及设计方法及应用来解决上述问题。
技术实现思路
1、本发明的主要目的是为了提供串联式多光响应元件及设计方法及应用。
2、本发明的目的通过采用如下技术方案达到:
3、串联式多光响应元件设计方法,包括如下步骤:
4、步骤一:采用plantcare和place在线工具对茶树的多个csdfrs和csfls基因家族启动子元件分析;
5、步骤二:获得g-box(cacgtg)、box 4(attaat)和tct-motif(tcttac)三个光响应元件;
6、步骤三:将g-box(cacgtg)、box 4(attaat)和tct-motif(tcttac)三个光响应元件设计为含有各三个重复序列的序列:
7、attaatattaatattaatcacgtgcacgtgcacgtgtcttactcttactcttac(seq id no:1),合成这一的核苷酸序列,得到串联式多光响应元件。
8、将步骤三中合成的核苷酸序列如seq id no:1所示的诱饵元件序列连接至线性化的pabai载体上,连接得到pabai-lres重组质粒,其中插入的序列为:
9、attaatattaatattaatcacgtgcacgtgcacgtg tcttactcttactcttac ctcgag;
10、将线性化的pabai-lres重组质粒,通过同源重组整合到y1hgold酵母菌株中,得到y1hgold(pabai-lres)重组菌株。
11、从sd/-ura平板上挑取y1hgold(pabai-lres)重组菌株,用0.9%nacl重悬,使得od600为0.002的重悬菌液;
12、涂布100μl重悬菌液于以下培养基以筛选aba浓度:
13、sd/-ura;
14、sd/-ura with aba(100ng/ml);。
15、根据生长情况,选择最终筛选浓度用于后续酵母单杂交筛库实验。
16、将y1hgold(pabai-lres)重组菌株与构建的茶树文库(ht2021-15655)进行筛库;
17、具体包括如下步骤:
18、将y1hgold(pabai-lres)重组菌株的菌种在平板上划线30℃培养箱倒置培养3天,至克隆大小为2-3mm;
19、挑取直径2-3mm的单克隆于3mlypda培养液中,在30℃摇床250rpm振荡培养8h;
20、吸取10-15ul至50mlypda中250ml三角瓶,在30℃摇床230-250rpm振荡培养16-20h,至od600=0.15-0.3;
21、室温700g离心5min以收集菌体;
22、倒去上清并用100mlypda重悬酵母,在30℃摇床230-250rpm振荡培养3-5h,至od600=0.4-0.5;
23、室温700g离心5min以收集菌体,弃去上清并用60ml无菌去离子水重悬菌体;
24、室温700g离心5min以收集菌体,弃去上清并用3ml 1.1×te/liac溶液重悬菌体,同时将carrierdna预变性两次;
25、高速离心15s,收集菌体,加入600μl1.1xte/liac重悬菌体;
26、加入10ug酵母文库质粒,50ul预变性的carrierdna,轻轻混匀;
27、加入2.5ml 1xpeg/liac,混匀;
28、30℃水浴45min,每15min摇匀一次;
29、加入160μl dmso,轻轻混匀;
30、42℃水浴热激20min,每10min上下颠倒混匀一次;
31、700g离心5min,收集菌体;
32、加入3ml ypd plus 30℃振荡培养90min;
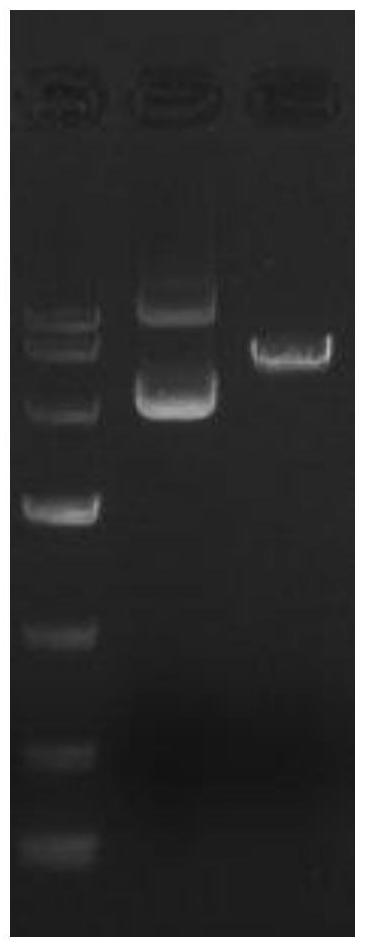
33、700g离心5min,收集菌体;
34、加入0.9%nacl悬浮菌体,至终体积6ml左右,取100μl 1/10浓度、1/100浓度的稀释液涂布100mm sd/-leu平板,用于计算转化效率,计算公式如下:
35、
36、其余菌液涂布于sd/-leu/aba*平板上150μl/块,约50块,在30℃恒温培养箱培养3-5天,单克隆长出至大小1-2mm,初筛完成;
37、将初筛平板上长出的阳性克隆转移到同样的筛选培养基sd/-leu/aba*上,进行二次筛选,筛选结果表明,出现32个个阳性克隆;
38、挑取生长较大的阳性克隆进行pcr鉴定,扩增产物通过琼脂糖凝胶电泳检测。
39、挑取pcr鉴定阳性的克隆接种于2ml液体培养基sd/-leu中,在30℃摇床振荡培养2天,利用酵母质粒小提试剂盒抽提酵母质粒,具体步骤如下:
40、取1~5ml酵母培养物,12000rpm离心1min,尽量吸除上清;
41、向菌体中加入300μl山梨醇buffer,加入50u lyticase,充分混匀,并在30℃摇床200rpm振荡处理1h,4000rpm离心10min,弃去上清,收集沉淀,加入250μl溶液yp1;
42、向管中加入250μl溶液yp2温和地上下翻转6~8次使菌体充分混匀,室温放置5~10min;
43、向管中加入350μl溶液yp3,立即温和地上下翻转6~8次,充分混匀,此时会出现白色絮状沉淀,12000rpm离心20min;
44、小心地将上清液加入吸附柱cp2中12000rpm离心1min倒掉废液,将吸附柱放到收集管中;
45、向吸附柱中加入500μl的缓冲液pd12000rpm离心1min,倒掉废液;
46、向吸附柱中加入600μl漂洗液pw12000rpm离心1min,倒掉废液,将吸附柱放入收集管中;
47、重复上一步;
48、将吸附柱放入收集管中12000rpm空离2min,目的是去除吸附柱中残余的漂洗液;
49、将吸附柱cp2置于一个干净的离心管中,向吸附膜的中间部位滴加50~100μl洗脱缓冲液eb,室温放置2min,12000rpm离心2min将质粒溶液收集到离心管中;
50、得到质粒预备扩增。
51、取5μl上一步提取的酵母质粒化学转化至dh5α感受态细胞中,涂布到含氨苄青霉素的lb板,37℃培养箱倒置培养过夜,约16h,挑取单菌落接到含氨苄青霉素的lb培养基,在37℃摇床260rpm振荡培养,培养20h后抽提质粒,得到质粒用于测序和一对一共转验证实验。
52、根据测序结果判断orf为是的筛选到的蛋白中的10个候选阳性克隆,进行一对一互作验证;
53、重新在sd/-leu/aba筛选培养基上进行活化复苏阳性克隆,酵母摇菌、质粒抽提、化转大肠杆菌dh5α,提取质粒作为prey质粒。然后与实施例2制备得到的y1hgold重组菌株进行一对一回转验证。
54、分别挑取经过一对一成功验证的7个阳性克隆菌株、重悬,调整od600=1,梯度稀释浓度为10-1到10-4,分别涂布sd/-leu平板上,评估生长状态,如能生长即说明猎物重组质粒pgadt7-b已成功转入宿主菌中且对宿主菌无毒性;
55、将7个阳性重悬的阳性克隆菌株分别涂布sd/-leu/+aba平板上,评估生长状态,能生长即说明诱饵质粒与阳性克隆菌株的质粒能够互作,激活了宿主菌报告基因abar/aur-c的表达。
56、将g-box(cacgtg)、box 4(attaat)和tct-motif(tcttac)三个光响应元件设计为含有各三个重复序列的序列:
57、attaatattaatattaatcacgtgcacgtgcacgtgtcttactcttactcttac(seq id no:1),合成这一的核苷酸序列,得到串联式多光响应元件。
58、本发明的有益技术效果:
59、本发明提供的串联式多光响应元件及设计方法及应用,本发明设计得到的光响应元件来源于csdfr和csfls基因家族的启动子序列,由于茶树及其它植物中dfr和fls基因是花青素合同途径中的关键基因,它们因受光照影响而调控花青素的合成。通过分析dfr和fls基因家族的启动子发现在启动子序列中存在多个光响应元件。因此,本发明以多个共有光响应元件重复序列及串联设计的酵母单杂交诱饵对于筛选光响应转录因子具有特殊性。
60、利用本发明设计得到的光响应元件作为酵母单杂交诱饵,筛选出的转录因子经过测序表明他们具有光响应活性特点,并进一步采用点对点法验证了筛选出的相关转录因子的基因序列;并通过对茶树遮荫处理后,对所筛选出的部分转录因子进行验证,表明其具有光响应的特点并调控相关花青素合成通路中的结构基因,上述结果证实利用本发明设计得到的光响应元件筛选转录因子具有较好的可靠性。
- 还没有人留言评论。精彩留言会获得点赞!