一种基于m6A表观遗传碱基修饰的ATP核酸适配体及其应用
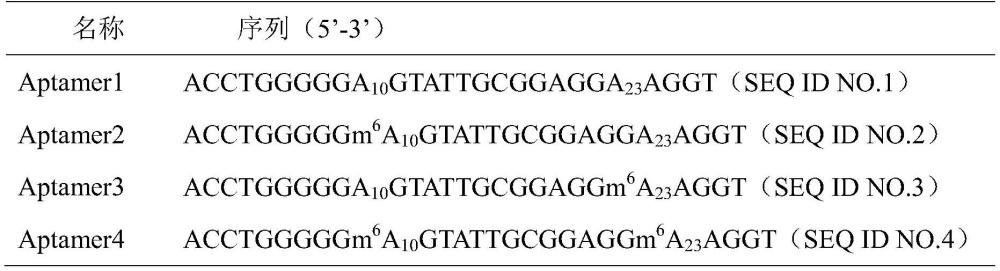
本发明属于生物传感检测领域,具体涉及一种基于m6a表观遗传碱基修饰的atp核酸适配体及其应用。
背景技术:
1、n6-甲基腺嘌呤(m6a)是指腺嘌呤a的第六位氮原子的甲基化修饰,是真核细胞中最普遍的表观遗传机制之一。m6a修饰在调节mrna的成熟、翻译和降解方面起着关键作用。m6a甲基化修饰在肿瘤的发生发展中发挥着不同的作用。m6a甲基化修饰动态变化且可逆转,主要调控因子包括甲基转移酶(writers)、去甲基化酶(erasers)和m6a甲基化阅读蛋白(readers)三部分。而作为m6a去甲基化酶之一的fto(脂肪和肥胖相关蛋白),其异常表达是各种人类疾病(如急性髓系白血病aml、黑色素瘤、乳腺癌和宫颈癌等)发病机制的基础,这也表明fto可以作为新的诊断生物标志物,并成为包括肿瘤在内的疾病治疗靶点。
2、然而,由于n6-甲基的尺寸较小且具有一定化学惰性,使得fto的m6a去甲基酶活性在细胞中的检测仍具挑战性。因此,目前只有少数方法被报告用于分析。这包括使用hplc或maldi-tof质谱法检测去甲基化dna/rna产物,酶消化底物的凝胶电泳法,荧光标记单链dna底物的荧光分析,m6a特异性抗体的免疫检测以及最近的基于rna适配体和mazf内切酶的荧光测定。虽然这些方法能对fto进行分析,但其中许多方法受到灵敏度差,低通量的限制,并且离线系综分析脱离了活细胞环境,忽略细胞间异质性,丢失活细胞关键动态信息。同时,迄今为止,实现实时分析活细胞中的m6a脱甲基酶活性的方法较少,且存在稳定性差、反应效率低等问题,导致无法实现长效稳定分析或动态信息滞后等问题。此外,受到体内循环系统与微环境调控的影响,在体检测的必要性不容忽视。但目前的分析方法均未能在活体层面得以应用,这严重阻碍了这些临床上重要的酶的研究。因此,亟需发展一种快速、灵敏、简便且能在活体中实时示踪fto酶活性的方法,并应用于fto抑制剂的筛选。
技术实现思路
1、本发明的发明思路是:本发明开发了一种由m6a位点特异性修饰的atp核酸适配体传感器以实现活体内去甲基化酶fto检测的新方法。该核酸适配体传感器(asp sensor)由aptamer、poly-t linker和封闭链组成一个完整的发夹结构,cy3荧光基团以及其相应淬灭基团bhq2分别修饰于asp sensor的5’和3’端,使得初始荧光信号为淬灭状态。首先,aspsensor对于atp的识别结合能力被aptamer关键碱基位点的m6a甲基化修饰所抑制,使得aptamer与atp的结合能小于与封闭链结合的自由能。当m6a-asp sensor由脂质体递送到细胞内时,细胞质内内源性的去甲基化酶fto对m6a-asp sensor中的m6a进行氧化去甲基化,恢复asp sensor对内源性atp的识别结合活性,aptamer与atp的结合能大于与封闭链结合的自由能,使得探针变构恢复荧光,从而实现对内源性去甲基化酶fto的成像检测。
2、本发明第一方面的目的,在于提供一种核酸适配体。
3、本发明第二方面的目的,在于提供一种m6a修饰的核酸适配体传感器。
4、本发明第三方面的目的,在于提供本发明第一方面的核酸适配体、本发明第二方面的m6a修饰的核酸适配体传感器在制备产品中的应用。
5、本发明第四方面的目的,在于提供一种试剂。
6、本发明第五方面的目的,在于提供一种试剂盒。
7、本发明第六方面的目的,在于提供一种成像系统。
8、本发明第七方面的目的,在于提供一种方法。
9、为了实现本发明上述的目的,本发明采取的技术方案是:
10、本发明的第一个方面,提供一种核酸适配体,其特征在于:
11、所述核酸适配体的序列如seq id no.1所示。
12、所述核酸适配体的第10位、和/或第23位腺嘌呤具有m6a修饰。
13、优选地,所述核酸适配体的第10位腺嘌呤具有m6a修饰。
14、本发明的第二个方面,提供一种m6a修饰的核酸适配体传感器,所述m6a修饰的核酸适配体传感器包括核酸适配体序列、poly-t序列、封闭链序列;所述m6a修饰的核酸适配体传感器的两端具有荧光基团和淬灭基团。
15、优选地,所述m6a修饰的核酸适配体传感器从5’端到3’端依次为核酸适配体序列、poly-t序列、封闭链序列。
16、优选地,所述poly-t序列的长度为3~25个碱基,进一步优选地,为4~20个碱基。
17、在本发明的一些实施方式中,所述poly-t序列的长度为12个t碱基序列。
18、优选地,所述封闭链序列的长度为4~10个碱基。
19、优选地,所述封闭链序列与核酸适配体序列的5’端反向互补配对。
20、在本发明的一些实施方式中,所述封闭链序列具有6个碱基,与核酸适配体序列5’端的前6个碱基互补配对。
21、优选地,所述m6a修饰的核酸适配体传感器的5’端和3’端具有稳定碱基。
22、优选地,所述m6a修饰的核酸适配体传感器5’端的稳定碱基与3’端的稳定碱基互补配对。
23、优选地,所述稳定碱基个数为1~3个。
24、优选地,所述稳定碱基选自g或c。
25、在本发明的一些实施方式中,所述稳定碱基的个数为一个,其中5’端的稳定碱基为c,3’端的稳定碱基为g。同理,也可以是5’端的稳定碱基为g,3’端的稳定碱基为c。
26、优选地,所述荧光基团选自fam、hex、rox、tamra、joe、cy3、cy5、vic中的至少一种。
27、优选地,所述淬灭基团选自dabcyl、bhq1、bhq2、bhq3、mgb、tamra中的至少一种。
28、优选地,所述核酸适配体序列具有m6a修饰;
29、优选地,所述核酸适配体的序列如seq id no.1所示,所述核酸适配体的第10位、和/或第23位腺嘌呤具有m6a修饰。
30、在本发明的第二个方面中,所述核酸适配体传感器的设计思路是,通过引入poly-t序列、封闭链序列,使得传感器本身形成回环的发卡结构,当不具有atp时,封闭链序列与核酸适配体序列的5’端序列互补结合,使得传感器两端的荧光基团与淬灭基团相接近,使得初始荧光为淬灭状态。当具有atp时,核酸适配体序列与与atp的结合能大于与封闭链结合的自由能,使得传感器构型发生改变,荧光基团与淬灭基团分离,传感器恢复荧光信号,实现对atp的检测。
31、基于该思路,进一步地,所述m6a修饰的核酸适配体传感器的设计思路是,在核酸适配体传感器的基础上,对核酸适配体序列进行m6a修饰,使得初始的核酸适配体序列与atp的结合位点被封闭,核酸适配体序列无法结合atp。m6a甲基化修饰的引入,使得核酸适配体传感器的功能从检测atp转变为检测去甲基化酶,当不具有去甲基化酶时,核酸适配体序列无法结合atp,无法进行构型改变,初始荧光为淬灭状态。当存在去甲基化酶时,去甲基化酶可以去除核酸适配体序列上的m6a修饰,使得该传感器恢复原有的结合atp的能力,并基于本发明第二个方面核酸适配体传感器的设计思路,在atp的存在下使得传感器恢复荧光信号,从而实现对去甲基化酶的检测。
32、本领域技术人员可以根据检测仪器的具体检测波段,选择合适的荧光基团,并搭配相应的淬灭基团。其中荧光基团、淬灭基团分别位于传感器的两端,其具体的位置方向不会成为本发明的限制。
33、进一步地,本领域技术人员可以基于上述思路,对能与atp结合的其他核酸适配体序列进行相应的改造。出于实验成本、周期的因素,申请人只进行了一种核酸适配体序列(seq id no.1)的传感器改造,但可以预期,其他atp核酸适配体序列也可以基于该思路进行改造,得到其他序列不同的核酸适配体传感器。本发明提供了一种优选的结合atp的核酸适配体序列,其他结合atp的序列也可以预期取得本发明相似或相同的效果。核酸适配体的具体序列不应该成为本发明的限制。例如:由于该atp核酸适配体含有与配体结合的g4重要结构,本方法对g4附近的a碱基进行m6a甲基化从而干扰了适配体与配体的结合,降低了两者的空间匹配度和相互作用力,最终降低了两者的结合能力,由此可以推测,该方法能够适用于含有g4结构的适配体,例如凝血酶thrombin的适配体tba,以及核仁素的适配体as1411,均含有与配体结合的g4结构,在这些g4结构附近的m6a修饰可以预测能够干扰其结合能力,从而可将asp中的适配体序列替代为tba或as1411。
34、本发明的第三个方面,提供本发明第一方面的核酸适配体、本发明第二方面的m6a修饰的核酸适配体传感器在制备产品中的应用,所述产品用于a1)~a5)中的任一种:
35、a1)检测去甲基化酶;
36、a2)筛选去甲基化酶激活剂;
37、a3)筛选去甲基化酶抑制剂;
38、a4)细胞成像;
39、a5)亚细胞结构成像。
40、优选地,所述去甲基化酶包括肥胖相关蛋白(fat mass and obesity-associatedprotein,fto)、alkb同系物5(alkb homolog 5,alkbh5)中的至少一种。
41、优选地,所述去甲基化酶激活剂包括提高去甲基化酶表达量的物质、提高去甲基化酶活性的物质、延缓去甲基化酶分解的物质。
42、本领域技术人员可以通过设计相应的实验体系完成上述激活剂或抑制剂的筛选。例如,在体外实验体系中加入少量去甲基化酶,并通过该体系完成对候选分子的筛选,若某一候选分子的加入提高了荧光信号,则说明该候选分子具有激活去甲基化酶活性的功能;或者设计相应的细胞体系,设计特定的筛选体系,筛选提高去甲基化酶活性、提高去甲基化酶表达量、延缓去甲基化酶分解的候选分子。
43、优选地,所述去甲基化酶抑制剂是指降低去甲基化酶表达量的物质、降低去甲基化酶活性的物质、促进去甲基化酶分解的物质。
44、同理,本领域技术人员可以根据激活剂的筛选思路筛选对应的抑制剂。
45、在本发明的第三个方面,所述产品包括但不限于试剂、试剂盒、系统、芯片中的至少一种。
46、所述细胞成像是指,基于实时的荧光反应变化来追踪活细胞环境内atp或去甲基化酶的动态变化。亚细胞结构成像是指,基于实时的荧光反应变化来追踪活细胞环境中亚细胞结构内的atp或去甲基化酶的动态变化
47、所述亚细胞结构包括细胞核、线粒体、内质网、高尔基体、溶酶体、囊泡系统、细胞膜中的至少一种。
48、本发明的第四个方面,提供一种试剂,包括本发明第一个方面的核酸适配体、和/或第二个方面的m6a修饰的核酸适配体传感器。
49、本发明的第五个方面,提供一种试剂盒,包括本发明第一个方面的核酸适配体、和/或第二个方面的m6a修饰的核酸适配体传感器。
50、优选地,所述试剂盒还包括缓冲液。
51、优选地,所述缓冲液包括pbs、tbs、tris-hcl、hbss中的至少一种。
52、优选地,所述试剂盒包括阳性标准模板和阴性标准模板。优选地,所述阳性标准模板为定量的atp或定量的去甲基化酶标准样品。
53、优选地,所述阴性标准模板为不含atp或不含去甲基化酶的标准样品。
54、优选地,所述阳性标准模板用于判断检测体系是否能够成功完成检测。
55、优选地,所述阴性标准模板用于判断检测体系不存在样本污染。
56、优选地,所述试剂盒还包括说明书。
57、优选地,所述说明书记载了各试剂具体信息、使用方法等操作说明。
58、本发明的第六个方面,提供一种成像系统,包括以下构件:
59、1)样品检测构件;
60、2)数据处理构件;
61、3)结果输出构件。
62、优选地,所述样品检测构件包括本发明第四个方面的试剂、和/或本发明第五个方面的试剂盒。
63、优选地,所述样品检测构件包括检测仪器。
64、优选地,所述检测仪器包括激光显微镜、活体成像仪中的至少一种。
65、本发明的第七个方面,提供c1~c2)中任一项的方法,包括使用本发明第四个方面的试剂、和/或本发明第五个方面的试剂盒的步骤。
66、c1)非诊断、治疗目的地检测atp的方法;
67、c2)非诊断、治疗目的地检测去甲基化酶的方法。
68、本发明的有益效果是:
69、本发明提供了一种核酸适配体即核酸适配体传感器。基于核酸适配体探针对靶标的识别和结合特异性,构建了单位点甲基化封闭开关型功能探针,实现了内源性去甲基化酶的活细胞以及活体成像检测。以atp及其适体为例,m6a甲基化修饰适体关键位点,以影响适体与配体间的结合稳定性,经内源性fto去甲基化后,适体恢复活性位点,可快速与atp结合,并被驱动变构释放荧光,实现fto的原位即时检测。该方法具有以下优点:
70、1、该报道首次实现活体层面的fto原位成像检测,并且也是首次利用脱氧核糖核苷酸(即dna)适体探针检测fto酶活性;
71、2、改良的核酸适体探针为单链dna发夹探针,对比已报到的rna探针,更加方便合成,结构稳定,不易降解,且具有良好的生物安全性;
72、3、通过计算机辅助分子模拟,实现精确分子对接和研究甲基化修饰对热力学、动力学的影响;
73、4、仅由单个甲基修饰即能引起atp适体结合能上的巨大差异;
74、5、灵敏度高,准确性好,检出限低至0.3nm;
75、6、特异性好,对其他内源性蛋白质和小分子化合物无特异性响应。
- 还没有人留言评论。精彩留言会获得点赞!