一种蔗糖异构酶及其制备方法
本发明属于生物酶工程,具体涉及一种蔗糖异构酶及其制备方法。
背景技术:
1、异麦芽酮糖又称为帕拉金糖,是一种蔗糖的同分异构体,天然存在于甜菜和蜂蜜等食物中,因此也是一种天然糖类。因其不致龋齿、对血糖值影响不大等特点,异麦芽酮糖在食品、饮料等领域需求量较大。但因其在天然产物中含量非常低,因此食品工业生产中的异麦芽酮糖依赖于通过利用化学合成、生物转化等方法人工制备获得。
2、现有技术中,采用化学合成方法制备异麦芽酮糖,因其制备成本高、且环境污染问题较为严重,因此并不适于产业化推广应用;采用微生物发酵转化方法制备异麦芽酮糖虽然具有发酵成本低的优点,但由于发酵产物成分复杂,导致后续提纯成本较高,因此仍然有较大的技术改进空间。
3、生物体代谢中,蔗糖异构酶(sucrose isomerase)是一种能够将蔗糖异构化形成异麦芽酮糖和海藻酮糖的生物酶,因此,基于生物酶转化法来制备异麦芽酮糖具有转化效率高、易于提纯的优点,也是目前最有应用产业化应用前景的异麦芽酮糖制备方法。但由于天然蔗糖异构酶的制备方法、以及该酶酶活是制约利用生物酶转化方法制备异麦芽酮糖制备的关键制约因素,因此,对蔗糖异构酶的制备方法、以及该酶酶活改进是亟需解决的技术问题。
技术实现思路
1、本技术主要目的在于提供一种蔗糖异构酶的制备方法,并通过化学修饰对所制备蔗糖异构酶的酶活进行进一步改进,从而为后续异麦芽酮糖的制备奠定一定技术基础。
2、本技术所采取的技术方案具体如下。
3、一种蔗糖异构酶,其通过如下步骤制备获得:
4、(一)原核表达制备蔗糖异构酶
5、采用基因工程方法,利用大肠杆菌原核表达系统制备蔗糖异构酶;
6、所述蔗糖异构酶(599aa),其氨基酸序列如seq id no.1所示,具体如下:msfikrrtaaalalsslmmtwacpslsatpsfaddidvhkentfpawwkeavfyqvyprsfkdtngdgigdirgiiekldylkslgidaiwinphydspntdngydisnyqqimkeygtmadfdtliaemkkrnmrlmidvvinhtsdrhpwfiqsksgknnpyrdyyfwrdgkdnqppnnypsffggsawqkdaksgqyylhyfarqqpdlnwdnpkvredlyamlrfwldkgvsgmrfdtvatyskipgfpdltpeqqknfaqqytmgpnihqyiqemnrevlshydvatageifgvpldrssqffdrrrhelnmafmfdlirldrdsnerwrhrpwtlsqfrqivskmdttvgeygwntffldnhdnpravshfgddspqwreasakalatvtltqratpfiyqgselgmtnypfkklsefddievkgfwhdyvesgkvtaaefldnvrltsrdnsrtpfqwddsqnagftsgkpwfhvnpnyvqinaareltenksvlnyykqmihlrhelpalvygayqdlnpqdnsvyaytrtldnerylvvvnfkeqpvryalpdndaieqvmietnqqsdtakestaialspwqagvyklr;
7、原核表达制备所述蔗糖异构酶时,根据大肠杆菌的密码子偏好性、质粒载体酶切位点(在5’端和3’端分别引入bamh i和xho 1限制性酶切位点)因素、以及后续分离纯化便捷性(在3’端插入6个his标签),对应的编码基因序列(1830bp)如seq id no.2所示,具体如下:
8、ggatccatgtctttcatcaaacgtcgtaccgcggctgcgctggcgctgagctctctgatgatgacctgggcttgcccgagcctgagcgctaccccgtctttcgctgatgacatcgatgttcacaaagaaaacaccttcccggcctggtggaaagaagcagttttctatcaggtttacccgcgtagcttcaaagataccaacggtgatggcatcggtgatatccgtggtatcatcgaaaaactggactacctgaaatctctgggcatcgatgccatctggattaacccgcactacgactctccgaacaccgataacggctatgatattagcaactaccagcaaatcatgaaagaatacggcaccatggctgatttcgacaccctgatcgcggaaatgaaaaaacgtaacatgcgtctgatgatcgacgttgtgattaaccatacttctgaccgtcacccgtggttcattcagtctaaaagcggcaaaaacaacccgtaccgtgattactacttctggcgtgatggtaaagacaaccagccaccgaacaactacccgtctttctttggtggctctgcgtggcagaaagatgcaaaatccggccagtactacctgcattactttgcacgtcagcagccggacctgaactgggataacccgaaagtgcgtgaagatctgtacgcgatgctgcgtttctggctggacaaaggtgtttccggcatgcgttttgataccgttgccacctactccaaaatcccaggcttcccggatctgactccggaacagcagaaaaactttgcgcagcagtacaccatgggcccgaacatccaccagtacatccaggaaatgaaccgtgaagtgctgagccactacgatgttgcgaccgcgggcgaaatcttcggcgtaccgctggatcgcagcagccagttcttcgaccgccgtcgtcacgagctgaacatggcgttcatgttcgacctgatccgtctggatcgtgattctaacgaacgttggcgccatcgcccgtggaccctgtctcagtttcgtcagattgtgagcaaaatggacaccaccgttggtgaatacggttggaacaccttctttctggataaccatgacaaccctcgtgcggtttctcatttcggtgatgactccccgcagtggcgcgaagcgagcgctaaagcactggcgaccgttaccctgacccagcgtgcaaccccgttcatctaccagggtagcgaactgggtatgactaactacccgttcaaaaaactgtccgaattcgatgacatcgaagttaaaggtttctggcatgactacgttgaatctggtaaagtgaccgcagcagaatttctggataacgttcgtctgaccagccgcgataacagccgtaccccgttccagtgggatgacagccagaacgcgggcttcacctctggcaaaccgtggttccacgttaacccgaactacgttcagatcaacgcggctcgtgaactgaccgaaaacaaatccgtcctgaactactataaacagatgatccacctgcgtcacgaactgccggctctggtgtacggtgcataccaggatctgaacccgcaggataactccgtttacgcatatactcgtactctggataacgaacgctatctggtagttgttaacttcaaagaacagccggtgcgttacgcgctgccggataacgacgcgatcgaacaggttatgattgaaaccaaccagcagtctgacaccgcgaaagaatctaccgcgatcgcgctgagcccgtggcaggcgggcgtttacaaactgcgtcaccaccaccaccaccattaactcgag;
9、具体制备时:
10、(1)将如seq id no.2所示的编码基因序列与质粒pet-28a(+)进行连接重组,以制备获得命名为rosi的重组质粒表达载体(委托上海生工生物工程有限公司制备提供,提供的成品形态为干粉形式);
11、(2)将上述重组质粒表达载体rosi加入到预先冰上解冻后的e.coli bl21 de(3)感受态细胞中,轻弹混匀后,再冰水混合物中静置10min;静置结束后,42℃、热激60~90s,立即冰浴3min;冰浴结束后,加入600μl的lb液体培养基,37℃、180rpm摇床复苏培养45min;
12、吸取上述50-100μl的复苏后产物均匀涂布于抗性(含kana 50μg/ml)lb平板上,37℃培养12h后,挑取阳性单克隆转接至抗性(含kana 50μg/ml)lb液体培养基中,37℃、180rpm扩增培养12h;
13、对上述扩增培养后培养液取样,提取质粒进行bamh i、xho i双酶切鉴定,对鉴定正确的质粒进一步进行测序鉴定,确保质粒重组正确,并最终对含有正确重组质粒的菌株保藏备用;
14、(3)将上述含有正确重组质粒的菌株接种至抗性(kana,50μg/ml)lb液体培养基中,37℃、180rpm扩大培养至od600=0.6-0.8左右时,加入终浓度0.5mm iptg,16-25℃培养18-20h以诱导表达蛋白;
15、(4)诱导表达完成后,对发酵液进行离心处理(8000rpm离心10min),收集菌体;将菌体沉淀用50mm磷酸氢二钠柠檬酸缓冲液(ph5.5)洗涤2~3遍(以去除菌体表面附着残留的培养基);
16、清洗干净后,按每克菌体沉淀加入10-15ml的比例量,加入结合-洗涤缓冲液(500mm nacl,50mm tris,20mm咪唑,ph 7.0)重悬菌体沉淀,重悬后置于冰水(1:1比例)中预冷处理后,超声破碎菌体细胞(超声功率350w,超声4s,停歇5s,处理时间15min);破碎完成后,对破碎后混合物进行离心处理(4℃、12000rpm离心10min),留上清,上清液即为粗酶液;
17、进一步地,可利用0.22μm水系滤膜对上清液进行过滤处理,以减少杂质及提高后续蛋白纯化的效率;
18、(5)采用ni-nta柱对步骤(4)所得上清液进行进一步纯化提纯,具体操作参考为:
19、先用超纯水冲洗3-5柱体积(以去除填料保护液中的乙醇),随后加入3-5柱体积的结合-洗涤缓冲液(500mm nacl,50mm tris,20mm咪唑,ph 7.0)以平衡柱子(ni-nta柱);平衡完成后,将上清液加入亲和层析柱(ni-nta柱)内,冰上静置不少于30min(期间每隔10min左右摇晃一次,以确保目的蛋白充分与填料接触和结合);
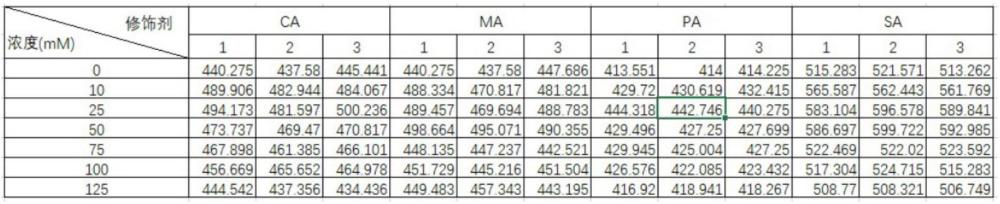
20、静置结束后:
21、先用3-5柱体积结合-洗涤缓冲液(500mm nacl,50mm tris,20mm咪唑,ph 7.0)洗脱与ni-nta填料弱结合的杂蛋白并收集流穿液;
22、再用3-5柱体积洗脱缓冲液(500mm nacl,50mm tris,500mm咪唑,ph 7.0)洗脱柱上的组氨酸标签蛋白并收集洗脱液;
23、最后用超滤管(30kda截留分子量)对收集的洗脱液进行超滤浓缩,所得即为纯化的蔗糖异构酶;
24、(二)化学修饰
25、利用化学修饰剂对步骤(一)所得蔗糖异构酶进行化学修饰;
26、所述化学修饰剂为含有羧基的酸酐,化学修饰过程中,化学修饰剂与蔗糖异构酶lys残基末端的ε-nh2进行偶联,生成酰胺键;
27、所述化学修饰剂具体例如为:邻苯二甲酸酐(pa)、马来酸酐(ma)、琥珀酸酐(sa)、或柠康酸酐(ca);
28、具体化学修饰操作过程为:
29、首先,取100μl、10mm化学修饰剂溶液与1ml、0.1mg/ml步骤(一)所制备的蔗糖异构酶纯酶,混合均匀后,4℃、反应3~5h(优选的,反应期间采用磁力搅拌方式以助于反应充分);
30、随后,4℃条件下,用50mmol/l的磷酸缓冲液(ph=7.5)对上述反应液进行透析过夜,得到化学修饰后的蔗糖异构酶。
31、所述蔗糖异构酶在异麦芽酮糖制备中的应用。
32、现有技术中,为提高生物酶分子稳定性和催化效率,其主要改造策略是从酶分子本身和对酶反应环境条件两个方面进行改造。对酶分子本身进行改造,主要是对特定位点氨基进行定点突变、化学修饰等改造,这种改造的根本目的在于对酶分子空间构象进行调节,以更好的与反应底物进行结合反应。
33、化学修饰改造虽然是提高和改善酶催化性能的有效方法,但因为这种修饰改造方法缺乏一定专一性,因此,实际应用时,必须统筹考虑生物酶分子原有构象、氨基残基基团及侧链分布特点等因素。本技术中,结合蔗糖异构酶空间结构分析,发明人利用含有羧基的酸酐类化学剂对其进行了化学修饰改造。初步实验结果表明,经过化学修饰改造后,改造后的生物酶对底物亲和力有明显增加,有利于后续的转化应用,表现出较好的应用前景,同时,也对其他生物酶的化学修饰改造提供了较好的科研借鉴。
- 还没有人留言评论。精彩留言会获得点赞!