一种循环肿瘤细胞建库过程中的培养方法和循环肿瘤细胞的建库方法
本发明涉及细胞组织库构建的,具体涉及一种循环肿瘤细胞建库过程中的培养方法和循环肿瘤细胞的建库方法。
背景技术:
1、循环肿瘤细胞(circulating tumor cells,简称ctcs)是指从原发肿瘤或转移性病灶中脱落并进入外周血液循环的肿瘤细胞。这些细胞有可能通过血液循环到达身体其他部位,并在那里形成新的肿瘤,即转移灶。ctcs的数量极少,循环肿瘤细胞在血液中含量极少,约每10毫升血液含有1-10个循环肿瘤细胞,甚至在每107个血液细胞中仅含有1个循环肿瘤细胞。ctcs的重要性在于它们与肿瘤的进展和预后密切相关。能够成功进入血液循环并存活下来的ctcs往往具有高度的活力和转移潜能。由于这些特性,ctcs成为了研究肿瘤生物学和开发新型诊断工具的重点对象之一。ctcs的捕获和分析有助于理解肿瘤的异质性、转移机制以及耐药性的发展,为开发新型治疗方法提供信息。由于ctcs的数量非常稀少,通常每毫升血液中只有几个至几十个,因此其检测是一项技术挑战,但同时也为临床提供了宝贵的液体活检(liquid biopsy)手段,即无需侵入性地获取组织样本即可获得有关肿瘤的信息。通过构建文库,进行基因表达分析或者基因组变异分析,可揭示细胞的异质性和复杂性。
2、然而,目前循环肿瘤细胞的大批量全长建库并测序目前还处于较为不成熟的阶段,可以被捕获并且成功建库测序的循环肿瘤细胞比较少,同时也存在如下问题:(1)目前,研究人员一般通过微流控装置对血液中的循环肿瘤细胞进行阴性或者阳性筛选,筛选后利用流式细胞仪等设备将细胞分选并进行后续实验。阳性筛选一般是选用epcam阳性对循环肿瘤细胞进行分选,但是大量文献研究表明,循环肿瘤细胞异质性较大,部分循环肿瘤细胞并没有epcam阳性,这导致在分选过程中会出现循环肿瘤细胞的丢失,准确率低,无法解决epcam阳性识别逃逸问题。阴性筛选则会导致有较多白细胞等其他细胞参与干扰,筛选难度大,后续如何高效快速的将分选出的细胞分开并进行培养和建库仍然是难点。(2)目前大多数研究是在循环肿瘤细胞刚刚从血液中被分选出来后立即进行监测和建库实验,此时循环肿瘤细胞在分选过程中遭受重创甚至导致其rna降解,此时测序无法反应循环肿瘤细胞的真实状态。然而本领域技术人员往往并未意识到循环肿瘤细胞测序时机对测序结果的影响,而即便意识到该问题也因分选出来的ctcs的状态极差和难以存活而不得不在获得ctcs后立即进行相关实验。
技术实现思路
1、(一)要解决的技术问题
2、鉴于现有技术的上述缺点、不足,本发明提供一种循环肿瘤细胞建库过程中的培养方法和循环肿瘤细胞的建库方法;一方面,本发明提供了一种ctcs的培养方法,可在体外对循环肿瘤细胞进行培养,使分选出来的ctcs能够在进行一段时间的状态恢复甚至增殖后再进行检测,使检测结果更能反应ctcs的真实状态并获取更多的检测样本;另一方面,本发明进一步优化了ctcs的分选及扩增后的样本纯化和片段化处理等过程,节省细胞挑选成本和提高分选精准度和成功率,提高样本纯度,使样本片段化更加均匀,提升后续测序的数据质量。
3、(二)技术方案
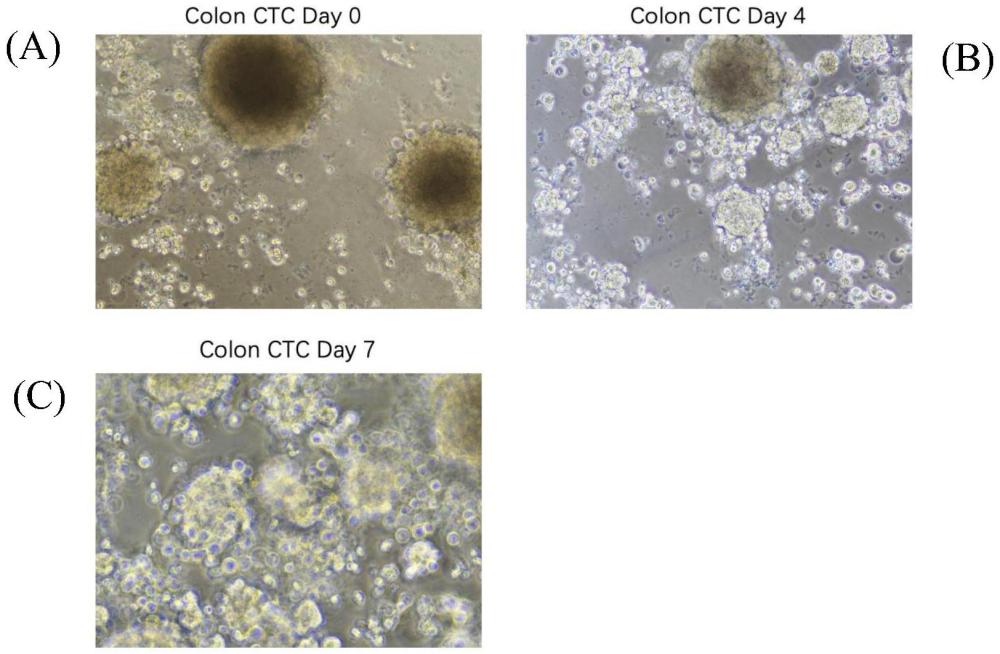
4、第一方面,本发明提供一种循环肿瘤细胞建库过程中的培养方法,其包括:将分选得到的循环肿瘤细胞置于缺氧培养箱中进行培养,氧气浓度控制在4-5%;培养温度为37±0.5℃,培养液采用基础培养基中添加神经生长因子fgf、表皮生长因子egf、b27补充剂、l-谷氨酰胺和抗生素/抗真菌剂的双抗组合物;基础培养基为rpmi 1640培养基;培养时间为3-10天,培养期间持续观察细胞的生长情况,一旦细胞出现衰老,立即将细胞挑取出来进行建库操作。
5、根据本发明较佳实施例,抗生素/抗真菌剂的双抗组合物为青霉素/链霉素或两性霉素b。
6、根据本发明较佳实施例,所述培养液的制备方法为:向每500ml的rpmi 1640培养基中加入4-6ml的l-谷氨酰胺、9-12ml的b27补充剂、2.5-3μg的fgf,2.5-3μg的egf,10ml-12ml的双抗组合物。
7、根据本发明较佳实施例,判断细胞衰老的方法为:出现细胞核颜色加深或细胞形态发生变形,即表示细胞开始衰老。此时将细胞挑取出来,保证细胞处于生长较好状态,有较多rna进行转录组建库。
8、第二方面,本发明提供一种循环肿瘤细胞的建库方法,其包括:从血液中分选循环肿瘤细胞,体外培养、单细胞挑选、建库和测序;所述体外培养采用上述任一实施例中所记载的培养方法。经过体外培养,使从血液中分选出来的循环肿瘤细胞得以状态恢复和细胞增殖,一方面减少循环肿瘤细胞rna的降解情况,另一方面可能会使循环肿瘤细胞的数量增多,便于获得更多细胞样本。
9、根据本发明的较佳实施例,采用细胞淘析机从血液中分选循环肿瘤细胞。
10、根据本发明的较佳实施例,所述单细胞挑选是对经过体外培养的循环肿瘤细胞,采用玻璃针管进行手动挑取;具体操作为:以酒精消毒过的毛细管为原材料,加热变软后拉制得到管中心为0.2mm±0.05mm的玻璃针管;提前将液氮到入保温杯,在10×镜下从培养液中挑选直径约20μm±2μm的细胞,将玻璃针管插入口吸管的接头处,利用口吸管提供负压,吸取细胞及1-2μl培养液,将细胞转移到玻璃针管内后将细胞吹到含有3μl裂解液的离心管中,离心管放入装液氮的保温杯,保存于-80℃冰箱。
11、根据本发明的较佳实施例,所述建库和测序的过程包括如下步骤:
12、(1)裂解和反转录:将盛装细胞和裂解液的离心管置于加热条件下裂解,得到细胞裂解液,配制反转录液,将反转录液与细胞裂解液混合,在热循环仪中孵化;
13、裂解液中加入寡核苷酸smartseq3_oli godt30vn的序列为/5biosg/acgagcatcagcagcatacgatttttttttttttttttttttt t tttttttvn;反转录液中加入寡核苷酸smartseq3_n 8_tso的序列为/5biosg/agagacagattgcgcaat gnnnnnnnnrgrgrg;
14、(2)预扩增:
15、配制预扩增体系,将预扩增体系加到步骤(1)处理的离心管中,混匀后将离心管放入热循环仪中进行预扩增;正向扩增引物fwd为tcgtcggcagcgtcagatgtgtataagagacagattgcgcaa*t*g;反向扩增引物rev为acgagcatcagcagcatac*g*a;
16、(3)纯化:预扩增结束后,向预扩增样本的离心管中加入超纯水稀释,再加入dna纯化磁珠,dna纯化磁珠的加入体积与加入前离心管内液体的体积比为35:50,用超纯水洗脱cdna;
17、(4)cdna质量检查:利用qubit dsdna hs检测试剂盒检测cdna文库质量,使用标准卡夹测量dna片段大小,保留片段大小900-1100kb的片段;
18、(5)cdna片段化:按照每1ng的cdna加入1μl amplicon tagmentation mix(tn5)的比例得到片段化混合液,放置到恒温金属浴中55℃处理5min;然后室温下加入0.2%的sds,放置恒温金属浴中55℃处理5min;
19、(6)纯化:向步骤(5)的混合液中,按样本总体积62.5:50的体积比例加入dna纯化磁珠进行纯化处理,随后用超纯水洗脱dna;
20、(7)样本扩增:使用步骤(6)获得的dna与nextera index引物配制样本扩增体系,在热循环仪中孵育样本;
21、(8)纯化:按0.8:1的体积比例加入dna纯化磁珠,最后用超纯水洗脱样本,利用qubit dsdna hs检测试剂盒检测cdna文库质量,用标准卡夹(c105101)测量cdna片段大小,保留分布300-500kb的片段;
22、(9)在illumina兼容的测序仪上测序并整理数据。
23、(三)有益效果
24、(1)本发明设计了适合循环肿瘤细胞生长的培养条件和培养液,使分选出来的循环肿瘤细胞先短暂培养一段时间,使循环肿瘤细胞的状态得到恢复,减少rna的降解程度,恢复细胞活力,之后再进行裂解、反转录、扩增和测序等处理,有利于获得更准确的循环肿瘤细胞检测数据;对于一些恶性程度较高的循环肿瘤细胞,经过培养后还能使细胞数量增加,增加可用的样本数量。
25、(2)本发明采用细胞淘析机分选和培养后采用玻璃针管进行手动挑取,对循环肿瘤细胞的甄别主要依赖于人力手动挑取获得,相比现有技术采用epcam阳性分选的技术,不仅成本低且准确率高、不易出现循环肿瘤细胞的丢失等问题,也不会出现阴性筛选导致的有大量白细胞等干扰的问题。由于循环肿瘤细胞的数量极少,国际标准上循环肿瘤细胞也是10ml有7个左右,因此手动挑取并不会增加过多劳动成本,相较于现有技术可显著降低成本并提高循环肿瘤细胞获取的成功率。
26、(3)相较于现有的smartseq3实验方案,本发明进一步优化了样本纯化的操作和条件,优化dna片段化的混合液体系,提高最终获得的dna纯度,使dna片段更均匀,提升了后续测序的效率和数据质量。
- 还没有人留言评论。精彩留言会获得点赞!