RPA-CRISPR/Cas12a引物组、gRNA和探针、试剂盒和检测体系
本发明涉及生物领域,具体为一种检测胞内劳森菌的rpa-crispr/cas12a引物组、grna和探针、试剂盒和检测体系。
背景技术:
1、胞内劳森菌(lawsonia intraculularis,li)是引起的猪增生性肠病(porcineproliferative enteritis,ppe)的肠道病原菌,主要定植于回肠末端,猪发病严重时也可感染空肠和结肠,细菌多呈小弯曲杆菌,革兰氏染色阴性,抗酸染色阳性。li感染引起的猪细菌性传染病,该病的传播能力极强,在猪场内出现患病猪后可导致大量猪被感染,发病猪食欲下降、生长发育迟缓、料肉比重下降,严重威胁着世界养猪业的健康发展。
2、目前现有的检测li的方法均存在一定的局限性,如吉姆萨染色、革兰染色并镜检,这些方法仅可用于li的前期鉴定;组织病理切片和免疫组化多用于猪死后的检测;pcr方法可以直接检测病原核酸,确定猪是否感染li,但在一些慢性或亚临床病例中存在间歇性排菌现象,采样时间不同,pcr检测的阳性率也不同,易造成检测结果假阴性;酶联免疫吸附试验(elisa)干扰因素较多,对温度和时间的把控均可能影响实验结果,导致出现假阳性;ipma和ifa是检测li抗体的最特异性的方法,但这两种方法均需要体外培养li感染的细胞,而常规方法培养li困难,且目前国内尚未见到成功分离培养li的报道,这也成为li的检测中的一大难点。而本研究所建立的rpa-crispr/cas12a检测方法,相较于目前现有的检测方法,其检出限低、检测准确性高、操作简单、无需昂贵设备、应用场景多样,为li快速检测及流行病学调查提供了一种切实可行的技术手段。
3、重组酶聚合酶等温扩增技术(recombinase polymerase amplification,rpa)是一种高度敏感的等温扩增技术,通过重组酶、聚合酶、单链结合蛋白、引物对靶标进行指数扩增,其反应条件为37℃-42℃,约15~30分钟就能得到可检测的扩增产物。因rpa反应条件温和、扩增效率高,设备简单,近几年在被广泛应用于病原菌的检测,这也给现场检测提供新的选择,被称为是可以替代pcr的核酸检测技术。
4、crispr/cas系统,全名为常间回文重复序列丛集/常间回文重复序列丛集关联蛋白系统(clustered regularly interspaced palindromic repeats/crispr-associatedproteins),是第三代基因组编辑工具,来源于细菌或古细菌获得性免疫,由rna指导cas蛋白对靶向序列进行修饰的技术。crispr/cas系统由四部分组成,分别为crispr簇、前导序列、重复序列、以及一系列保守的crispr相关基因。与其他的cas蛋白相比,cas12a的靶标dna不再局限于双链dna(dsdna),也可高效切割单链dna(ssdna)。根据这一特性,cas12a被应用到病原检测中,被检测体系中主要包含三部分:靶标序列、cas12a-sgrna复合物、荧光报告子,其中荧光报告分子两端为荧光基团和猝灭基团,由单链dna连接,此时猝灭基团能够抑制荧光基团发光,体系观察不到荧光。而当sgrna识别到靶标序列时,能够激活cas12a的反式切割活性,cas12a蛋白开始对其周围的dna进行非特异性切割,其中就包括荧光报告子。连接荧光报告子的单链dna被切割后,猝灭基团将无法抑制荧光基团发光,此时可观察到体系产生荧光,由此来鉴别体系中是否有待检测的靶标序列。
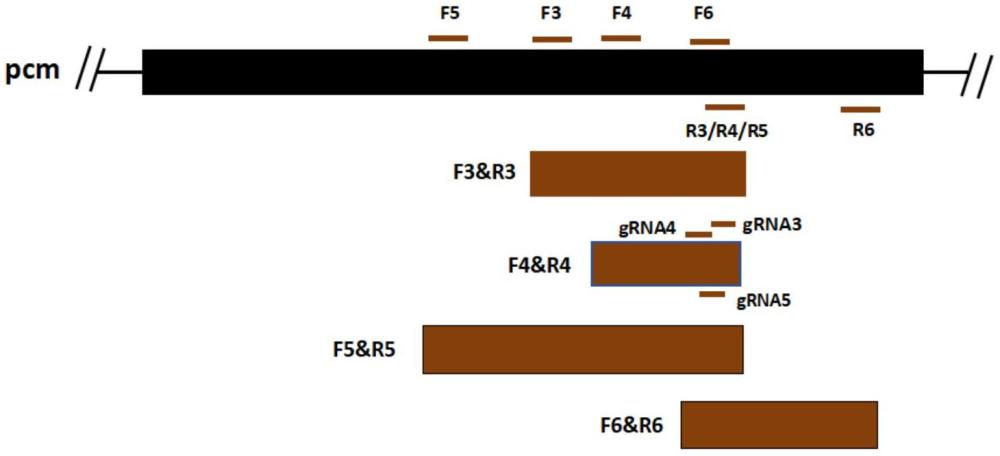
5、rpa-crispr/cas12a快速检测方法在进行引物、探针、crrna设计时,存在很大的难度,最核心的难点在于位点的选择、crrna和rpa引物组的设计。
6、1.保守位点的不同,会导致检测结果差异性巨大;这种差异性在普通pcr检测中并不会体现,因为普通pcr技术只要扩增出相应的序列,一般来说都是可以得到对应的检测结果和符合需求的灵敏度;但是rpa-crispr/cas12a技术涉及靶标序列与crrna、cas12a形成三元复合物,cas12a蛋白非特异性切割活性在靶标序列与crrna、cas12a形成三元复合物时被激活,从而对体系中的试纸条探针及荧光探针进行切割,产生荧光信号或试纸条检测线显现;这不仅仅对于引物扩增的效率、crrna的特异性提出了要求,对于位点的选择更为重中之重。
7、2.引物序列,引物用于扩展出保守位点所在序列,对于同一位点,采用不同的引物进行扩增,得到的序列即使略有区别,其可能最终的灵敏度、特异性都会产生明显的区别,这是由于目标序列和crrna、cas12a形成三元复合物进而影响切割和显示结果。
8、3.crrna,由于目标序列和crrna、cas12a形成三元复合物,在现有研究中发现,合适的crrna对于特异性、灵敏性是尤为重要的。
9、同时,与pcr技术不同的是,现有技术中并没有成熟的软件去设计
10、rpa-crispr/cas12a快速检测方法中的相关序列,需要研究人员根据长期研究摸索来得到相关序列;
11、综上,成功开发rpa-crispr/cas12a快速检测方法和体系是一件具有挑战性的事情。
技术实现思路
1、本发明的第一目的在于提供检测胞内劳森菌的rpa-crispr/cas12a引物组、grna和探针,其具有检出限低、检测准确性高的优点。
2、同时,本发明还公开了一种试剂盒以及胞内劳森菌的检测体系。
3、为实现上述第一目的,本发明提供如下技术方案:
4、一种检测胞内劳森菌的rpa-crispr/cas12a引物组、grna和探针,包括rpa引物组、grna和探针;
5、所述rpa引物组包括如seq id no.1所述的上游引物和下游引物;
6、grna的序列如seq id no.2所示;
7、所述探针的序列为5'-fam-ttatt-bhq1-3';
8、所述探针的5端和3端分别为荧光基团和淬灭基团。
9、如下表1所示:
10、表1胞内劳森菌rpa-crispr/cas12a检测引物、探针、grna设计
11、
12、本发明还公开了一种试剂盒,含有如上所述的检测胞内劳森菌的rpa-crispr/cas12a引物组、grna和探针。
13、同时,本发明还公开了一种检测胞内劳森菌的检测体系,包括扩增体系和crispr/cas12a反应体系;
14、所述扩增体系为:
15、浓度为10μmol/l的上游引物2.4μl;
16、浓度为10μmol/l的下游引物2.4μl;
17、primer free rehydration buffer 29.5μl;
18、去离子水11.2μl;
19、将上述物质混匀后加入冻干管内,吹打混匀,将其一分为二,
20、每管中加入1μl dna模板,混匀后每管中加入1.25μl浓度为280mmol/l的mgoac;
21、所述上游引物和下游引物的核苷酸序列如seq id no.1和seq id no.2所示;
22、所述crispr/cas12a反应体系为:
23、去离子水13μl
24、浓度为1μmol/l的cas12a酶1μl;
25、浓度为1μmol/l的grna 1μl;
26、10倍单位的neb buffer 2.1 2μl;
27、浓度为10μmol/l的ssdna报告分子1μl;
28、扩增体系扩增得到的核酸扩增产物2μl;
29、所述grna序列如seq id no.3所示。
30、本发明的有益效果如下:
31、本发明rpa-crispr/cas12a的体系对胞内劳森菌的检测具有较高的特异性,其具有检出限低、检测准确性高的优点。
- 还没有人留言评论。精彩留言会获得点赞!