一种氟苯尼考及其衍生物的合成方法与流程
本发明属于化学合成领域,具体涉及一种氟苯尼考的合成方法。
背景技术:
1、氟苯尼考是一种广泛使用的新一代氯霉素类兽用抗生素,具有吸收迅速、体内分布广泛,半衰期长,无再障副作用,不易产生耐药性,无残留,无交叉耐药性等优点,主要用于治疗牛、猪、鸡鸭、鱼等动物的细菌性疾病和支原体感染。近年来,全球对氟苯尼考的需求日益增加,目前其市场规模已超30亿元。
2、氟苯尼考结构式如下所示:
3、
4、目前国内较成熟的合成氟苯尼考的工艺路线,大多采用对甲砜苯甲醛路线(tobibiki hisao;ger offen,de2349496),均以氯霉素、甲砜霉素这些原料药或其相关中间体作为起始原料,经还原,保护,氟代,水解开环,酰化制得。其中涉及到对甲砜基苯甲醛与甘氨酸、硫酸铜反应制备铜盐后经酯化反应得到外消旋的d、l型丝氨酸乙酯,经酒石酸的拆分得到,其中一个异构体l型被废弃,使整个路线的成本增加,且制备铜盐时会产生大量的硫酸铜废水,废水处理成本非常高,使得企业因生产成本和环保压力处于临时关停状态。
5、随着不对称化学的发展,各种手性催化剂开始应用于氟苯尼考的合成。美国的jone.clark等人采用酶催化的方法进行了该类反应的研究,后来feng li等人采用不对称合成的方法合成中间体噁唑啉,然后再经水解、二氯乙酰化反应制得。该工艺路线存在收率低、流程较长的缺点,很难应用于工业化生产(tetrahedron:asymmetry22(2011)1337-1341)。
6、目前,国内各厂家的氟苯尼考生产工艺路线比较一致,均以(2s,3r)-对甲砜基苯丝氨酸乙酯(d-乙酯)为原料,通过还原、与苄腈反应制备噁唑啉、ishikawa试剂作用下氟化、水解以及二氯乙酰化等得到氟苯尼考原料药。
7、
8、在氟化反应步骤需要使用当量的ishikawa试剂,这类试剂氟原子利用率比较低,成本比较高;由于ishikawa试剂的稳定性原因,工厂生产通常采用现制现用的方法,该试剂的生产过程需要超低温、高压、高温等条件,增加了能耗和安全风险;另外在反应后会形成大量n,n-二乙基-2,3,3,3-四氟丙酰胺,其回收套用难度较高,在环保及生产成本层面具有较大压力。
9、目前,d-乙酯作为生产氟苯尼考的关键中间体,使用成本较高,国内外规模化生产d-乙酯的主要方法是化学合成法和生物酶催化法两种工艺,其中化学合成法是以对甲砜基苯甲醛和甘氨酸为原料,通过缩合、酯化和拆分得到(2s,3r)-对甲砜基苯丝氨酸。生物酶催化法制备(2s,3r)-对甲砜基苯丝氨酸主要有2种路线,其中一条路线是利用l-苏氨酸醛缩酶催化对甲砜基苯甲醛和甘氨酸的缩合反应,另一条路线,即以对甲砜基苯甲醛和l-苏氨酸为原料,通过全细胞或者生物酶催化反应合成(2s,3r)-对甲砜基苯丝氨酸。
10、综上所述,现有的氟苯尼考生产路线存在生产成本高,还会产生大量难以处理的废水,因此寻找产率高,其他废物少的工业化生产路线是很有价值的。现有技术中,制备氟苯尼考的方法往往整体产率不足,或者虽然产率较高,但是操作过程过于繁琐,注定其无法用于大规模生产。
11、随着这几年食品安全的整治,国际动保市场,氟苯尼考的用量不断扩大。因此,开发氟苯尼考新的合成工艺方法以降低生产成本,对环境友好和绿色安全生产具有十分重要的经济意义和社会意义。
技术实现思路
1、针对现有技术存在的不足,本发明提供了一种全新的氟苯尼考及其衍生物的合成方法,采用酶化学级联合成路线,共需要三步,从对甲砜基苯甲醛直接合成氟苯尼考及其衍生物,从而降低成本,简化工艺,易于工业放大。
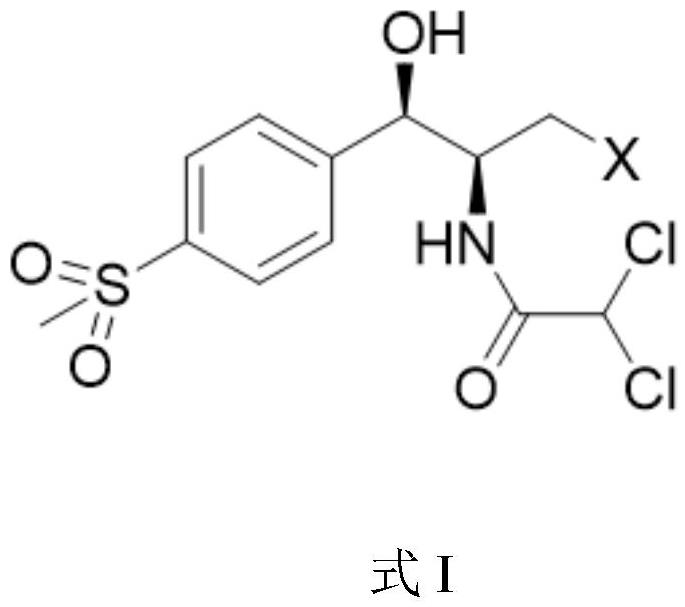
2、本发明中所述氟苯尼考及其衍生物的结构式如式i所示:
3、
4、式i中,x选自ch3、oh、f、cl、br或i。
5、当x为f时,式i所示化合物为氟苯尼考。
6、本发明采用的技术方案如下:
7、一种氟苯尼考及其衍生物的合成方法,包括下述步骤:
8、1)使化合物1(对甲砜基苯甲醛)和化合物2在丙酮酸脱羧酶或表达丙酮酸脱羧酶的大肠杆菌全细胞的作用下反应,得到化合物3;
9、
10、其中,化合物2中x的定义同式i;化合物3中x的定义同式i;
11、2)使化合物3与胺类物质在氨基转移酶或表达氨基转移酶的大肠杆菌全细胞的作用下反应,得到化合物4;
12、
13、其中,化合物4中x的定义同式i;
14、3)使化合物4与二氯乙酸甲酯进行酰胺化反应,得到式i所示的化合物。
15、上述方法步骤1)中,所述丙酮酸脱羧酶为丙酮酸脱羧酶e1;所述表达丙酮酸脱羧酶的大肠杆菌全细胞为大肠杆菌全细胞e1。
16、进一步地,所述丙酮酸脱羧酶来自于bacillus megateriu。
17、在本发明的实施例中,所述丙酮酸脱羧酶e1的氨基酸序列为seq id no:1。
18、进一步地,所述丙酮酸脱羧酶以粗酶液的形式加入,所述化合物1、所述化合物2和所述丙酮酸脱羧酶粗酶液的用量配比为10mmol:(40-60)mmol:(60-90)ml;具体如10mmol:50mmol:80ml。
19、更进一步地,所述丙酮酸脱羧酶粗酶液按照如下步骤制备:od值为12-16的表达丙酮酸脱羧酶的重组菌经异丙基-β-d-硫代吡喃半乳糖苷(iptg)诱导18-22小时后收集菌体,再向所述菌体中按照菌体:pbs缓冲液的配比为1g:8-12ml的量加入所述pbs缓冲液,破碎,收集破碎产物的上清液,得到粗酶液;
20、所述表达丙酮酸脱羧酶的重组菌为将所述丙酮酸脱羧酶的编码基因导入大肠杆菌得到的重组菌。
21、根据本发明的一个实施例,丙酮酸脱羧酶粗酶液按照如下步骤制备:od值为15的表达丙酮酸脱羧酶的重组菌经iptg诱导20小时后收集菌体,再向所述菌体中按照菌体:缓冲液的配比为1g:10ml的量加入所述缓冲液,破碎,收集破碎产物的上清液,得到丙酮酸脱羧酶e1粗酶液;
22、所述表达丙酮酸脱羧酶的重组菌为将所述丙酮酸脱羧酶的编码基因通过质粒pet28a-e1导入大肠杆菌得到的重组菌;
23、所述iptg诱导的温度为30℃;
24、所述iptg诱导的浓度为0.5mm;
25、所述收集的菌体为6000rpm离心15min取沉淀;
26、所述缓冲液为50mm、ph 8.0的pbs缓冲液。
27、所述破碎为高压均质破碎。
28、所述收集破碎产物的上清液为将破碎产物13000rpm离心60min,取上清液,再经过0.45μm膜过滤,获得粗酶液。
29、进一步地,所述步骤1)中,所述化合物1、所述化合物2和表达丙酮酸脱羧酶的大肠杆菌全细胞的用量配比为10mmol:(40-60)mmol:20-35g;
30、所述表达丙酮酸脱羧酶的大肠杆菌全细胞为所述表达丙酮酸脱羧酶的重组菌经iptg诱导18-22小时后收集的菌体。
31、根据本发明的一个实施例,所述表达丙酮酸脱羧酶的大肠杆菌全细胞按照如下步骤制备:od值为15的表达丙酮酸脱羧酶的重组菌经iptg诱导20小时后收集菌体,得到表达丙酮酸脱羧酶的大肠杆菌e1全细胞。
32、所述iptg诱导的温度为30℃。
33、所述iptg诱导的浓度为0.5mm。
34、所述收集的菌体为6000rpm离心15min取沉淀。
35、上述方法步骤1)中,所述反应过程中,还加入mgcl2,thdp(焦磷酸硫胺素),fad(黄素腺嘌呤二核苷酸),dmso。
36、根据本发明的实施例,化合物1、mgcl2,thdp(焦磷酸硫胺素),fad(黄素腺嘌呤二核苷酸),dmso的投料比依次为10mmol:5mmol:0.1mmol:0.05mmol:125ml。
37、上述方法步骤1)中,所述反应在hepes缓冲液中进行。所述hepes缓冲液具体可为100mm ph 7.5的hepes缓冲液。
38、上述方法步骤1)中,所述反应的反应条件为:25-35℃,搅拌反应18-22小时,搅拌速度可为220-260rpm。
39、上述步骤1)反应结束后,无需分离纯化得到的化合物3,可直接在同一反应器中进行步骤2)的反应。即步骤1)和步骤2)的反应采用一锅法制备。
40、上述方法步骤2)中,所述氨基转移酶为氨基转移酶e2;所述表达所述氨基转移酶的大肠杆菌全细胞为大肠杆菌全细胞e2。
41、进一步地,所述氨基转移酶来自于paludibacterium sp.。
42、在本发明的实施例中,所述氨基转移酶e2的氨基酸序列为seq id no:2。
43、进一步地,所述氨基转移酶以粗酶液的形式加入,所述化合物3、胺类物质和所述氨基转移酶粗酶液的用量配比为10mmol:(100-200)mmol:(60-90)ml;具体如10mmol:100mmol:50ml。
44、更进一步地,所述氨基转移酶粗酶液按照如下步骤制备:od值为12-16的表达氨基转移酶的重组菌经异丙基-β-d-硫代吡喃半乳糖苷(iptg)诱导18-22小时后收集菌体,再向所述菌体中按照菌体:pbs缓冲液的配比为1g:8-12ml的量加入所述pbs缓冲液,破碎,收集破碎产物的上清液,得到粗酶液;
45、所述表达氨基转移酶的重组菌为将所述氨基转移酶的编码基因导入大肠杆菌得到的重组菌。
46、根据本发明的一个实施例,氨基转移酶粗酶液按照如下步骤制备:od值为15的表达氨基转移酶的重组菌经iptg诱导20小时后收集菌体,再向所述菌体中按照菌体:缓冲液的配比为1g:10ml的量加入所述缓冲液,破碎,收集破碎产物的上清液,得到氨基转移酶e2粗酶液;
47、所述表达氨基转移酶的重组菌为将所述氨基转移酶的编码基因通过质粒pet28a-e2导入大肠杆菌得到的重组菌;
48、所述iptg诱导的温度为30℃;
49、所述iptg诱导的浓度为0.5mm;
50、所述收集的菌体为6000rpm离心15min取沉淀;
51、所述缓冲液为50mm、ph 8.0的pbs缓冲液。
52、所述破碎为高压均质破碎。
53、所述收集破碎产物的上清液为将破碎产物13000rpm离心60min,取上清液,再经过0.4μm膜过滤,获得粗酶液。
54、进一步地,所述步骤2)中,所述化合物3、胺类物质和表达氨基转移酶的大肠杆菌全细胞的用量配比为10mmol:(100-200)mmol:15-25g;
55、所述表达氨基转移酶的大肠杆菌全细胞为所述表达氨基转移酶的重组菌经iptg诱导18-22小时后收集的菌体。
56、根据本发明的一个实施例,所述表达氨基转移酶的大肠杆菌全细胞按照如下步骤制备:od值为15的表达氨基转移酶的重组菌经iptg诱导20小时后收集菌体,得到表达氨基转移酶的大肠杆菌e2全细胞。
57、所述iptg诱导的温度为30℃。
58、所述iptg诱导的浓度为0.5mm。
59、所述收集的菌体为6000rpm离心15min取沉淀。
60、上述方法步骤2)中,所述胺类物质作为氨基供体,选自下述至少一种:异丙胺、α-甲基丙氨,1-甲基-3-苯基丙胺,1-氨基茚满,苄胺,2-庚胺,1,5-二甲基己胺,2-氨基丁烷,氨基丁酸,l-丙氨酸等。
61、上述方法步骤2)中,所述反应过程中,还加入磷酸吡哆醛(plp)作为辅酶。
62、所述对甲砜基苯甲醛与磷酸吡哆醛(plp)的用量配比为10mmol:0.1-0.3mmol。
63、上述方法步骤2)中,所述反应的反应条件为:25-35℃,搅拌反应20-35小时,搅拌速度可为150-250rpm。
64、上述方法步骤3)中,所述化合物4与二氯乙酸甲酯的初始摩尔比为1:(3-6),具体如1:5。
65、上述方法步骤3)中,所述酰胺化反应在碱存在下进行,所述碱可选自三乙胺(tea)或二异丙基乙胺。
66、进一步地,所述化合物4与所述碱的投料摩尔比为1:(1-1.5),具体如1:1
67、上述方法步骤3)中,所述酰胺化反应在溶剂中进行,所述溶剂可选自甲醇或thf。
68、上述方法步骤3)中,所述酰胺化反应的反应条件为:室温(25-33℃)搅拌反应22-26小时,具体反应条件可为:室温搅拌反应24小时。
69、与现有技术相比,本发明具有如下有益效果:
70、本发明开创性地提供一种新的酶化学级联合成路线合成氟苯尼考及其衍生物,整个路线仅需要三步。跟目前应用的从d-乙酯再合成氟苯尼考及其衍生物的路线相比,显著降低了氟苯尼考生产成本,简化了合成工艺,同时也使得其更符合当今绿色工业生产的需求。
- 还没有人留言评论。精彩留言会获得点赞!