一种检测抗生物素蛋白的比率型荧光探针及其合成方法和应用与流程
本发明涉及一种用于比率检测抗生物素蛋白的荧光探针的合成及应用。
背景技术:
蛋白质是生命科学研究的主要内容之一,其是细胞和生物功能的重要体现者。各种蛋白的表达都与人的正常生理生命活动息息相关。因而,对于蛋白的检测、功能的研究、实时的追踪显得极其重要。现在对蛋白质的检测主要有凯氏定氮法、双缩脲法、紫外吸收法、考马斯亮蓝法、酚试剂法等,这些方法较为繁琐、费时、需大量前期准备。因此,荧光检测技术因为其高灵敏度、操作简便、快速响应等优势逐渐被成功应用于蛋白的检测与功能研究中。
近年来,基于小分子荧光探针的蛋白检测方法逐渐受到生物研究工作者的重视,其能够在蛋白结构与功能研究以及检测中起到至关重要作用。小分子荧光探针与蛋白结合后的荧光变化能够将蛋白微观的变化以荧光这种宏观形式展现给研究工作者,借助生物荧光成像等系统可以观测到实时动态的变化。然而,现在对于大多检测、标记蛋白的荧光探针来说,其局限于单一的荧光增强并伴有蓝移,其受到设备、样品等外界因素影响较大。而能够克服此类缺点的检测蛋白的比率型荧光探针较为少见。
生物素是动、植物体内广泛存在的一种小分子生长因子,又叫维生素H。其能与抗生物素蛋白(亲和素)特异性结合,且二者亲和力比抗原-抗体结合力高出百万倍。因此,生物素-亲和素系统因为其高亲和力、高稳定性、高灵敏度、高特异性等优点被广泛应用于分子生物学、免疫学等领域。
技术实现要素:
本发明的目的之一是提供种用于比率检测抗生物素蛋白的荧光探针,该探针能够与抗生物素蛋白特异性结合并进行比率的识别。
本发明的另一目的是提供一类用于比率检测抗生物素蛋白的荧光探针的合成方法,该方法具有原料低廉、简单、易提纯等优点。
本发明提供一种用于检测抗生物素蛋白的比率型荧光探针,以1,8-萘酰亚胺为荧光基团,2-(N,N-二乙基氨基)乙酰基)氨基为响应基团,生物素为靶向基团,该荧光探针能够与抗生物素蛋白特异性结合。当向探针测试液中加入抗生物素蛋白后,~470nm的荧光峰逐渐降低而~550nm处荧光峰逐渐增强,该荧光探针具有如下结构:
一种检测抗生物素蛋白的比率型荧光探针的合成路线,如下:
合成的具体步骤如下:
(1)中间体N-Boc-乙二胺的合成:
将二碳酸二叔丁酯溶于二氯甲烷中,并在冰浴下滴加乙二胺。室温下搅拌过夜(10-16h),饱和食盐水洗涤,并加入无水硫酸钠干燥,过滤得澄清溶液,旋干得N-Boc-乙二胺无色油状物。
(2)中间体N-Boc-N-生物素乙二胺的合成:
将EDC.HCl,HOBt.H2O,三乙胺,生物素溶于DMF中,并向其中加入N-Boc-乙二胺,室温搅拌18-20h,减压除去溶剂,硅胶柱分离得N-Boc-N-生物素乙二胺白色固体。
(3)探针的合成:
将N-Boc-N-生物素乙二胺溶于二氯甲烷中,加入三氟乙酸,室温下搅拌0.5-2h,减压除去溶剂,残留物溶于乙醇中,并加入4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐,加热至80-90℃,3-6h,旋干,硅胶柱分离得到淡黄色固体。
步骤(2)中所述EDC.HCl、HOBt.H2O、三乙胺、生物素、DMF、N-Boc-乙二胺,其质量比为1:1:1.5:1:80:1-1:2:2:100:2。硅胶柱分离,200-300目硅胶,洗脱剂为二氯甲烷:甲醇=100:1~50:1,分离后需经减压除去溶剂得N-Boc-N-生物素乙二胺。
步骤(3)中所述N-Boc-N-生物素乙二胺、二氯甲烷、三氟乙酸、乙醇、4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐,其质量比为1:150:30:200:1-1:200:100:600:1。硅胶柱分离,200-300目硅胶,洗脱剂为二氯甲烷:甲醇=50:1~20:1,分离后需经减压除去溶剂得淡黄色固体。
所述的检测抗生物素蛋白的比率型荧光探针在比率识别抗生物素蛋白、蛋白检测或在生物荧光成像中的应用。
本发明具有以下特征:
该类探针拥有合成方法操作简便、原料低廉、产物易纯化等优点。
该类探针在该探针在水溶液中呈现出~470nm的蓝色荧光,而在甲醇,二甲基亚砜,N,N-二甲基甲酰胺、乙醇等极性溶剂中呈现出~550nm的荧光。在水溶液与甲醇不同比例条件下,~470nm与550nm的荧光峰呈比率变化。
该荧光探针能够特异性与抗生物素蛋白结合,当向探针测试液中加入抗生物素蛋白后,~470nm的荧光峰逐渐降低而~550nm处荧光峰逐渐增强,从而达到比率检测抗生物素蛋白。其可用于蛋白检测、生物荧光成像领域等。
附图说明
图1本发明提供的荧光探针合成路线图。
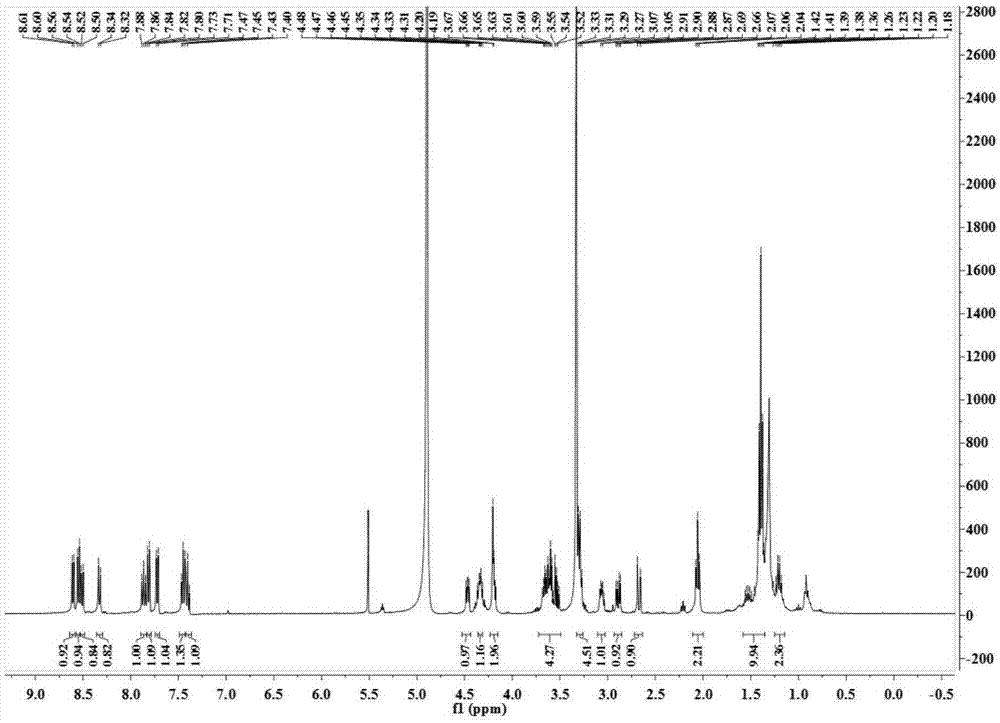
图2实施例1制备的荧光探针核磁谱图氢谱。
图3中荧光探针浓度为10μm,其在水与甲醇不同比例下荧光光谱图,横坐标为波长,纵坐标为荧光强度。
图4中荧光探针浓度为5μm,其在缓冲液中加入0-2.0当量抗生物素蛋白的荧光光谱变化,激发光为365nm,横坐标为波长,纵坐标为荧光强度。
图5中荧光探针浓度为5μm,其在缓冲液中加入0-2.0当量抗生物素蛋白的荧光光谱变化,激发光为405nm,横坐标为波长,纵坐标为荧光强度。
具体实施方式
实施例1:一种检测抗生物素蛋白的比率型荧光探针的合成方法。
(1)中间体N-Boc-乙二胺的合成:
将二碳酸二叔丁酯(1.2g,5.5mmol)溶于40mL二氯甲烷中,并在冰浴下滴加2.2mL(33mmol)乙二 胺。反应液在室温下搅拌过夜(10-16h),饱和食盐水洗涤三次,有机相用无水硫酸钠干燥,过滤得澄清溶液,旋干得无色油状物845mg,产率96%。1HNMR(400MHz,CDCl3)δ4.91(s,1H),3.20–3.14(m,2H),2.80(t,J=5.9Hz,2H),1.45(s,9H),1.41(s,2H)。
(2)中间体N-Boc-N-生物素乙二胺的合成:
将EDC.HCl(144mg,1.0mmol),HOBt.H2O(182mg,1.0mmol),三乙胺(350μL,2.1mmol),生物素(110mg,0.2mmol)溶于10mL DMF中,并向其中加入N-Boc-乙二胺(130mg,0.4mmol),室温搅拌20h,减压除去溶剂,硅胶柱分离,采用200-300目硅胶,洗脱剂为二氯甲烷:甲醇=100:1~50:1,分离后需经减压除去溶剂得白色固体64mg,产率52%。1HNMR(400MHz,MeOD)δ4.54–4.46(m,1H),4.33(dd,J=7.5,4.5Hz,1H),3.29–3.19(m,4H),3.16(t,J=5.8Hz,2H),2.95(dd,J=12.7,4.9Hz,1H),2.72(d,J=12.7Hz,1H),2.22(t,J=7.3Hz,2H),1.81–1.54(m,5H),1.45(s,9H),1.33(t,J=7.3Hz,2H)。
(3)探针的合成:
将N-Boc-N-生物素乙二胺(30mg,0.78mmol)溶于4mL二氯甲烷中,加入1mL三氟乙酸,室温下搅拌1h,减压除去溶剂,残留物溶于10mL乙醇中,并加入4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐(25mg,0.78mmol),加热至85℃,3h,旋干,硅胶柱分离,采用200-300目硅胶,洗脱剂为二氯甲烷:甲醇=100:1~50:1,分离后需经减压除去溶剂得淡黄色固体30mg,产率66%。1HNMR(400MHz,MeOD)δ8.60(d,J=7.2Hz,1H),8.55(d,J=8.1Hz,1H),8.51(d,J=8.5Hz,1H),8.33(d,J=8.1Hz,1H),7.91–7.83(m,1H),7.81(d,J=8.2Hz,1H),7.72(d,J=8.2Hz,1H),7.50–7.38(m,2H),4.47(dd,J=7.7,4.9Hz,1H),4.38–4.29(m,2H),4.20(d,J=4.1Hz,2H),3.69–3.49(m,4H),3.32–3.24(m,4H),3.12–3.02(m,1H),2.89(dd,J=12.8,4.9Hz,1H),2.67(d,J=12.7Hz,1H),2.06(t,J=7.3Hz,2H),1.58–1.35(m,10H),1.28–1.17(m,2H).。
将该探针溶于DMSO溶液中,配制成2mM母液;抗生物素蛋白溶于PBS缓冲液中配置成2mM的母液。根据不同比例配制成所需浓度,测试其荧光光谱变化。
实施例2:实施例1制备的荧光探针在水与甲醇不同比例下荧光响应情况。
图3中实施例1制备的荧光探针浓度为10μM,激发光为405nm,在水溶液中探针呈现出波长为~470nm的荧光,在甲醇呈现出波长为~550nm荧光,当甲醇比例逐渐增加时,波长为~550nm处的荧光强度逐渐增强,而波长为~470nm处荧光强度逐渐降低。
实施例3:实施例1制备的荧光探针对0-2.0当量抗生物素蛋白的响应。
图4中荧光探针浓度为5μM,激发光为365nm,取10.0μL探针母液溶于4mL PBS缓冲液(pH=7.4,20 mM),配制成荧光探针浓度为5μM的测试液。当测试液逐渐加入相对于探针0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0,1.5,2.0当量的抗生物素蛋白(0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,15.0,20.0μL)后,~470nm的荧光强度逐渐降低,而~550nm处荧光逐渐增加。
图5中荧光探针浓度为5μM,激发光为405nm,取10.0μL探针母液溶于4mL PBS缓冲液(pH=7.4,20mM),配制成荧光探针浓度为5μM的测试液。当测试液中逐渐加入0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0,1.5,2.0量抗生物素蛋白(0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,15.0,20.0μL)后,波长为~470nm处的荧光强度逐渐降低,而波长为~550nm处的荧光强度逐渐增加。
- 还没有人留言评论。精彩留言会获得点赞!