6‑丹磺酰胺‑吲哚类荧光探针及其制备方法与应用与流程
本发明属于化学分析检测技术领域,具体而言,涉及一种6-丹磺酰胺-吲哚类荧光探针及其制备方法与应用。
背景技术:
活细胞由于其本身存活的需求,细胞通过完整的细胞膜与外界进行隔离,从而形成细胞内稳定的生理环境,其中包括:ph值、营养成分、各种物质成分比。当细胞死亡的时候,尽管细胞死亡可以通过不同的方式,如凋亡、坏死和自噬等,而每种死亡形式都有特殊的信号通路启动和调控,但是细胞死亡过程都要伴随着细胞内环境的变化,并且都经历一个形态学的变化。总的来说,细胞死亡时形态变化主要包括细胞形状改变、细胞基质变得紧密、细胞核收缩和细胞膜破裂等。
区分活的与死的肿瘤细胞的生物医学意义非常重要。对于生物医学研究中,如何快速准确的检测出活细胞与死亡细胞对于很多生物医学研究必不可少的一项操作。例如,在药理评价中,简单而准确的检测细胞是死亡还是活得十分重要;或者在进行临床病理筛查是,如果能够快速的区分分离的肿瘤细胞是否是死亡或者活得的,这也非常重要。一个好的区分死亡细胞或活细胞的方法应该是经济、简便、快速、灵敏、精确和具有普适性。目前市场上的细胞活性的检测方法都不能满足上述所有要求。
根据检测的原理,细胞活性的检测方法主要可以分为两大类,其一为基于细胞活性(生化酶学活性)的分析检测,比如mtt和alamarblue等。这类方法目前应用比较广泛,但具有一定的局限性。这类检测细胞活性的方法可能会受到筛选化学试剂的影响。例如,mtt化合物的环状结构可以被具有还原活性的化合物给打开,造成检测的假阳性;有些生化检测方法仅局限于检测某种特定的细胞死亡方式,如检测caspase-3的活性来确定细胞凋亡情况。并且利用生化活性来检测是否存在活细胞的总体灵敏度不高,很难采用这种方法操作小量的样本。如临床样本中仅含有少数的几个活的肿瘤细胞。
第二种为基于细胞形态变化的分析检测。形态学鉴定被广泛用于检测细胞死亡。光学显微镜观察细胞形态变化是最简单和精确的活细胞与死细胞的鉴定方法。细胞形态的变化标志着细胞死亡的启动。在科学研究的早期,科学家发现和定义细胞死亡主要是通过在光学显微镜下观察细胞形态的变化。而直到现在,通过形态变化鉴定细胞死亡是定义细胞死亡的一个金标准。但是这种方法具有很大的局限性,这主要体现在,在可见光下,细胞通常处于一个透明的颜色,同时很难于周围的结缔组织或者组织培养液进行区分。对于活细胞的活体检测,这就尤其困难。
技术实现要素:
本发明要解决的技术问题是,提供一种6-丹磺酰胺-吲哚类荧光探针及其制备方法与应用,具有低细胞毒性并较快穿透活细胞的细胞膜,特异性地对活细胞细胞质进行荧光染色的特点。相比较,这类化合物对于死亡细胞的染色则在荧光形态上明显不同于活细胞的染色,染色后的活细胞与死亡细胞非常容易进行区分,从而能够用于检测区分活的或死的肿瘤细胞。
本发明提供了通式(i)所示的6-丹磺酰胺-吲哚类荧光探针。
其中,r选自甲基、乙基、丙基、丁基和戊基。
本发明涉及的一部分6-丹磺酰胺-吲哚类荧光探针的名称和结构式列在表ⅰ中。
本发明还提供通式i所示6-丹磺酰胺-吲哚类荧光探针的制备方法:
具体而言,称取丹磺酰氯溶解于吡啶,称取6-氨基-吲哚溶解于吡啶,缓慢滴入丹磺酰氯溶液,冰浴下搅拌2小时至室温,氩气保护,反应过夜。向反应中加入双蒸水终止反应,且沉淀反应混合物。采用乙酸乙酯溶解析出的固体,分别用碳酸氢钠洗涤两次,饱和氯化钠洗两次,水洗两次。加入硫酸钠去除水,经过柱层析得到中间体1;
将中间体1与氢化钠溶解于溶剂二甲基甲酰胺中,氩气保护下冰浴反应30分钟。逐滴加入各种烷基化试剂,室温反应过夜。向反应体系中加入二氯甲烷至反应物完全溶解,加入饱和氯化钠洗三次,水洗两次,加入硫酸钠除水,反应混合物通过柱层析进行分离纯化。
其中,r选自甲基、乙基、丙基、丁基和戊基。
本发明还提供了6-丹磺酰胺-吲哚类荧光探针在生物学中检测肿瘤活细胞的应用。
具体来说,本发明提供一种细胞质特异性染色的荧光探针从而建立一种区分活的与死亡的肿瘤细胞的方法。此方法经济、简单、准确、具有普适性,可用于大量样本的检测。
活细胞的生理功能相对稳定,在荧光显微镜下荧光探针染色活细胞后表现为细胞质的荧光染色,细胞核没有荧光染色。其细胞生理学方面的解释为:由于活细胞的生理功能相对稳定,荧光染料在活细胞内聚集到一个较低的浓度便趋于饱和,荧光染料在细胞质内与胞内蛋白进行结合,从而阻止了荧光染料穿过核孔复合体从而进入细胞核内。因此,本试验中的荧光探针对于活细胞染色结果为:细胞核没有荧光,细胞质特异性的荧光染色。图1显示了本发明专利中的5个化合物进行的活肿瘤细胞染色。
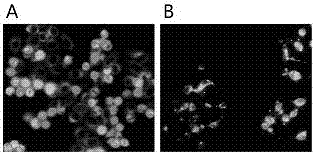
当细胞发生各种模式的细胞死亡时,死亡细胞的形态发生变化,加之死亡细胞内的蛋白发生降解,这些导致该荧光染料在死亡细胞内的分布发生了变化。死亡细胞的荧光形态包括以下情况:对于细胞膜完整的死细胞,由于细胞膜通透性的增加以及细胞内可与荧光染料相结合的蛋白质降解减少,大量荧光染料进入死亡细胞内,表现为全细胞荧光分布(细胞质和细胞核)。对于各种完整膜包裹的凋亡小体等也同样由于膜通透性的变化而表现为整个小体荧光分布。对于细胞膜破裂的死细胞及细胞碎片,由于荧光染料可以被缓冲液洗脱掉,所以表现为无荧光染色。图2显示了本发明专利中的5个化合物显示的活的与死的肿瘤细胞染色的差异。
本试验方法中采用细胞质特异性定位荧光染料来进行细胞染色,有效地区分活细胞与死细胞,从而在荧光显微镜下可以观察到是否有活的肿瘤细胞。本试验方法对于细胞的染色只需要10分钟,即可以在荧光显微镜下观察到是否有活的肿瘤细胞。
本发明的进行生物学操作的技术方案如下:利用特异性的细胞质荧光染料(表1),该染料在活的健康细胞内只分布于细胞质。当细胞发生死亡时,由于细胞膜或核膜的通透性发生改变,该荧光染料透过细胞膜进入细胞。在洗脱时,由于细胞膜的破裂,具体表现为细胞无荧光,对于细胞膜没有破裂的死亡细胞,由于核膜处于一个破坏的状态,荧光探针没有被洗脱掉,但是其分布于整个细胞,也是不同于活细胞荧光分布的(如图2所示)。
具体的肿瘤活细胞检测时:
首先,向需要检测的细胞样品中加入50微摩尔/升的荧光染料共同孵育10分钟;
其次,进行没有结合染料的洗脱。由于培养的肿瘤细胞附着在培养板上,通过洗脱漂洗掉未结合的染料;
最后,用荧光显微镜,对于本发明专利的染料采用紫外光激发,对肿瘤细胞进行直接的观察。
本发明提供的4-丹磺酰胺-吲哚类荧光探针,其具有对活细胞的细胞质特异性染色,不进入活细胞的细胞核。相比较,这类化合物对于死亡细胞的染色则在荧光形态上明显不同于活细胞的染色。通过荧光显微镜对细胞进行荧光成像,进而对细胞生存状态进行评价。本发明涉及的细胞活性检测方法具有操作简单,检测结果准确并且成本低廉的优点。
术语和简称:如本发明中所使用的,如果为提供具体的限定,本发明的术语具有下述含义:“丹磺酰胺”是指5-(n,n-二甲基氨基)-1-萘磺酰胺。
附图说明
图1为本发明中的5个化合物进行的活肿瘤细胞染色。
图2为本发明中的5个化合物区分活的与死的肿瘤细胞。
具体实施方法
下面的实施例可进一步说明本发明,但不以任何方式限制本发明。
实施例1
该实施例中,6-丹磺酰胺-吲哚类荧光探针的名称和结构式如下:
以上6-丹磺酰胺-n-甲基-吲哚的制备方法如下:
称取丹磺酰氯(1327毫克,4.92毫摩尔)溶解于3毫升的吡啶,称取6-氨基-吲哚(500毫克,3.78毫摩尔)溶解于4毫升吡啶,缓慢滴入丹磺酰氯溶液,冰浴下搅拌2小时至室温,氩气保护,反应过夜。向反应中加入100毫升双蒸水终止反应,且沉淀反应混合物。采用100毫升乙酸乙酯溶解析出的固体,分别用60毫升的碳酸氢钠洗涤两次,20毫升饱和氯化钠洗两次,50毫升水洗两次。加入硫酸钠去除水,经过柱层析得到中间体1954毫克;
将中间体1(60毫克,0.164毫摩尔)与氢化钠(8毫克,0.197毫摩尔)溶解于3毫升二甲基甲酰胺中,氩气保护下冰浴反应30分钟。逐滴加入0.197毫摩尔烷基化试剂,室温反应过夜。向反应体系中加入50毫升的二氯甲烷至反应物完全溶解,加入30毫升饱和氯化钠洗3次,30毫升水洗两次,加入硫酸钠除水,反应混合物通过柱层析进行分离纯化,得到45毫克6-丹磺酰胺-n-甲基-吲哚。化合物的鉴定数据如下:
1hnmr(400mhz,cdcl3):δ=2.88(s,6h),3.33(s,3h),6.29(br,1h),6.85-6.87(d,j=8.0hz,1h),7.01-7.14(m,2h),7.28-7.46(m,3h),8.16-8.18(m,1h),8.24-8.26(m,2h),8.51-8.53(m,1h);
hrms(esi):m/z[m+h]计算c21h21n3o2s:380.14272;获得数据:380.14285。
实施例2
该实施例中,6-丹磺酰胺-吲哚类荧光探针的名称和结构式如下:
以上6-丹磺酰胺-n-乙基-吲哚的制备方法如下:
称取丹磺酰氯(1327毫克,4.92毫摩尔)溶解于3毫升的吡啶,称取6-氨基-吲哚(500毫克,3.78毫摩尔)溶解于4毫升吡啶,缓慢滴入丹磺酰氯溶液,冰浴下搅拌2小时至室温,氩气保护,反应过夜。向反应中加入100毫升双蒸水终止反应,且沉淀反应混合物。采用100毫升乙酸乙酯溶解析出的固体,分别用60毫升的碳酸氢钠洗涤两次,20毫升饱和氯化钠洗两次,50毫升水洗两次。加入硫酸钠去除水,经过柱层析得到中间体1954毫克;
将中间体1(60毫克,0.164毫摩尔)与氢化钠(8毫克,0.197毫摩尔)溶解于3毫升二甲基甲酰胺中,氩气保护下冰浴反应30分钟。逐滴加入0.197毫摩尔烷基化试剂,室温反应过夜。向反应体系中加入50毫升的二氯甲烷至反应物完全溶解,加入30毫升饱和氯化钠洗3次,30毫升水洗两次,加入硫酸钠除水,反应混合物通过柱层析进行分离纯化,得到43毫克6-丹磺酰胺-n-乙基-吲哚。化合物的鉴定数据如下:
1hnmr(400mhz,cdcl3):δ=1.05(t,j=8.0hz,3h),2.88(s,6h),3.80(m,2h),6.23-6.25(m,1h),6.85-6.89(m,1h),7.03-7.15(m,2h),7.31-7.41(m,3h),8.12-8.14(m,2h),8.30-8.32(m,1h),8.47-8.49(m,1h);
hrms(esi):m/z[m+h]计算c22h23n3o2s:394.15837;获得数据:394.15839。
实施例3
该实施例中,6-丹磺酰胺-吲哚类荧光探针的名称和结构式如下:
以上6-丹磺酰胺-n-丙基-吲哚的制备方法如下:
称取丹磺酰氯(1327毫克,4.92毫摩尔)溶解于3毫升的吡啶,称取6-氨基-吲哚(500毫克,3.78毫摩尔)溶解于4毫升吡啶,缓慢滴入丹磺酰氯溶液,冰浴下搅拌2小时至室温,氩气保护,反应过夜。向反应中加入100毫升双蒸水终止反应,且沉淀反应混合物。采用100毫升乙酸乙酯溶解析出的固体,分别用60毫升的碳酸氢钠洗涤两次,20毫升饱和氯化钠洗两次,50毫升水洗两次。加入硫酸钠去除水,经过柱层析得到中间体1954毫克;
将中间体1(60毫克,0.164毫摩尔)与氢化钠(8毫克,0.197毫摩尔)溶解于3毫升二甲基甲酰胺中,氩气保护下冰浴反应30分钟。逐滴加入0.197毫摩尔烷基化试剂,室温反应过夜。向反应体系中加入50毫升的二氯甲烷至反应物完全溶解,加入30毫升饱和氯化钠洗3次,30毫升水洗两次,加入硫酸钠除水,反应混合物通过柱层析进行分离纯化,得到35毫克6-丹磺酰胺-n-丙基-吲哚。化合物的鉴定数据如下:
1hnmr(400mhz,cdcl3):δ=0.80(t,j=8.0hz,3h),1.39-1.48(m,2h),2.88(s,6h),3.70(t,j=8.0hz,2h),6.13-6.19(m,1h),6.84-7.09(m,3h),7.29-7.39(m,3h),8.12-8.16(m,2h),8.29-8.31(m,1h),8.44-8.49(m,1h);
hrms(esi):m/z[m+h]计算c23h25n3o2s:408.17402;获得数据:408.17419。
实施例4
该实施例中,6-丹磺酰胺-吲哚类荧光探针的名称和结构式如下:
以上6-丹磺酰胺-n-丁基-吲哚的制备方法如下:
称取丹磺酰氯(1327毫克,4.92毫摩尔)溶解于3毫升的吡啶,称取6-氨基-吲哚(500毫克,3.78毫摩尔)溶解于4毫升吡啶,缓慢滴入丹磺酰氯溶液,冰浴下搅拌2小时至室温,氩气保护,反应过夜。向反应中加入100毫升双蒸水终止反应,且沉淀反应混合物。采用100毫升乙酸乙酯溶解析出的固体,分别用60毫升的碳酸氢钠洗涤两次,20毫升饱和氯化钠洗两次,50毫升水洗两次。加入硫酸钠去除水,经过柱层析得到中间体1954毫克;
将中间体1(60毫克,0.164毫摩尔)与氢化钠(8毫克,0.197毫摩尔)溶解于3毫升二甲基甲酰胺中,氩气保护下冰浴反应30分钟。逐滴加入0.197毫摩尔烷基化试剂,室温反应过夜。向反应体系中加入50毫升的二氯甲烷至反应物完全溶解,加入30毫升饱和氯化钠洗3次,30毫升水洗两次,加入硫酸钠除水,反应混合物通过柱层析进行分离纯化,得到39毫克6-丹磺酰胺-n-丁基-吲哚。化合物的鉴定数据如下:
1hnmr(400mhz,cdcl3):δ=0.75(t,j=8.0hz,3h),1.21-1.43(m,4h),2.89(s,6h),3.72(t,j=8.0hz,2h),6.19(br,1h),6.84-7.05(m,3h),7.29-7.42(m,3h),8.11-8.16(m,2h),8.29-8.31(m,1h),8.49-8.52(m,1h);
hrms(esi):m/z[m+h]计算c24h27n3o2s:422.18967;获得:422.18954。
实施例5
该实施例中,6-丹磺酰胺-吲哚类荧光探针的名称和结构式如下:
以上6-丹磺酰胺-n-戊基-吲哚的制备方法如下:
称取丹磺酰氯(1327毫克,4.92毫摩尔)溶解于3毫升的吡啶,称取6-氨基-吲哚(500毫克,3.78毫摩尔)溶解于4毫升吡啶,缓慢滴入丹磺酰氯溶液,冰浴下搅拌2小时至室温,氩气保护,反应过夜。向反应中加入100毫升双蒸水终止反应,且沉淀反应混合物。采用100毫升乙酸乙酯溶解析出的固体,分别用60毫升的碳酸氢钠洗涤两次,20毫升饱和氯化钠洗两次,50毫升水洗两次。加入硫酸钠去除水,经过柱层析得到中间体1954毫克;
将中间体1(60毫克,0.164毫摩尔)与氢化钠(8毫克,0.197毫摩尔)溶解于3毫升二甲基甲酰胺中,氩气保护下冰浴反应30分钟。逐滴加入0.197毫摩尔烷基化试剂,室温反应过夜。向反应体系中加入50毫升的二氯甲烷至反应物完全溶解,加入30毫升饱和氯化钠洗3次,30毫升水洗两次,加入硫酸钠除水,反应混合物通过柱层析进行分离纯化,得到51毫克6-丹磺酰胺-n-戊基-吲哚。化合物的鉴定数据如下:
1hnmr(400mhz,cdcl3):δ=0.74(t,j=8.0hz,3h),1.16-1.59(m,6h),2.89(s,6h),3.71(t,j=8.0hz,2h),6.21(br,1h),6.85-7.15(m,3h),7.30-7.42(m,3h),8.11-8.15(m,2h),8.29-8.32(m,1h),8.48-8.51(m,1h);
hrms(esi):m/z[m+h]计算c25h29n3o2s:436.20532;获得:436.20547。
实施例6
将上述5个化合物分别溶于二甲亚砜中,将其分别加入到hepg2细胞的培养基中至终浓度为50微摩尔/升,染色10分钟后,采用ph为7.4的磷酸盐缓冲液洗脱没有吸收的荧光探针。在荧光显微镜下观察,如图1所示,所有的荧光探针均表现出细胞质特异性的荧光染色。a:6-丹磺酰胺-n-甲基-吲哚;b:6-丹磺酰胺-n-乙基-吲哚;c:6-丹磺酰胺-n-丙基-吲哚;d:6-丹磺酰胺-n-丁基-吲哚;e:6-丹磺酰胺-n-戊基-吲哚。
实施例7
采用荧光探针化合物6-丹磺酰胺-n-戊基-吲哚区分活细胞与死细胞的实验验证。
采用细胞毒性药物紫杉醇(0.1微摩尔/每升)分别处理肿瘤细胞株-hepg2细胞4个和8个小时,使得hepg2细胞表现死亡细胞(早期、终期)与活细胞均存在的情况。在这种情况下,采用6-丹磺酰胺-n-戊基-吲哚荧光探针对于死亡状态(早期、终期)细胞进行染色,观察到死亡细胞则表现为:在细胞死亡的早期,死亡细胞变为全荧光染色的圆形(图2-a),同一图中部分肿瘤活细胞表现为细胞核无荧光,细胞质为荧光染色。在细胞死亡的后期,部分的死亡细胞或细胞碎片因为没有完整地细胞膜,不能看到荧光染色;另外一些具有完整膜包裹的死亡细胞或膜包裹小体则表现为全细胞荧光染色的不规则形状(图2-b)。如图2所示。所以,死亡细胞的荧光染色是不同于肿瘤活细胞。
显然,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于所述技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!