一种还原响应性荧光探针的结构、制备及应用的制作方法
本发明涉及一种还原响应性荧光探针的结构、制备及应用,属于有机荧光探针领域。
背景技术:
:
肿瘤严重威胁人类健康,据统计,全球在2017年有880万人死于肿瘤。除了放疗、化疗和免疫治疗,目前大部分肿瘤早期患者主要接受手术治疗。然而由于恶性肿瘤生长部位的复杂性及浸润性生长的特点,手术医生仅通过肉眼判断,往往难以准确判断肿瘤组织和周边正常组织的边界,亦难以识别正常组织中散在的微小肿瘤病灶。如不能彻底清除肿瘤,容易导致术后肿瘤复发;如过度切除肿瘤周边正常组织,又可能影响到患者术后的一些正常生理功能。因此,通过肿瘤精准成像,帮助外科医生彻底清除肿瘤病灶在临床手术治疗中具有重要意义。
目前临床上肿瘤成像模式主要包括结构成像(如ct,mri,超声成像等)和功能成像(如pet,spect和荧光成像等)。结构成像能很好地给出机体的解剖结构信息,但无法给出疾病特异性的信息。功能成像中,pet成像在肿瘤的早期诊断方面应用较多,但其不能用于术中成像,且存在分辨率较低和假阳性率较高等问题。荧光实时成像可以引导手术切除肿瘤,应用潜力巨大。因此,用于肿瘤精准成像的荧光探针的研究具有重要的临床价值
用于肿瘤特异性成像的荧光探针主要包括靶向荧光探针和生物响应型荧光探针。前者针对肿瘤高表达的生物标志物,在某些特定的肿瘤亚型上成像效果较好,但不具备肿瘤成像的广谱性,且无法在正常组织实现荧光淬灭,往往具有较高的组织背景,导致其信噪比有限,难以对肿瘤边缘进行精准成像。后者主要基于fret(荧光共振能量转移)原理设计,在正常组织能够实现荧光淬灭(简称“off”状态),而在肿瘤组织特异性地被刺激因子(如组织蛋白酶等)激活发光(简称“on”状态),从而提高荧光探针成像的信噪比。但这类生物响应型探针中的荧光分子发射波长多处于可见光范围,具有较高的组织背景和较弱的组织穿透能力,限制了其体内信噪比的提高程度。
近年来,生物响应型纳米材料受到越来越多的关注,已被广泛用于肿瘤成像和药物递送。生物响应型纳米探针也可构建成“on/off”型荧光探针,实现信号放大。与其它荧光探针相比,其具备一些优势:第一,由于处于纳米内核中的荧光染料之间的荧光淬灭主要是通过homofret原理(同种荧光染料分子间的荧光能量共振转移现象)来实现,可选用同一种近红外荧光染料;第二,同一个纳米粒可以同时负载数百个荧光染料分子;第三,纳米探针可增强荧光分子在肿瘤组织的蓄积量。尽管生物响应型纳米探针具有以上这些优势,但其体内成像信噪比仍不够高,限制了在肿瘤精准成像方面的应用。该类探针信噪比不高的原因主要有两方面:首先,生物响应型纳米探针普遍存在响应效率不高的问题,从而影响了其成像信噪比。响应效率不高的原因主要有两方面:第一,由于体内刺激因子浓度往往较低,很多生物响应型纳米材料在低浓度刺激因子作用下化学断键的反应效率不高;第二,有些刺激敏感的化学键断裂需要较长时间,如聚碳酸酯或一些脂肪族聚酯类在体内降解往往需要几个小时甚至几天的时间。其次是荧光染料分子能否从纳米粒内核中迅速有效释放的问题。纳米探针对刺激因素作出响应后,只有迅速将荧光染料从纳米内核中释放出来,才能实现纳米探针的“off/on转变”。事实上,控制纳米粒在体内合适的部位有效释放负载物(药物或荧光分子),也是纳米领域的重要课题。
肿瘤组织中还原性物质(如谷胱甘肽)的浓度是正常组织的4倍以上,且肿瘤胞内谷胱甘肽浓度(1-10mm)是胞外浓度(1-10μm)的近1000倍,已经被广泛用于药物靶点或生物响应型材料的刺激因子。
技术实现要素:
基于以上背景技术,针对现有技术的不足,本发明的目的是针对“现有荧光探针成像信噪比普遍不高”的问题,拟构建一种高效还原响应型荧光纳米探针(gsh-primingnanoprobes,gpn),通过荧光分子的“核/壳跃迁”实现超高信噪比,用于肿瘤精准成像引导的手术治疗。该响应型纳米探针具有体内外成像信噪比高、灵敏度高、肿瘤靶向性强的特点。
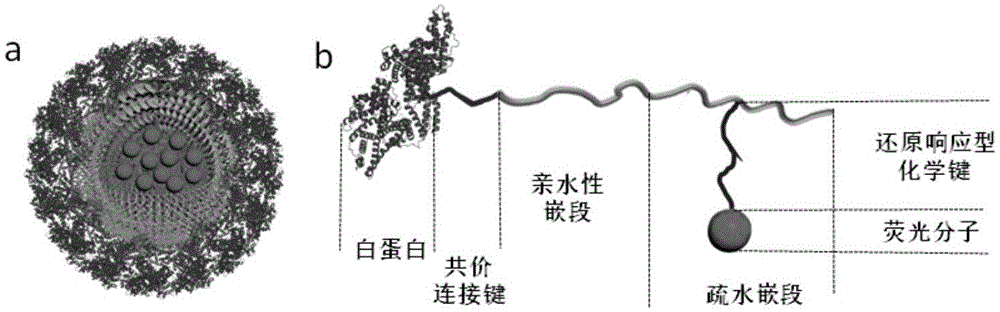
本发明所述纳米探针由三层组成,最外层为白蛋白层,中间层为亲水高分子嵌段层,内层为同时偶联还原响应型化学键和荧光染料的疏水性高分子嵌段内核。本发明所述纳米探针由以下嵌段共聚物缔合而形成胶束或纳米粒结构。嵌段共聚物由以下六部分组成:白蛋白、共价连接键、亲水嵌段、疏水嵌段、还原响应型部分、荧光分子。其中,荧光分子单元和白蛋白单元结合力极强;
本发明所述的还原响应型荧光纳米探针,其特征在于该纳米探针从非还原性环境进入还原性环境(谷胱甘肽gsh,二硫苏糖醇dtt,β-巯基乙醇等)时,荧光强度发生显著增强,荧光增强倍数为2-200倍,具有类似于“荧光开关”的性质;
本发明所述的还原响应型荧光纳米探针,其发光机理为,在非还原性环境(正常组织)中,荧光分子处于纳米内核,相互之间发生荧光淬灭,该纳米探针处于“荧光关”状态;在还原性环境(肿瘤组织)下,还原剂打开纳米材料上的二硫键,荧光分子在纳米外壳白蛋白的作用下发生“核/壳跃迁”,该纳米探针由“关”状态转换至“开”状态。该纳米探针同时具备两个优势:①白蛋白与荧光分子的结合可有效防止荧光分子间自聚,从而使纳米探针在“荧光开”状态下的发光强度达到最大化;②荧光分子的“核/壳跃迁”可促进还原剂与还原敏感化学键之间氧化还原反应的进行,从而提高了该荧光纳米探针对还原剂的响应效率。
本发明所述的还原响应型纳米探针具有以下优点:
1、本发明提供的荧光纳米探针体外成像信噪比高。
2、本发明提供的荧光纳米探针体内成像信噪比高。
3、本发明提供的荧光纳米探针对还原剂的响应效率高。
4、本发明提供的荧光纳米探针稳定性好。
5、本发明提供的荧光纳米探针肿瘤成像特异性好,灵敏度高。
附图说明:
附图1.荧光纳米探针的结构示意图。(a)纳米探针的结构示意图;(b)组成纳米探针的高分子材料结构示意图。
附图2.荧光纳米探针的荧光激活机理示意图。
附图3.荧光纳米探针的制备示意图。
附图4.还原响应型纳米探针的透射电镜照片,标尺:50nm。
附图5.荧光纳米探针在还原剂谷胱甘肽环境中的荧光光谱扫描图。激发光为780nm,发射光为800-850nm。
附图6.荧光纳米探针的对谷胱甘肽的浓度响应性(a)和时间响应性(b)。
附图7.荧光纳米探针在不同谷胱甘肽浓度中的体外成像。
附图8.荧光纳米探针在荷293-t肿瘤nod/scid小鼠中的成像效果。荧光纳米探针在荷4t1肿瘤nod/scid小鼠中的成像效果。(a)小鼠经尾静脉注射荧光探针后24小时的活体成像效果;(b)小鼠经尾静脉注射荧光探针后24小时的离体体荧光成像效果;(c)纳米探针在小鼠不同器官激活的荧光半定量分析。
具体实施方式
以下通过实施例进一步说明和解释本发明,但不作为本发明进行的限制。
实施案例1、还原敏感性吲哚氰氯荧光纳米材料的合成
(1)分三步合成还原响应的共聚物。第一步,将一定量的ctam、甲基丙烯酸二异丙基氨基乙酯(dpa)、偶氮二异丁腈(aibn)溶于二甲基甲酰胺(dmf)中,经三次冻融循环后,在70℃氩气保护下反应24小时,反应产物经纯水透析2天并冻干;第二步,称取一定量上一步所得产物,与甲基丙烯酸丁酯(bma)一起溶于dmf中,经三次冻融循环后,在70℃氩气保护下反应24小时,反应产物经纯水透析2天并冻干;第三步,将第二步的产物羧基端与mpeg5000的羟基端偶联。
(2)对于近红外荧光染料的偶联,通过共聚物上游离氨基与吲哚氰氯活泼酯(icg-osu)反应,将一定量的共聚物和icg-osu加入甲醇/四氢呋喃混合溶剂中,反应24小时后过酸性三氧化二铝色谱柱纯化,并经超滤除盐和有机溶剂,冻干即得。
(3)对于共聚物-白蛋白偶联物的合成,先将一定量共聚物溶于四氢呋喃后,滴入去离子水中,并通过旋转蒸发挥掉有机溶剂后,加入带双键的聚乙二醇,搅拌24小时后冻干即可。
实施案例2、还原敏感性吲哚氰氯荧光纳米材料的制备(方法i)
称取一定量的共聚物-吲哚氰氯偶联物冻干粉,用四氢呋喃溶解后,在超声情况下逐滴滴加至去离子水中,再用100kd的超滤管在4000rpm的情况下超滤4-5次后,定容至适当浓度。为了得到荧光纳米探针,再称取适量共聚物-白蛋白偶联物,溶于共聚物-吲哚氰氯偶联物的纳米粒溶液中,涡旋即可。
实施案例3、还原敏感性吲哚氰氯荧光纳米材料的制备(方法ii)
称取一定量带双键的共聚物-吲哚氰氯偶联物,用四氢呋喃溶解后,在超声情况下逐滴滴加至去离子水中,再用100kd的超滤管在4000rpm的情况下超滤4-5次后,定容至适当浓度。然后,加入与双键等比例牛血清白蛋白,磁力搅拌24小时即可。
实施案例4、还原敏感性吲哚氰氯荧光纳米探针的透射电镜图
取实施案例2中制备的还原敏感性吲哚氰氯荧光纳米探针,用马尔文激光粒度仪(zetasizer3000hs,malvern,uk)测定25℃时的粒径(图)。将制备的还原敏感性吲哚氰氯荧光纳米探针稀释10倍,用透射电镜(jem-200x,jeol,japan)观察其结构。将稀释好的样品在室温下恒温30min后,滴加在渡碳膜的铜网上,待水分挥干后直接装入jem-200x透射电镜,加速电压为80kv,观察粒径和形态。
实施案例5、还原敏感性吲哚氰氯荧光纳米探针在gsh环境中的荧光激活作用
为了准确计算不同的荧光纳米探针的信噪比,我们分别测定荧光纳米探针(有还原剂,fion)、荧光纳米探针(无还原剂,fioff)和空白还原剂(10mmgsh溶液,fi0)的荧光强度(λex=780nm,λem=808nm),根据下列公式计算信噪比。
信噪比(cnr)=(fion–fi0)/(fioff–fi0)
利用荧光分光光度法分别测定荧光纳米探针在不同gsh浓度下的荧光值,绘制荧光-gsh浓度曲线。拟用时间扫描法测定纳米探针在不加gsh时的荧光值随时间的变化,6min后,迅速加入预先准备好的gsh(控制终浓度为10mm),混合均匀,继续用时间扫描法测定其荧光值,考察gsh激活反应器的时间灵敏度。
实施案例6、还原敏感性吲哚氰氯荧光纳米探针在不同gsh浓度中的体外成像
在不同ep管中分别加入30μl1mg/ml还原敏感性吲哚氰氯荧光纳米探针,然后加入30μl不同浓度的gsh,稀释至300μl,控制gsh的终浓度分别为0,0.01,0.03,0.1,0.3,1,3,10mm,利用荧光分光光度计进行发射光谱的波长扫描,考察还原敏感性吲哚氰氯荧光纳米探针激活对gsh的浓度灵敏度。
在96孔板中的不同小孔中分别加入20μl1mg/ml还原敏感性吲哚氰氯荧光纳米探针,然后加入20μl不同浓度的gsh,稀释至200μl,控制gsh的终浓度分别为0,0.01,0.03,0.1,0.3,1,3,10mm,利用小动物活体成像仪进行体外成像,考察还原敏感性吲哚氰氯荧光纳米探针在不同浓度gsh溶液中的激活效果。
实施案例7、还原敏感性吲哚氰氯荧光纳米探针在荷4t1肿瘤的小鼠模型中的活体成像和离体成像
向nod/scid小鼠的右侧腋下皮下接种106个4t1乳腺癌细胞,建立荷4t1肿瘤的小鼠模型。待肿瘤长至一定大小后,向每只小鼠尾静脉注射200μl还原敏感性吲哚氰氯荧光纳米探针(剂量为5mg/kg),分别在给药后0,1,4,8,24h不同时间点,用异氟烷麻醉小鼠,利用小动物活体成像仪进行成像观察。在最后一个时间点成像后,颈椎脱臼法处死小鼠,收集心、肝、脾、肺、肾和肿瘤组织,在离体状态下进行近红外荧光成像。激发光波长780nm,发射光波长845nm。
实施案例8、还原敏感性吲哚氰氯荧光纳米探针在荷karpas肿瘤的小鼠模型中的活体成像和离体成像
向nod/scid小鼠的右侧腋下皮下接种106个karpas肿瘤细胞,建立荷4t1肿瘤的小鼠模型。待肿瘤长至一定大小后,向每只小鼠尾静脉注射200μl还原敏感性吲哚氰氯荧光纳米探针(剂量为5mg/kg),分别在给药后0,1,4,8,24h不同时间点,用异氟烷麻醉小鼠,利用小动物活体成像仪进行成像观察。在最后一个时间点成像后,颈椎脱臼法处死小鼠,收集心、肝、脾、肺、肾和肿瘤组织,在离体状态下进行近红外荧光成像。激发光波长780nm,发射光波长845nm。
实施案例9、还原敏感性吲哚氰氯荧光纳米探针在荷786-o肿瘤的小鼠模型中的活体成像和离体成像
向nod/scid小鼠的右侧腋下皮下接种106个786-o肿瘤细胞,建立荷4t1肿瘤的小鼠模型。待肿瘤长至一定大小后,向每只小鼠尾静脉注射200μl还原敏感性吲哚氰氯荧光纳米探针(剂量为5mg/kg),分别在给药后0,1,4,8,24h不同时间点,用异氟烷麻醉小鼠,利用小动物活体成像仪进行成像观察。在最后一个时间点成像后,颈椎脱臼法处死小鼠,收集心、肝、脾、肺、肾和肿瘤组织,在离体状态下进行近红外荧光成像。激发光波长780nm,发射光波长845nm。
- 还没有人留言评论。精彩留言会获得点赞!