一种多组分氯化物共晶熔盐的制备方法与流程
本发明涉及熔盐领域,具体涉及一种多组分氯化物共晶熔盐的制备方法。
背景技术
氯化物熔盐具有工作温度宽,粘度低,比热容高及扩散能力好等优点,作为介质其在熔盐电解精炼、燃料电池、太阳能光热、熔盐快堆和储能领域具有广泛的应用。为更好发挥氯化物熔盐在超高温蓄热领域的优势,美国能源部启动sunshot计划研究氯化物熔盐作为太阳能热发电技术的候选传蓄热介质,通过提高传蓄热介质的工作温度,以提高热电转化效率。单组分氯化盐具有较大的挥发性和吸水性,两种或两种以上氯化盐共混制备二元系或者多元系的氯化物熔盐时极易挥发或者分解,进而影响氯化物熔盐的传蓄热特性和稳定性,为氯化物熔盐制备应用带来了极大的难度和技术挑战。
目前熔盐的制备方法主要有混合加热法和水溶法两种方法。混合加热法是将多组分熔盐按照组分配比进行称量混合,充分加热使其熔融形成共晶体系。水溶法将按照配比混合好的多组分熔盐溶于水中,从而使体系中各组分均匀分散,充分加热除去水分后形成共晶体系。多元氯化物熔盐体系中,单组份氯化盐都具有较大的挥发性,在制备的过程中易产生氯气或与少量水结合,易形成碱金属氯化物与金属氧化物,从而导致氯化物熔盐体系的组成和结构发生变化,导致其传蓄热特性和稳定性变差。
采用混合加热法制备氯化物熔盐体系时,短时间内多元体系无法达成分子层级混合,致使加热过程中的某一组分因蒸发而逸出影响多元体系组成和性能。水溶法通常只能用于制备多元碳酸盐体系,而在制备多元氯化物熔盐体系过程中,高价碱金属氯化物会与oh-结合,在加热过程中极易形成碱金属氯化物与金属氧化物,从而影响多元氯化物熔盐体系的组成和性能。以上两种熔盐制备方法由于组分、结构或者引入杂质的原因,均不能制备出性能优异的多元氯化物熔盐体系。
技术实现要素:
为了解决上述现有技术存在的问题,本发明旨在提供一种多组分氯化物共晶熔盐的制备方法。
本发明所述的多组分氯化物共晶熔盐的制备方法,包括如下步骤:s1,提供具有第一熔点的第一氯化物组分和具有第二熔点的第二氯化物组分,其中,第二熔点小于第一熔点;s2,提供盐酸水溶液,将该盐酸水溶液与第一氯化物组分和第二氯化物组分在超声振动下混合形成氯化物溶液;s3,将氯化物溶液加热至第一温度,在该第一温度下保温以去除氯化物溶液中的水,该第一温度大于120℃并比第二熔点小10-100℃;s4,将氯化物溶液继续加热至第二温度,在该第二温度下保温以熔化第一氯化物组分和第二氯化物组分;s5,冷却得到具有第三熔点的多组分氯化物共晶熔盐,第三熔点小于第一熔点,第二温度比第三熔点大10-200℃。
所述第一氯化物组分为cscl,所述第二氯化物组分为zncl2。优选地,所述第一氯化物组分和所述第二氯化物组分的摩尔比为(0.1-0.75):(0.25-0.9)。其中,cscl的熔点为645℃,zncl2的熔点为283-293℃。在一个优选的实施例中,cscl和zncl2的摩尔比为0.201:0.799,cscl-zncl2的熔点为256℃,第一温度比zncl2熔点低83-93℃为200℃,第二温度比共晶熔点高44℃为300℃。在另一个优选的实施例中,cscl和zncl2的摩尔比为0.75:0.25,cscl-zncl2的熔点为556℃,第一温度为200℃,第二温度为600℃。在又一个优选的实施例中,cscl和zncl2的摩尔比为0.1:0.9,cscl-zncl2的熔点为252℃,第一温度为200℃,第二温度比共晶熔点高48℃为300℃。
在所述步骤s1中,第一氯化物组分和第二氯化物组分根据既定的摩尔比或质量比进行精确称量。当然,本发明提供的多组分氯化物共晶熔盐还可以包括第三、第四……氯化物组分。在步骤s1中,该第一氯化物组分和第二氯化物组分可以进行混合操作,也可以不进行混合操作。
在所述步骤s2中,该盐酸水溶液加入到承载有第一氯化物组分和第二氯化物组分的坩埚中进行混合。当然,也可以将第一氯化物组分和第二氯化物组分直接加入到承载有盐酸水溶液的坩埚中进行混合。应该理解,该坩埚为耐熔盐腐蚀且熔点高于氯化物组分的容器。优选地,该盐酸水溶液与第一氯化物组分和第二氯化物组分在超声振动10-15min下混合形成氯化物溶液。在一个优选的实施例中,超声振动后静置得到该氯化物溶液。具体地,通过稀释浓盐酸来得到盐酸水溶液。在优选的实施例中,盐酸水溶液的浓度为0.01-1mol/l。应该理解,该盐酸水溶液的浓度不能过高,以避免引入过多cl-,导致制备过程中hcl的溢出,影响环境。
在所述步骤s3中,第一温度比第二熔点小80-99℃。具体地,第一温度为120-200℃。在优选的实施例中,氯化物溶液以5-20℃/min的速率加热至第一温度,并在第一温度下保温1-2h。在一个优选的实施例中,氯化物溶液以10℃/min的速率加热至第一温度,并在第一温度下保温1.5h。
在所述步骤s4中,第二温度比第三熔点大30-40℃。具体地,第二温度为300-600℃。在优选的实施例中,氯化物溶液以5-20℃/min的速率继续加热至第二温度,并在第二温度下保温30min-1h。在一个优选的实施例中,氯化物溶液以10℃/min的速率继续加热至第二温度,并在第二温度下保温45min。
在所述步骤s5中,在无氧或惰性气氛冷却至常温以得到多组分氯化物共晶熔盐。
根据本发明的多组分氯化物共晶熔盐的制备方法,可以在自然条件下的空气气氛中进行,简单安全,操作方便,能有效降低氯化物熔盐制备过程中气体溢出,减少对环境的污染。实践表明,根据本发明的制备方法获得的多组分氯化物共晶熔盐分散性好,稳定性高,传蓄热性能优异,适合于熔盐储能、太阳能热发电等新能源领域。总之,根据本发明的多组分氯化物共晶熔盐的制备方法,不仅能够解决混合加热法制备氯化物熔盐中存在的氯化盐低熔点组分易挥发分解和分散不均的难题,而且可以解决水溶液法制备氯化物熔盐中的高价态组分易水解产生杂质而引起体系结构变化的问题。
附图说明
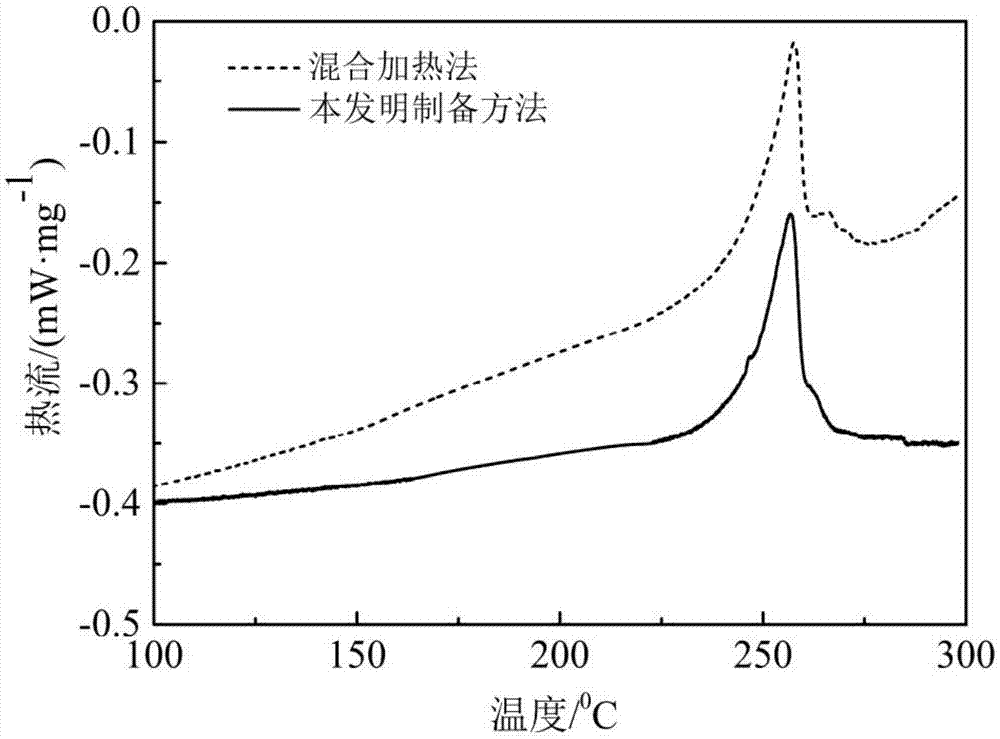
图1是根据本发明的实施例1制备的cscl-zncl2共晶熔盐和混合加热法制备的cscl-zncl2熔盐的dsc曲线;
图2是根据本发明的实施例2制备的cscl-zncl2共晶熔盐和混合加热法制备的cscl-zncl2熔盐的dsc曲线;
图3是根据本发明的实施例3制备的cscl-zncl2共晶熔盐和混合加热法制备的cscl-zncl2熔盐的dsc曲线。
具体实施方式
下面结合附图,给出本发明的较佳实施例,并予以详细描述。
实施例1
cscl-zncl2(0.201:0.799,mol%)共晶熔盐的制备
1)分别称量cscl(纯度>99.0%)2.3707g和zncl2(纯度>94.7%)7.6293g,称量后放入坩埚中待用;
2)量取41.7ml36.0%的盐酸稀释至1000ml,配置浓度为0.5mol/l的盐酸水溶液。将配置好的盐酸水溶液加入到坩埚中,常温条件下将坩埚置于超声条件下振动10-15min后静置,制备出混合均匀的氯化物溶液;
3)将含有氯化物溶液的坩埚置于加热炉中以10℃/min的速率加热升温到200℃,并在此温度下保温1.5h以去除氯化物溶液中的水分;
4)将含有氯化物溶液的坩埚以10℃/min的速率继续加热升温至300℃,并在此温度下保温45min后将坩埚转移放置在无氧或惰性气氛的手套箱内冷却至室温,即得多组分氯化物熔盐;
5)采用差式扫描量热仪(dsc)对制备的多组分氯化物熔盐进行测试,测试的温度范围90-300℃,升温速率为5-10℃,通过测试后熔点变化来判断是否形成cscl-zncl2共晶熔盐体系。
图1示出了根据本发明的制备方法得到的cscl-zncl2共晶熔盐的dsc曲线。另外,由于cscl-zncl2熔盐也可以采用混合加热法进行制备,因此,为了较佳地说明两种制备方法的异同,本实验通过对这两种方法制备的cscl-zncl2熔盐的熔点测试来进行评价,即图1也示出了混合加热法制备的cscl-zncl2熔盐的dsc曲线。
从图1可以看出,混合加热法制备的cscl-zncl2熔盐出现明显分峰现象,测试基线有较大程度漂移,表明其并不能形成完全共晶。由此可推断,混合加热的制备过程中可能发生了zncl2组分部分分解成cl2与zn单质,使体系组成发生变化。另外,混合加热法制备cscl-zncl2熔盐的实验过程中,超过200℃开始出现刺鼻的白色烟雾,制备的cscl-zncl2熔盐呈现浅灰色。
从图1可以看出,采用本发明方法制备的cscl-zncl2熔盐的熔点为256℃,为单一峰,表明其形成共晶熔盐体系。另外,采用本发明方法制备cscl-zncl2熔盐的加热过程中,随着加热时间的增加,逐渐有白色颗粒析出,直至水分完全蒸发。当温度加热至300℃,未出现刺鼻的白色烟雾,cscl-zncl2熔盐外观为白色。
如此对比可以得出,与混合加热法相比,采用本发明方法得到的cscl-zncl2熔盐性能效果最佳。
实施例2
cscl-zncl2(0.750:0.250,mol%)共晶熔盐的制备
1)分别称量cscl(纯度>99.0%)7.8749g和zncl2(纯度>94.7%)2.1251g,称量后放入坩埚中待用;
2)量取41.7ml36.0%的盐酸稀释至1000ml,配置浓度为0.5mol/l的盐酸水溶液。将配置好的盐酸水溶液加入到坩埚中,常温条件下将坩埚置于超声条件下振动10-15min后静置,制备出混合均匀的氯化物溶液;
3)将含有氯化物溶液的坩埚置于加热炉中以5℃/min的速率加热升温到120℃,并在此温度下保温1h以去除氯化物溶液中的水分;
4)将含有氯化物溶液的坩埚以5℃/min的速率继续加热升温至600℃,并在此温度下保温30min后将坩埚转移放置在无氧或惰性气氛的手套箱内冷却至室温,即得多组分氯化物熔盐;
5)采用差式扫描量热仪(dsc)对制备的多组分氯化物熔盐进行测试,测试的温度范围250-580℃,升温速率为5-10℃,通过测试后熔点变化来判断是否形成cscl-zncl2共晶熔盐体系。
图2示出了根据本发明的制备方法得到的cscl-zncl2共晶熔盐的dsc曲线。另外,由于cscl-zncl2熔盐也可以采用混合加热法进行制备,因此,为了较佳地说明两种制备方法的异同,本实验通过对这两种方法制备的cscl-zncl2熔盐的熔点测试来进行评价,即图2也示出了混合加热法制备的cscl-zncl2熔盐的dsc曲线。
从图2可以看出,混合加热法制备的cscl-zncl2熔盐吸收峰温度较低。由此可推断,混合加热的制备过程中可能发生了zncl2组分部分分解成cl2与zn单质,使体系组成发生变化。另外,混合加热法制备cscl-zncl2熔盐的实验过程中,超过200℃开始出现刺鼻的白色烟雾,制备的cscl-zncl2熔盐呈现浅灰色。
从图2可以看出,采用本发明方法制备的cscl-zncl2熔盐的熔点为556℃,为单一峰,表明其形成共晶熔盐体系。另外,采用本发明方法制备cscl-zncl2熔盐的加热过程中,随着加热时间的增加,逐渐有白色颗粒析出,直至水分完全蒸发。当温度加热至600℃,未出现刺鼻的白色烟雾,cscl-zncl2熔盐外观为白色。
如此对比可以得出,与混合加热法相比,采用本发明方法得到的cscl-zncl2熔盐性能效果最佳。
实施例3
cscl-zncl2(0.100:0.900,mol%)共晶熔盐的制备
1)分别称量cscl(纯度>99.0%)1.2068g和zncl2(纯度>94.7%)8.7932g,称量后放入坩埚中待用;
2)量取41.7ml36.0%的盐酸稀释至1000ml,配置浓度为0.5mol/l的盐酸水溶液。将配置好的盐酸水溶液加入到坩埚中,常温条件下将坩埚置于超声条件下振动10-15min后静置,制备出混合均匀的氯化物溶液;
3)将含有氯化物溶液的坩埚置于加热炉中以20℃/min的速率加热升温到200℃,并在此温度下保温2h以去除氯化物溶液中的水分;
4)将含有氯化物溶液的坩埚以20℃/min的速率继续加热升温至300℃,并在此温度下保温60min后将坩埚转移放置在无氧或惰性气氛的手套箱内冷却至室温,即得多组分氯化物熔盐;
5)采用差式扫描量热仪(dsc)对制备的多组分氯化物熔盐进行测试,测试的温度范围90-290℃,升温速率为5-10℃,通过测试后熔点变化来判断是否形成cscl-zncl2共晶熔盐体系。
图3示出了根据本发明的制备方法得到的cscl-zncl2共晶熔盐的dsc曲线。另外,由于cscl-zncl2熔盐也可以采用混合加热法进行制备,因此,为了较佳地说明两种制备方法的异同,本实验通过对这两种方法制备的cscl-zncl2熔盐的熔点测试来进行评价,即图3也示出了混合加热法制备的cscl-zncl2熔盐的dsc曲线。
从图3可以看出,混合加热法制备的cscl-zncl2熔盐出现两个结晶峰。由此可推断,混合加热的制备过程中可能发生了zncl2组分部分分解成cl2与zn单质,使体系组成发生变化。另外,混合加热法制备cscl-zncl2熔盐的实验过程中,超过200℃开始出现刺鼻的白色烟雾,制备的cscl-zncl2熔盐呈现浅灰色。
从图3可以看出,采用本发明方法制备的cscl-zncl2熔盐的熔点为252℃,为单一峰,表明其形成共晶熔盐体系。另外,采用本发明方法制备cscl-zncl2熔盐的加热过程中,随着加热时间的增加,逐渐有白色颗粒析出,直至水分完全蒸发。当温度加热至300℃,未出现刺鼻的白色烟雾,cscl-zncl2熔盐外观为白色。
如此对比可以得出,与混合加热法相比,采用本发明方法得到的cscl-zncl2熔盐性能效果最佳。
总之,本发明的制备方法对氯化物熔盐制备非常适用,尤其是适用于氯化物熔盐体系中的某组分具有较大的蒸汽压,两种或两种以上的氯化盐的熔点差别较大等导致升温过程中低熔点组分挥发或分解等情况。
以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
- 还没有人留言评论。精彩留言会获得点赞!