一种荧光微球的保存液及其配制方法与流程
本发明涉及生物化学制剂
技术领域:
,特别涉及一种荧光微球的保存液及其配制方法。
背景技术:
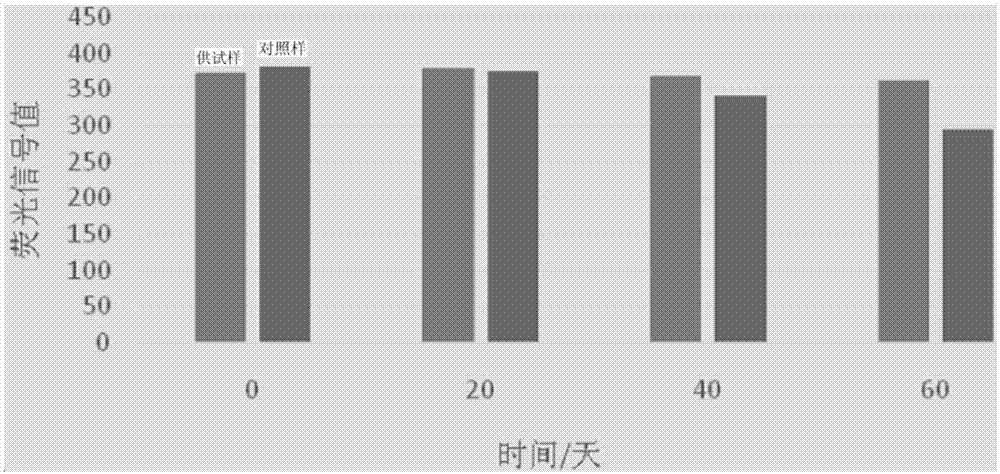
:荧光微球是一种功能性微球,具体是通过化学反应或物理吸附在微球表面标记荧光物质,或者在微球内部包埋或聚合上某种荧光物质,从而使微球具有荧光显示效果;荧光微球外形可为任意形状,以球形为主。目前,荧光微球的种类包括量子点荧光微球、稀土荧光微球、自发光荧光微球等等。由于荧光微球在受到外界能量刺激后发出荧光,因此广泛应用于荧光免疫分析法、酶免疫分析法、荧光显微镜法、共聚焦荧光显微镜法、流式细胞术/成像细胞术等生物医药领域。现有荧光微球具有粒度均一、分散性好、发光率高等优点,但其稳定性差,会受到外界环境和介质的影响。通常需将荧光微球置于保存液中进行保存,目前,保存液组分主要包括缓冲液和防腐剂等,对荧光微球的保存效果欠佳。技术实现要素:有鉴于此,本发明的目的在于提供一种荧光微球的保存液及其配制方法。采用本发明的保存液能够明显提高荧光微球的荧光信号稳定性和生物活性稳定性。本发明提供了一种荧光微球的保存液,包括以下质量比的组分:优选的,所述糖类选自蔗糖、海藻糖、葡萄糖、山梨醇和葡聚糖中的一种或几种。优选的,所述缓冲液为甘氨酸-盐酸缓冲液、柠檬酸-柠檬酸钠缓冲液或磷酸氢二钠-柠檬酸缓冲液。优选的,所述缓冲液的浓度为0.05~0.2m。优选的,所述有机分散剂为聚乙二醇。优选的,所述聚乙二醇的数均分子量为6000以上。优选的,所述聚乙二醇选自peg-10000、peg-15000和peg-20000中的一种或几种。优选的,所述无机钠盐包括氯化钠。优选的,所述保存液的ph为3.0~6.0。本发明还提供了一种上述技术方案中所述的保存液的配制方法,包括:将无机钠盐、糖类、有机分散剂和缓冲液与部分水混合,再加入乙醇,调节ph后加入剩余水,得到保存液。本发明提供了一种荧光微球的保存液,包括以下质量比的组分:0.8%~8%的乙醇,1.2%~4.8%的缓冲液,0.05%~0.15%的无机钠盐,0.5%~1.5%的糖类,0.05%~0.15%的有机分散剂和余量的水。本发明提供的保存液中,乙醇、糖类和有机分散剂三者协同作用,增强对荧光微球颗粒表面活性基团的保护作用,同时,通过无机钠盐调节体系离子浓度及缓冲液的缓冲作用,对荧光微球达到较好的保护效果,明显提高了其荧光信号稳定性和生物活性稳定性。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。图1为本发明实施例2中加速稳定性的荧光信号变化图;图2为本发明实施例2中加速稳定性的生物活性变化图;图3为本发明实施例3中实时稳定性的荧光信号变化图;图4为本发明实施例3中实时稳定性的生物活性变化图。具体实施方式本发明提供了一种荧光微球保存液,包括以下质量比的组分:本发明提供的保存液中,乙醇、糖类和有机分散剂三者协同作用,增强对荧光微球颗粒表面活性基团的保护作用,同时,通过无机钠盐调节体系离子浓度及缓冲液的缓冲作用,对荧光微球达到较好的保护效果,明显提高了其荧光信号稳定性和生物活性稳定性。本发明提供的保存液包括乙醇。乙醇在本发明的保存液体系中能够改变溶液的极性,并促进其它保护成分溶解,增强保护成分与荧光微球颗粒表面活性基团的相互作用,即乙醇与其它保护成分相互协同作用,提升对荧光微球颗粒活性的保护作用,达到提高其稳定性的效果。本发明对所述乙醇的种类没有特殊限制,可以为无水乙醇或工业乙醇。本发明中,乙醇在保存液中的质量比为0.8%~8%,优选为3%~5%,更优选为4%。本发明提供的保存液还包括缓冲液。本发明中,所述缓冲液优选为甘氨酸-盐酸缓冲液、柠檬酸-柠檬酸钠缓冲液或磷酸氢二钠-柠檬酸缓冲液。所述缓冲液能够维持本发明保存液体系的ph值,对溶液ph变化起缓冲作用。其中,上述缓冲液中,柠檬酸-柠檬酸钠缓冲液的效果最好。本发明中,所述缓冲液的浓度优选为0.05~0.2m,更优选为0.1m。本发明中,所述缓冲液在保存液中的质量比为1.2%~4.8%,优选为1.5%~3%,更优选为2.38%。本发明提供的保存液还包括无机钠盐。采用无机钠盐能够调节本发明保存液体系的离子浓度,使各成分之间更好的相互作用,提升保护效果。经考察,采用其它无机盐类如钾盐(如kcl、k2so4等)、镁盐(如mgcl2、mgso4等)等,都不能够与本发明其它成分相互配合,对荧光微球的保护效果较差。本发明中,所述无机钠盐优选为氯化钠;经考察,诸多无机钠盐(如nacl、na2so4等)中,氯化钠更能够与本发明其它成分协同,达到优异的保护效果,使荧光微球的稳定性达到最佳。本发明中,所述无机钠盐在保存液中的质量比为0.05%~0.15%,优选为0.08%~0.12%,更优选为0.1%。本发明提供的保存液还包括糖类。本发明的保存液体系中引入糖类能够对荧光微球表面的活性基团起保护作用,与乙醇、有机分散剂协同,提高荧光微球的稳定性。本发明中,所述糖类优选为蔗糖、海藻糖、葡萄糖、山梨醇和葡聚糖中的一种或几种;经考察,其它糖类如果糖、麦芽糖、乳糖等,保护效果较差,而本发明的上述糖类保护效果较好。本发明中,所述糖类更优选为蔗糖,其保护效果最佳。本发明中,所述糖类在保存液中的质量比为0.5%~1.5%,优选为0.8%~1.2%,更优选为1.0%。本发明提供的保存液还包括有机分散剂,采用有机分散剂能够对溶液体系起到较好的分散效果,并对荧光微球起保护作用,与乙醇、糖类协同,提高荧光微球稳定性。本发明中,所述有机分散剂优选为聚乙二醇;经考察,相比其它有机分散剂如pvp(即聚乙烯吡咯烷酮)、明胶等,聚乙二醇适宜于本发明的保存液体系,能够与其它保护成分起协同作用。本发明中,所述聚乙二醇优选为数均分子量在6000以上的聚乙二醇,若分子量低于6000,保护效果降低。更优选的,所述聚乙二醇为peg-10000、peg-15000和peg-20000中的一种或几种;最优选为peg-20000。本发明中,所述有机分散剂在保存液中的质量比为0.05%~0.15%,优选为0.08%~0.12%,更优选为0.1%。本发明提供的保存液还包括余量的水,用于溶解各个组分。在本发明的一些实施例中,保存液包括:乙醇3%~5%,缓冲液1.5%~3%,无机钠盐0.08%~0.12%,糖类0.8%~1.2%,有机分散剂0.08%~0.12%,水余量。在最佳实施例中,保存液包括:乙醇4%,缓冲液2.38%,无机钠盐0.1%,糖类1.0%,有机分散剂0.1%,水余量。在本发明的一些实施例中,保存液包括:乙醇3%~5%,柠檬酸-柠檬酸钠缓冲液1.5%~3%,氯化钠0.08%~0.12%,蔗糖0.8%~1.2%,peg-200000.08%~0.12%,水余量。在最佳实施例中,保存液包括:乙醇4%,柠檬酸-柠檬酸钠缓冲液2.38%,氯化钠0.1%,蔗糖1.0%,peg-200000.1%,水余量。本发明中,所述保存液的ph值优选为3.0~6.0,更优选为4.0。本发明所提供荧光微球的保存液,适宜的荧光微球优选为聚甲基丙烯酸酯基荧光微球或聚苯乙烯基荧光微球。本发明还提供了一种上述技术方案中所述的荧光微球的保存液的配制方法,包括:将无机钠盐、糖类、有机分散剂和缓冲液与部分水混合,再加入乙醇,调节ph后加入剩余水,得到保存液。本发明先取一部分水,加入无机钠盐、糖类、有机分散剂和缓冲液混合均匀,再加入乙醇,然后调节ph,最后用剩余水定容,得到保存液。其中,先取的一部分水优选为总水量的50wt%~80wt%。其中,调节ph所用试剂的种类没有特殊限制,为本领域技术人员熟知的试剂即可,如naoh溶液、hcl液等;在一些实施例中,所述调节ph的试剂浓度为0.05m。试验结果表明,采用本发明提供的保存液,能够明显提升荧光微球的荧光信号稳定性和生物活性稳定性。为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是为进一步说明本发明的特征和优点,而不是对本发明权利要求的限制。实施例1原料:乙醇4%,柠檬酸-柠檬酸钠缓冲液(0.1m)2.38%,氯化钠0.1%,蔗糖1.0%,peg-200000.1%,去离子水余量。配制:将氯化钠、蔗糖、缓冲液溶解于部分去离子水中,再加入乙醇,调ph至4.0,用余下去离子水定容,得到保存液。实施例2取100ml荧光微球(固含量为2%,型号为f8809,由thermofisher科技公司提供),平均分成两份,每份50ml。取其中一份转移至离心管中,离心后去掉上清,加入50ml实施例1中的保存液,在振荡器上振荡3~5min,再超声处理5~10min,使荧光微球均匀分散于保存液中,记为供试样。将另一份未使用保存液的荧光微球作为空白对照样。将上述两份样品在37℃下储存,分别进行荧光信号和生物活性的加速稳定性测试(加速条件为:37℃),测试时间点分别是0天、20天、40天、60天。(1)荧光信号稳定性的测试如下:用移液枪从两份样品中分别吸取1ml样品,离心去掉上清,再加入1ml去离子水,在振荡器上振荡3~5min,再超声处理5~10min,确保荧光微球均匀分散于水中;再从中取一定量的样品,用去离子水稀释400倍。然后,用hitachif-2700荧光分光光度计分别检测两份样品的荧光信号。测试结果参见表1和图1,图1为本发明实施例2中加速稳定性的荧光信号变化图。表1实施例2中加速稳定性的荧光信号测试结果由表1和图1测试结果可以看出,未使用保存液的对照样中,荧光微球的荧光信号值变化幅度较大,而使用本发明的保存液后,荧光微球表现出更加稳定的荧光信号。(2)生物活性稳定性的测试如下:s1:颗粒活化:从两份样品中分别吸取1ml置于离心管中,离心去掉上清,再加入1ml去离子水,在振荡器上振荡3~5min,再超声处理5~10min,确保荧光微球均匀分散于水中。再加入edc(即1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)12.5mg、nhs(即n-羟基琥珀酰亚胺)10mg,超声处理5~10min,在25℃的恒温摇床中孵育1h,然后离心去掉上清,再加入1ml去离子水,在振荡器上振荡3~5min,超声处理5~10min,确保荧光微球均匀分散于水中,得到活化的荧光微球。s2:将鼠抗人c反应蛋白单抗(购自上海领潮生物科技有限公司)用0.1m的pbs缓冲液稀释成5mg/ml,得到稀释的单抗。s3:取1ml稀释的单抗于离心管中,加入10μl活化的荧光微球,在25℃的恒温摇床中孵育2h,然后离心取其上清,利用shimadzuuv-1800测试其吸光度值。测试结果参见表2和图2,图2为本发明实施例2中加速稳定性的生物活性变化图。表2实施例2中加速稳定性的生物活性测试结果由表2和图2测试结果可以看出,未使用保存液的对照样中,荧光微球的吸光度值变化幅度较大,而使用本发明的保存液后,吸光度值较为稳定,即荧光微球表现出更加稳定的生物活性。实施例3取50ml荧光微球(固含量为2%,型号为f8809,由thermofisher科技公司提供),转移至离心管中,离心后去掉上清,加入50ml实施例1中的保存液,在振荡器上振荡3~5min,再超声处理5~10min,使荧光微球均匀分散于保存液中,记为供试样。将上述样品在室温下(25℃)储存,分别进行荧光信号和生物活性的实时稳定性测试(实时条件为25℃),测试时间点分别是0个月、6个月、12个月、24个月、36个月。(1)荧光信号稳定性的测试如下:用移液枪吸取1ml样品,离心去掉上清,再加入1ml去离子水,在振荡器上振荡3~5min,再超声处理5~10min,确保荧光微球均匀分散于水中;再从中取一定量的样品,用去离子水稀释400倍。然后,用荧光分光光度计检测样品的荧光信号。测试结果参见表3和图4,图3为本发明实施例3中实时稳定性的荧光信号变化图。表3实施例3中实时稳定性的荧光信号测试结果时间/月06122436荧光信号值371380386374368由表3和图3测试结果可以看出,使用本发明保存液的荧光微球实时条件下也具有较稳定的荧光信号值。(2)生物活性稳定性的测试如下:s1:颗粒活化:吸取1ml样品置于离心管中,离心去掉上清,再加入1ml去离子水,在振荡器上振荡3~5min,再超声处理5~10min,确保荧光微球均匀分散于水中。再加入edc(即1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)12.5mg、nhs(即n-羟基琥珀酰亚胺)10mg,超声处理5~10min,在25℃的恒温摇床中孵育1h,然后离心去掉上清,再加入1ml去离子水,在振荡器上振荡3~5min,超声处理5~10min,确保荧光微球均匀分散于水中,得到活化的荧光微球。s2:将鼠抗人c反应蛋白单抗用0.1m的pbs缓冲液稀释成5mg/ml,得到稀释的单抗。s3:取1ml稀释的单抗于离心管中,加入10μl活化的荧光微球,在25℃的恒温摇床中孵育2h,然后离心取其上清,测试其吸光度值。测试结果参见表4和图4,图4为本发明实施例3中实时稳定性的生物活性变化图。表4实施例3中实时稳定性的生物活性测试结果时间/月06122436吸光度值0.190.210.210.240.22由表4和图4测试结果可以看出,使用本发明保存液的荧光微球实时条件下也具有较稳定的生物活性。实施例41.1样品的制备原料:乙醇4%,甘氨酸-盐酸缓冲液(0.1m)2.38%,氯化钠0.1%,海藻糖1.0%,peg-100000.1%,去离子水余量。按照实施例1的配方方法得到保存液,记为样品4a。原料:乙醇4%,磷酸氢二钠-柠檬酸缓冲液(0.1m)2.38%,氯化钠0.1%,葡萄糖1.0%,peg-150000.1%,去离子水余量。按照实施例1的配方方法得到保存液,记为样品4b。1.2样品的测试按照实施例2的测试方法对上述样品分别进行荧光信号和生物活性的加速稳定性测试,测试结果分别如表5和表6所示。表5实施例4加速稳定性的荧光信号测试结果由表5测试结果可知,与实施例2中的空白对照样相比,样品4a和样品4b均表现出更加稳定的荧光信号,证明使用本发明的保存液,能够提高荧光微球的荧光稳定性。与实施例2中的供试样(即采用了实施例1的保存液)相比,样品4a和样品4b的荧光信号变化幅度略增,证明,实施例1的保存液对提高荧光微球的荧光信号稳定性具有最佳效果。表6实施例4加速稳定性的生物活性测试结果由表6测试结果可知,与实施例2中的空白对照样相比,样品4a和样品4b均表现出更加稳定的生物活性,证明使用本发明的保存液,能够提高荧光微球的生物活性稳定性。与实施例2中的供试样(即采用了实施例1的保存液)相比,样品4a和样品4b的吸光度值变化幅度略增,证明,实施例1的保存液对提高荧光微球的生物活性稳定性具有最佳效果。以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1