辅因子-底物探针平台用于肿瘤缺氧相关酶的快速定量检测的制作方法
本发明属于金属-有机超分子、生物无机和生物荧光探针领域,具体涉及用于快速定量检测缺氧酶的主-客体超分子探针的制备方法及在溶液、细胞、活体检测方面的应用。
背景技术:
缺氧是许多癌症的一项重要指标,与肿瘤的各种生理活动密切相关。目前,许多基于底物的酶促荧光探针通过使用靶向低氧激活的方法鉴定癌细胞中低氧酶的位置和表达水平,用于溶液、癌细胞和小动物体内低氧酶异常水平的检测和成像,对癌症的早期诊断和监测治疗至关重要。然而,缺氧酶的浓度和表达水平通常在不同的细胞和肿瘤中差别很大,甚至相同的细胞中也有差异。当一定量的传统探针用于检测时,未知浓度的辅因子和酶两个变量都会导致探针发射随时间发生显着变化,传统探针很难排除辅因子浓度对检测结果的干扰,酶含量与荧光响应没有显示出稳定的线性关系。因此,传统的探针方法来定量检测酶含量,准确区分正常和疾病状态的酶活性变化仍然是一项具有挑战性的课题。
对于传统的探针来说其对体内缺氧酶含量的检测高度依赖于辅因子的含量,通常在溶剂检测辅因子依赖性的缺氧酶实验中,研究人员通过加入大量过量(几十倍到几百倍摩尔量)的辅因子,从而消除酶催化反应中辅因子浓度干扰,使得辅因子浓度相控制不再制约缺氧酶催化底物的最大反应速率,响应信号只与酶含量相关。这种方法消除了辅因子的浓度对酶催化探针荧光开启速率的限制,以实现精确、快速的检测。但是细胞中检测时,不同种类的细胞,甚至在具有不同缺氧条件的相同细胞中,缺氧酶和相应辅因子的表达水平是不固定的,而且也无法实现溶剂实验中辅因子大大过量的条件。因此,将基于辅因子-底物的探针组合到一个超分子系统中,该体系中辅因子和底物两者之间具有明确的化学计量比,并且相互接近的主客体分子将促进电子转移效率,这将使探针与酶的反应速率不被内源辅因子浓度干扰,对于快速定量检测很有帮助。
金属-有机多面体笼具有酶高效催化底物转化的能力,研究人员使用具有特定亲-疏水腔的金属-有机笼作为独特的主体来催化化学转化。将辅因子模拟物直接引入到金属-有机笼状配合物的骨架中,使催化活性位点靠近底物,并促进反应物之间有效的电子转移过程。将基于酶底物的发光探针封装在辅因子组装的“分子容器”中,得到一种可用于区分和定量检测正常状态和疾病状态下不同酶活性的重要工具。这种新型辅因子-底物结构的主-客体超分子探针融合策略使发光底物、辅因子和酶的氧化还原反应能够有效发生,表现出出色的动力学特性。
技术实现要素:
本发明的目的是提出一种基于辅因子-底物探针平台用于肿瘤缺氧相关酶的快速定量检测,包括其制备方法和生物测试应用,金属-有机笼状配合物作为nadh模拟物与底物融合成准分子与酶催化反应,将多底物反应变为单底物反应的策略。通过减少底物种类,缩短各底物之间距离,促进反应动力学改变。
本发明的技术方案如下:
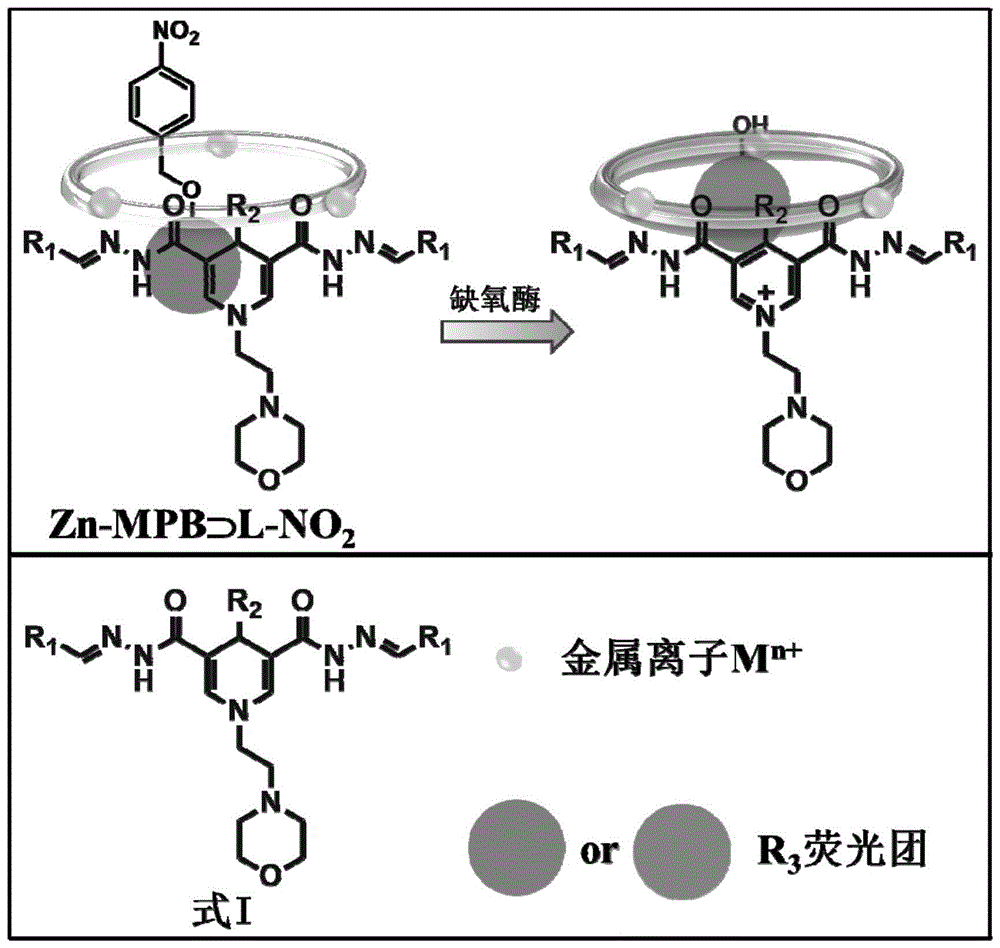
基于辅因子-底物探针平台结构、基本配体组成单元及酶催化反应,如图1所示。
其中,主-客体探针
式i中配体的二氢吡啶部分结构与nadh类似,作为nadh模拟物活性部分,用于质子和电子传递;
所述的配体制备方法,包括如下步骤:
其中:r1为提供配位原子的基团,r1采用2-吡啶基、2-巯基苯基、2-噻吩、2-吡咯、喹啉或异喹啉;r2为苯基、氢、卤素、氰基、苄氧基。r2采用苯基时,式ⅰ的结构更优。
(1)以丙炔酸甲酯、r2-cho、醋酸铵和冰醋酸为原料制备中间体1所示化合物;所述醋酸铵:丙炔酸甲酯:r2-cho的摩尔比为4:2:1;
(2)以所示中间体1、4-(2-氯乙基)吗啉、碱、有机溶剂为原料制备中间体2所示化合物;所述碱为碳酸钠、碳酸钾、碳酸铯或有机碱;所述有机溶剂选自丙酮、n,n-二甲基甲酰胺或1,4-二氧六环;所述中间体1:4-(2-氯乙基)吗啉的摩尔比为1:1.1;
(3)以中间体2和80%水合肼反应,得到中间体3所示化合物;中间体2与80%水合肼的摩尔比1:5到1:10;
(4)以中间体3和r1-cho在醋酸催化下反应,得到最终配体化合物式i结构;所述中间体3:r1-cho的摩尔比1:2。
其中:当r1为2-吡啶基,r2为苯基时,其制备方法如下:
(1)以丙炔酸甲酯、苯甲醛、醋酸铵和冰醋酸为原料制备中间体1所示化合物;所述醋酸铵:丙炔酸甲酯:苯甲醛的摩尔比为4:2:1;
(2)以所示中间体1、卤代化合物4-(2-氯乙基)吗啉、碱(过量,>2eq)、有机溶剂为原料制备中间体2所示化合物;所述碱为碳酸钠、碳酸钾、碳酸铯或有机碱;所述有机溶剂选自丙酮、n,n-二甲基甲酰胺或1,4-二氧六环;所述中间体1:4-(2-氯乙基)吗啉的摩尔比为1:1.1;
(3)以中间体2和80%水合肼反应,得到中间体3所示化合物;中间体2与80%水合肼的摩尔比1:5到1:10;
(4)以中间体3和2-醛基吡啶在醋酸催化下反应,得到最终配体化合物式i结构;所述中间体3:2-醛基吡啶的摩尔比1:2。
所述的荧光底物制备方法,包括如下步骤:
客体结构中,r3为酶催化的荧光底物的荧光团部分,可以是且不仅限于2-苯基-3a,11b-二氢-1h-菲[9,10-d]咪唑基团、萘基团、喹喔啉基团、卟啉或卟吩基团等;
(1)选择上述羟基、酚羟基或氨基荧光团r3-oh、r3-nh2;
(2)以上述荧光团和对硝基苄溴为原料,合成式ii或式iii结构,作为硝基还原酶荧光底物。
当r3为2-苯基-3a,11b-二氢-1h-菲[9,10-d]咪唑基时,可采用以下方法进行式ⅱ或式ⅲ的合成:
(1)以4-羟基苯甲醛(或4-氨基苯甲醛)、对硝基苄溴为原料,制备中间体4(或中间体5)所示化合物;所述4-羟基苯甲醛(或4-氨基苯甲醛):对硝基苄溴的摩尔比为1:1;
(2)以所示中间体4(或中间体5)、9,10-菲咯醌、醋酸铵(>10eq)为原料,醋酸作溶剂,加热回流制备合成式ⅱ或式ⅲ的结构,作为硝基还原酶荧光底物;所述中间体4(或中间体5):9,10-菲咯醌的摩尔比为3:1。
所述的辅因子-底物主客体探针平台制备方法,包括如下步骤:
1)选择上述式i中配体与所需配位金属盐分别溶于有机溶剂(乙腈、乙醇等),选取一定比例的这两种溶液充分混合搅拌8h,通过溶剂挥发结晶、溶剂扩散结晶或加入小极性互溶溶剂沉淀出金属-有机配合物,通过核磁、质谱或单晶结构等数据确认结构m3n3;
2)以上述配体与金属盐得到的金属-有机笼状配合物和硝基还原酶荧光底物混合,通过质谱、核磁或单晶确认辅因子-底物主客体探针的结构,分析金属-有机笼状配合物与荧光底物的化学计量比。
所述的辅因子-底物主客体探针在溶剂中检测硝基还原酶的应用。
一类用于溶剂中硝基还原酶定量快速检测的辅因子-底物主客体探针,测试方法:向新配置的硝基还原酶tris-hcl缓冲液(10.0mm,ph7.4,25℃)中加入辅因子-底物主客体探针(0-5μm)进行荧光滴定实验和荧光动力学实验。具有辅因子nadh功能的主体金属-有机笼与具有荧光指示功能的底物分子形成的超分子探针,将底物和辅酶模拟物融合成准分子结构,使硝基还原酶原有的辅酶nadh和底物双底物催化过程优化为单底物过程。使硝基还原酶的检测快速达到平衡,不再受nadh含量的影响,因此检测的荧光强度变化只与硝基还原酶含量变化有关,实现快速对硝基还原酶的定量检测。
所述的辅因子-底物主客体探针在细胞中检测硝基还原酶的应用。
一类用于细胞中硝基还原酶定量快速检测的辅因子-底物主客体探针,测试方法:配置dmem培养基(加入fbs10%,双抗1%)用于培养mcf-7和231细胞,配置1640培养基(加入fbs10%,双抗1%)用于培养a549细胞。设置不同氧含量环境(20%,8%,0.1%)培养细胞6-12h后,再用辅因子-底物超分子探针进行孵育1min,进行不同氧含量下细胞的激光共聚焦荧光成像实验。相同氧含量环境(例如都在0.1%o2)下培养细胞6-12h,然后再辅因子-底物超分子探针对细胞进行不同的孵育时间(如0-10min),开展细胞荧光成像随时间变化实验。
所述的辅因子-底物主客体探针在活体动物中检测硝基还原酶的应用。
一类用于小鼠活体内硝基还原酶定量快速检测的辅因子-底物主客体探针,测试方法:利用所需的癌细胞对裸鼠进行种瘤,在成瘤期对小鼠进行注射中所述的辅因子-底物超分子探针(一般注射浓度和范围为10-200μm、50-200μl),进行小鼠瘤体荧光随时间变化成像实验。
本发明的有益效果:
通过将缺氧酶中最常见的辅因子nadh模拟物引入金属有机胶囊zn-mpb的骨架中,我们在此提出了一种基于辅因子-底物的超分子探针
1、该药品主要应用对象:主要适用于仿生催化、肿瘤成像诊断治疗等领域。
2、市场及价格定位:由于生活水平的提高,人类寿命得到大幅提高,而老年人群里更易患癌症;另一方面,现代人们的不健康生活方式,吸烟、感染、职业暴露、环境污染、不合理膳食、遗传因素等都会导致癌症发病率增加。2018年ca:acancerjournalforclinicians(影响因子223)期刊上一篇文章总结了当年全球肿瘤统计情况,结果显示全球185个国家地区估计有1819万癌症新增病例以及960万癌症死亡病例。而我国每天约有1万人确诊癌症,相当于平均每分钟就有7个人确诊癌症,我国癌症患病率处于国际中等偏上水平。癌症的早期诊断对于患者的治愈率和存活时间有着巨大的提升,该发明主要针对广谱的癌症标志物缺氧酶的活性的准确检测,来诊断是否患癌。另一方面,本发明还可以作为指导肿瘤切除手术显像剂。可以说在医疗健康领域有着广阔的应用前景。
3、应用效益:癌症早期症状不明显,目前对早期癌症的筛查比较复杂昂贵,因此很多患者往往错过最佳治疗时间。将本发明应用到癌症早期诊断可快速对病症进行筛查,而且廉价易行,使得普通民众都能用得起。本专利所建立的方法将有助于解决这一问题,因此具有巨大的潜在经济价值。
4、推广价值:据统计数据显示,全球癌症药物市场规模从2013年的729亿美元扩大至2017年的1106亿美元,复合年增长率达12.8%。随着癌症药物市场的进一步扩大,预计2030年以前,全球肿瘤市场销售额将超4000亿美元。本专利涉及的化合物目前还未形成产品,其相关产品一旦市场化,其市场价值将达到百亿元级别。
附图说明
图1是基于辅因子-底物探针平台结构、基本配体组成单元及酶催化反应图。
图2是
图3是l-no2或
图4是cck8实验分析zn-mpb和l-no2分别对mcf-7细胞的毒性实验图。
图5是l-no2和
图6是l-no2和
图7是注射l-no2以及
具体实施方式
本发明提出了一种基于辅因子-底物探针平台并用于肿瘤缺氧酶的超快定量检测的策略,该主客体探针在溶剂、细胞以及活体实验中表现出超快定量检测的特征,下面结合实施例对本发明做进一步介绍。
实施例1:辅因子-底物结构的超分子主客体探针的合成制备
所述的
1.ntr荧光底物合成,包括如下步骤:
(1)以对羟基苯甲醛和对硝基苄溴为原料合成化合物1
室温下,将4-羟基苯甲醛(1g,8.20mmol)、对硝基苄基溴(1.7g,8.20mmol)、碳酸钾(1.7g,12.30mmol)和n,n-二甲基甲酰胺(10ml)的混合物在60℃下加热2小时。tcl监测反应进程,反应完成后将混合物冷却至室温,并倒入冷水(50ml)中。抽滤得到灰白色固体,用水(10ml×3)洗涤,真空浓缩并通过柱层析纯化,得到4-(4-硝基-苄氧基)-苯甲醛,产量1.56g,产率74%。1hnmr(400mhz,cdcl3)δ9.91(s,1h),8.27(d,j=8.3hz,2h),7.87(d,j=8.4hz,2h),7.62(d,j=8.3hz,2h),7.09(d,j=8.4hz,2h),5.27(s,2h).13cnmr(101mhz,cdcl3)δ189.61,161.91,146.79,142.26,131.05,129.64,126.64,122.95,114.07,67.83.esi-msm/z:[m+h]calculatedforc14h12no4+258.0761,found258.0767。
(2)以化合物1和9,10-菲咯醌为原料合成ntr荧光底物l-no2
将9,10-菲咯醌(166mg,0.8mmol),4-(4-硝基苄氧基)-苯甲醛(617mg,2.4mmol)和乙酸铵(123mg,16mmol)的混合物在冰醋酸(4ml)中加热搅拌回流。反应完成后,将冷却至室温,抽滤收集所得浅黄色固体,并用过量的水和甲醇洗涤除去起始原料,dmso中重结晶,产量295mg,收率83%。1hnmr(500mhz,dmso)δ13.32(s,1h),8.85(dd,j=16.6,8.3hz,2h),8.59(d,j=7.8hz,1h),8.54(d,j=7.9hz,1h),8.28(dd,j=8.7,1.9hz,4h),7.78(d,j=8.5hz,2h),7.76-7.70(m,2h),7.66-7.61(m,2h),7.28(d,j=8.8hz,2h),5.39(s,2h).13cnmr(126mhz,dmso)δ158.81,149.08,147.06,144.76,136.88,128.30,127.75,127.48,127.43,127.40,127.03,126.96,125.10,124.97,124.03,123.67,123.63,123.60,122.39,121.82,115.25,68.20.esi-msm/z:[m-h]calculatedforc28h18n3o3-446.1499,found446.1490。
2.主体金属有机笼状配合物zn-mpb合成,包括如下步骤:
(1)以2-吗啉乙醇、二氯亚砜为原料制备如图化合物2
将二氯亚砜(4.76g,40mmol)和10ml甲苯加入到圆底烧瓶中,并在冰浴中搅拌15分钟。然后,将2-吗啉-4-基-乙醇(1.31g,10mmol)溶解在甲苯(5ml)中,并用滴液漏斗缓慢滴加到冰浴的圆底烧瓶中。0℃下反应2小时后,将逐渐升温到90℃下再回流8小时。反应完成后,将混合物在冷盐水(50ml)中淬灭。然后将溶液的ph调节至10,用乙酸乙酯萃取,柱层析纯化,得到浅褐色油状化合物2(4-(2-氯乙基)-吗啉),产量1.33g,收率89%。1hnmr(400mhz,cdcl3)δ3.75–3.69(m,4h),3.59(t,j=6.9hz,2h),2.72(t,j=6.9hz,2h),2.55–2.48(m,4h).13cnmr(101mhz,cdcl3)δ66.77,60.13,53.52,40.63.esi-msm/z:[m+h]calculatedforc6h13clno+150.0680,found150.0677。
(2)以醋酸铵、苯甲醛和丙炔酸甲酯为原料制备化合物3
将丙酸甲酯(1.68g,20mmol),苯甲醛(1.06g,10mmol)和乙酸铵(2.31g,30mmol)在冰醋酸(4.0ml)中80℃回流12小时。待反应完成冷却后,将固体产物抽滤并用et2o(10ml×3)洗涤,得到黄色粉末粗产物化合物3,将其用乙醇重结晶,产量1.32g,产率48%。1hnmr(400mhz,dmso)δ7.39(s,2h),7.26–7.18(m,4h),7.15–7.08(m,1h),4.75(s,1h),3.95(br,1h),3.54(s,6h).13cnmr(126mhz,dmso)δ166.75,147.11,135.08,127.95,127.50,126.15,105.57,50.82,36.85.nmr(126mhz,dmso).esi-msm/z:[m+h]calculatedforc15h16no4+274.1074,found274.1074。
(3)以化合物2和化合物3为原料制备化合物4(dmpdd)
将化合物2(1.79g,12mmol),化合物3(2.73g,10mmol)和碳酸钾(0.35g,25mmol)在丙酮中回流12小时以上,tcl检测反应进程,反应完成后冷却并过滤,收集有机相,并将固体用二氯甲烷充分洗涤,收集有机相。完成后,除去溶剂,并将粗产物通过柱色谱法纯化(乙酸乙酯/石油醚,1:10,v/v),得到浅黄色固体dmpdd,产量2.04g,收率53%。1hnmr(400mhz,cdcl3)δ7.36–7.31(m,2h),7.25–7.20(m,4h),7.17–7.12(m,1h),4.87(s,1h),3.75–3.71(m,4h),3.63(s,6h),3.50(t,j=6.1hz,2h),2.63(t,j=6.1hz,2h),2.56–2.52(m,4h).13cnmr(101mhz,cdcl3)δ167.36,146.69,137.92,128.04,128.00,126.45,108.19,66.85,58.28,53.62,51.63,51.29,37.05.esi-msm/z:[m+h]calculatedforc21h27n2o5+387.1914,found387.1911.
(4)以化合物4和水合肼为原料,合成酰肼化合物5
将80%水合肼(20ml)和化合物4(3.86g,10mmol)的混合溶液在120℃下搅拌回流12小时以上。反应完成后,将其收集并真空干燥。将粗产物通过快速柱色谱法纯化(ch2cl2/ch3oh,40∶1,v/v),得到浅黄色固体化合物5。产量3.46g,收率90%。1hnmr(400mhz,dmso)δ8.63(br,2h),7.31(d,j=7.1hz,2h),7.17(t,j=7.4hz,2h),7.12(s,2h),7.08(t,j=7.3hz,1h),4.98(s,1h),4.41(br,4h),3.61–3.55(m,4h),3.49(t,j=5.9hz,2h),2.54–2.48(m,2h),2.44(s,4h).13cnmr(101mhz,cdcl3)δ172.08,139.20,132.99,132.93,131.18,112.88,71.53,58.40,55.57,40.60.esi-msm/z:[m+h]calculatedforc19h27n6o3+387.2139,found387.2134。
(5)以化合物为原料合成配体h2mpb
将化合物5(3.86g,10mmol)加入到含有2-吡啶醛(2.68g,25mmol)的乙醇溶液(50ml)中。加入几滴乙酸后,将混合物在80℃下加热搅拌12小时以上。反应完成后冷却过滤收集浅黄色固体产物,用乙醇洗涤,真空干燥并从甲醇中重结晶,得到纯的化合物h2mpb。产量4.95g,收率88%。1hnmr(500mhz,dmso)δ11.36(s,2h),8.57(d,j=4.8hz,2h),8.29(s,2h),7.86(d,j=7.8hz,2h),7.83(td,j=7.6,1.7hz,2h),7.47(s,2h),7.38–7.36(m,2h),7.35(s,2h),7.22(t,j=7.6hz,2h),7.12(t,j=7.3hz,1h),5.31(s,1h),3.64(s,2h),3.60(s,4h),2.64(s,2h),2.50(s,4h).13cnmr(126mhz,dmso)δ163.82,153.52,149.37,146.96,145.03,136.65,135.86,127.92,127.65,126.10,123.91,119.51,108.26,66.28,57.75,53.20,50.81,35.80.esi-msm/z:[m+h]calculatedforc31h33n8o3+565.2670,found565.2670。
(6)zn-mpb的组装合成
将六水合高氯酸锌(18.6mg,0.05mmol)和h2mpb(28.5mg,0.05mmol)溶于ch3cn(10ml)中,得到黄色澄清溶液。搅拌4小时后,将溶液倒入乙醚中,得到黄色沉淀,离心分离并真空干燥,得到橘黄色粉末,产量35mg,产率75%。1hnmr(400mhz,dmso)δ11.45(br,6h),8.44(m,12h),7.93(m,12h),7.47(m,12h),7.35(d,j=5.8hz,6h),7.22(s,6h),7.14(t,j=7.2hz,3h),5.32(s,3h),3.77(s,6h),3.62(s,12h),2.77–2.50(m,18h).esimsm/z:[h2zn3(mpb)3]2+=942.54。
3.
将得到的zn-mpb化合物与l-no2分别溶解在氘代dmso中,配置等浓度的溶液,并1:1混合。其noesy核磁谱如图2a所示。l-no2的n-h质子与zn-mpb化合物中多个质子间具有相互租用,说明形成了主客体结构。esimsm/z:h2zn3(mpb)3(l-no2)]2+=1166.17.
实施例2:基于辅因子-底物探针平台的溶剂性质测试
辅因子-底物探针平台
(1)
辅因子-底物超分子探针平台的稳定性决定了其应用能力和范围。在氘代dmso中测试zn-mpb和l-no2混合物(1:1)的h-h相互作用,发现l-no2的n-h与zn-mpb的其他h有明显的相互作用,说明形成了
(2)超分子探针与ntr相互作用
(3)
在tris-hcl缓冲液(10.0mm,ph7.4,25℃)中进行ntr对
(4)其他生物分子干扰物对
细胞内环境十分复杂,考虑到要将
实施例3:基于辅因子-底物探针平台的细胞实验测试
(1)zn-mpb和l-no2对细胞毒性实验
在96孔板上接种培养细胞,并向细胞中分别加入0,1,2,5,10,20μm的zn-mpb或l-no2进行孵育24h后,通过cck8分析实验(如图4),测试化合物对mcf-7细胞的毒性。
(2)
对不同缺氧程度(20%,8%,0.1%o2)处理6h的癌细胞(包括mcf-7、231和a549细胞)使用
(3)利用
对0.1%o2缺氧处理的各种癌细胞(包括mcf-7、231和a549细胞)使用
实施例4:基于辅因子-底物探针平台的小鼠活体实验测试
将裸鼠腋下注射种瘤,分别建立mcf-7荷瘤小鼠模型,待成瘤后,注射
- 还没有人留言评论。精彩留言会获得点赞!