用于过氧化物酶的超灵敏化学发光底物的制作方法
本发明涉及一种化学发光底物,其用于在测定样品中分析物的测定中测定过氧化物酶,其中该化学发光底物允许以非常高的灵敏度进行定量的过氧化物酶检测。
背景技术:
辣根过氧化物酶(hrp)催化的鲁米诺(luminol)的化学发光氧化在抗原、抗体和核酸的分析测试中,且尤其是在印迹测试例如斑点印迹、蛋白印迹(westernblots)(蛋白质)、dna印迹(southernblots)和rna印迹(northernblots)(核酸)中得到广泛应用。
已知通过加入电子介体或增强剂(enhancer)可以使由hrp催化的鲁米诺的化学发光氧化更快、更有效地进行,如例如由krickalj(1991),clinicalchemistry,37:1472-1481;或由krickalj,voytajc和bronsteini在“chemiluminescentmethodsfordetectingandquantitatingenzymeactivity”(2000),methodsenzymol;305:370-390中所述。
如下描述了增强化学发光反应(ecl)的机制,其中鲁米诺和增强剂被同时氧化[lindj,merenyig和eriksente(1983),jamchemsoc,105:7655-7661]。在ecl的第一步中,根据“乒乓”机制,在hrp的存在下,通过过氧化氢将对于hrp而言比鲁米诺更具活性的底物-增强剂(e)氧化:
hrp+h2o2→hrp-i(1)
hrp-i+e→hrp-ii+e·(2)
hrp-ii+e→hrp+e·(3)
其中e是增强剂,e·是增强剂的单电子氧化的自由基产物,hrp是处于其fe(iii)静止状态的辣根过氧化物酶,hrp-i和hrp-ii是过氧化物酶的氧化中间体,其分别比钙静止状态高两个和一个氧化当量。然后,增强剂的自由基产物(e·)与鲁米诺分子(lh-)可逆地反应[eastonpm,simmondsac,rakisheva,egorovam和candeiaslp(1996),jamchemsoc;118:6619-6624]:
在热力学上,氧化还原平衡(4)的位置由实验条件下增强剂和鲁米诺自由基之间的还原电势之差确定。形成后,两个鲁米诺自由基(l·-)歧化为鲁米诺阴离子(lh-)和二氮杂醌中间体(l):
2l·-→lh-+l(5)
二氮杂醌中间体(l)与过氧化氢反应形成过氧化鲁米诺(lo22-),其随着分子氮的排出而崩溃成3-氨基邻苯二甲酸酯的激发态([ap2-]*)。[ap2-]*然后返回至基态(ap2-),并在425nm处发射光子(hν):
l+h2o2→lo22-→[ap2-]*+n2→ap2-+hν(6)
发射光的强度与鲁米诺自由基(l·-)的生成速率的平方成正比。平方关系是激发物种生成机制的结果,其涉及两个鲁米诺自由基的歧化,等式5。反过来,鲁米诺自由基的生成速率由酶转换速率给定,其由氧化还原平衡(4)后导致鲁米诺自由基(l·-)的经生成自由基的分数加权。酶转换速率由速率确定步骤控制,即将hrp-ii还原为铁酶(hrp),等式(3)。总之,通过考虑(a)通过增强剂与hrp-ii的反应促进酶转换,以及(b)增强剂自由基和鲁米诺之间的可逆电子转移反应,可以很好地近似地描述化学发光的增强。
许多化合物已成功用于增强hrp诱导的化学发光,其包括:萤光素,6-羟基苯并三唑、对碘苯酚、对香豆酸和其他酚类增强剂(thorpeghg和krickalj(1986),methodsenzymol;133:331);芳族胺(美国专利号4,279,950);乙酰苯胺(欧洲专利申请号603953);n-取代的吩噻嗪(美国专利号5,171,688和美国专利美国专利号6,432,662);硼酸(美国专利号5,629,168)。
鲁米诺基底物的化学发光输出方面的一个基础性限制涉及其相对较低的发光量子产率,等式(6)。因为该原因,已经开发出许多鲁米诺类似物,最著名的是8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮,也称为l-012(欧洲专利申请号491477),其具有以下化学结构:
因此,在针对辣根过氧化物酶的对碘苯酚和硼酸盐增强的化学发光测定中,与鲁米诺相比,该化合物显示出光发射增加高达10倍[jix,kondok,aramakiy和krickalj(1996)jbioluminchemilumin;11:1-7]。
最近,在8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮底物中测试了作为增强剂的若干属于洛粉碱类别的化合物。特别地,使用2-(4-羟苯基)-4,5-二(2-吡啶基)咪唑作为增强剂,发现该化学发光系统灵敏度比使用4-碘苯酚的常规增强的鲁米诺系统高20倍[ichibangaset,ohbay,kishikawan,nakashimak和kurodan(2014)luminescence29:118-121]。
然而,基于鲁米诺的技术的最新发展已导致化学发光的hrp底物至少与基于l-012的那些一样灵敏[美国专利号7803573(2010),美国专利号9040252(2015)]。
因此,鉴于化学发光化合物l-012的化学发光效率高于鲁米诺,仍然有足够的潜力进一步增加过氧化物酶检测的灵敏度。
发明目的和概述
本发明的目的是提供一种超灵敏的化学发光底物,其用于在检测样品中的分析物的测定中定量测定过氧化物酶。
根据本发明,由于在所附权利要求中指定的试剂盒而实现了上述目的,其被理解为构成本说明书的组成部分。
根据一个实施方式,本公开涉及一种用于增加由8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮、过氧化物酶、增强剂、共增强剂(co-enhancer)和过氧化物氧化剂的化学发光反应产生的光发射的方法,其中所述增强剂为阴离子n-烷基吩噻嗪且所述共增强剂选自4-二烷基氨基吡啶或n-唑(azole)。
本发明还涉及试剂盒,其用于执行用于增加由如本文公开的8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮的化学发光反应产生的光发射的方法,其中所述试剂盒包含8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮、过氧化物氧化剂、增强剂和共增强剂,其中所述增强剂为阴离子n-烷基吩噻嗪且所述共增强剂选自4-二烷基氨基吡啶或n-唑。
附图说明
现在将参考附图仅以举例的方式描述本发明,其中:
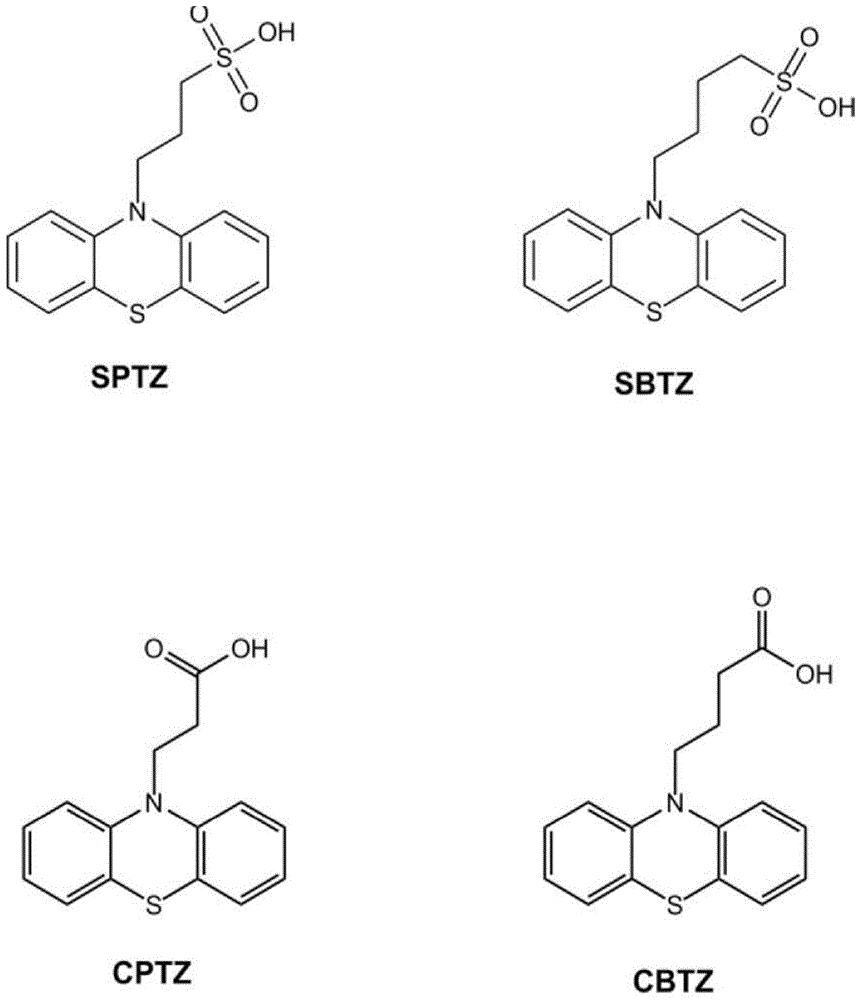
-图1显示了本发明的阴离子n-烷基吩噻嗪增强剂的结构。
-图2显示了l-012/过氧化物/sptz系统的化学发光信号的ph依赖性图。
-图3显示了在共增强剂咪唑(imdz);1-甲基咪唑(mimdz),1,2,3-三唑(triaz),4-吗啉代吡啶(morp),4-二甲基氨基吡啶(dmap)和4-吡咯烷基吡啶(ppy)的存在下,通过sptz和cptz增强的l-012/过硼酸盐底物的初始化学发光信号的柱状图。
-图4显示了化学发光信号对l-012/过硼酸盐/sptz/morp底物中l-012浓度的依赖性。
-图5显示了化学发光信号对l-012/过硼酸盐/sptz/morp底物中sptz浓度的依赖性。
-图6显示了化学发光信号对l-012/过硼酸盐/sptz/morp底物中morp浓度的依赖性。
-图7显示了化学发光信号对l-012/过硼酸盐/sptz/morp底物中过硼酸盐浓度的依赖性。
-图8显示了l-012/过硼酸盐/sptz/morp底物中化学发光信号的ph依赖性。
-图9显示了l-012/过硼酸盐/sptz/咪唑底物中化学发光信号的ph依赖性。
-图10显示了化学发光信号对l-012/过硼酸盐/sptz/morp底物中咪唑浓度的依赖性。
-图11显示了在不存在和存在morp和咪唑共增强剂的情况下,在鲁米诺/过硼酸盐/sptz和l-012/过硼酸盐/sptz底物中初始化学发光信号之间的比较。
-图12显示了l012/b3和鲁米诺/a3底物的化学发光信号随辣根过氧化物酶(hrp)量变化的曲线图。
-图13显示了用l012/b3底物和基于鲁米诺的底物westarsupernova获得的人ikbα的蛋白印迹。
-图14显示了针对l012/b3底物和基于鲁米诺的底物supersignalfemtoelisa的人hdac-1的elisa剂量反应曲线。
发明的详细描述
在以下描述中,给出了许多具体细节以提供对实施方式的透彻理解。可以在没有一个或多个具体细节的情况下,或者采用其他方法、组分、材料等实践所述实施方式。在其他情况下,未详细示出或描述公知的结构、材料或操作,以避免模糊实施方式的方面。
在整个说明书中,对“一个实施方式”或“一实施方式”的提及意味着结合该实施方式描述的特定特征、结构或特性包括在至少一个实施方式中。因此,在整个本说明书中各处出现的短语“在一个实施方式中”或“在一实施方式中”不一定都指的是同一实施方式。此外,在一个或多个实施方式中,可以以任何合适的方式组合特定的特征、结构或特性。
本文提供的标题仅是为了方便,并不解释实施方式的范围或含义。
本公开公开了一种用于执行用于检测样品中的分析物的化学发光测定的方法,其包括:
a.使分析物与分析物检测试剂反应,其中该检测试剂与过氧化物酶直接或间接缀合,形成复合的分析物-检测试剂;
b.使复合的分析物-检测试剂与化学发光底物反应,该化学发光底物包含增强剂、共增强剂、过氧化物氧化剂和8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮,其在化学发光反应中共反应伴随光发射,其中该增强剂为阴离子n-烷基吩噻嗪且该共增强剂选自4-二烷基氨基吡啶和n-唑;以及
c.通过测量光发射来检测该分析物。
在一个实施方式中,本发明涉及用于增加由8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮、过氧化物酶或其缀合物、增强剂、共增强剂和过氧化物氧化剂的化学发光反应产生的光发射的方法,其中该增强剂为阴离子n-烷基吩噻嗪且该共增强剂选自4-二烷基氨基吡啶或n-唑,其中该方法包括以下步骤:
(i)通过将8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮、增强剂、共增强剂和过氧化物氧化剂混合在一起来实现化学发光底物,以及
(ii)将过氧化物酶或其缀合物加至该化学发光底物。
在一个实施方式中,阴离子n-烷基吩噻嗪选自3-(10h-吩噻嗪-10-基)丙烷-1-磺酸(sptz)、4-(10h-吩噻嗪-10-基)丁烷-1-磺酸(sbtz)、3-(10h-吩噻嗪-10-基)丙酸(cptz)和4-(10h-吩噻嗪-10-基)丁酸(cbtz)及其盐。这些n-烷基吩噻嗪的化学结构在图1中示出。
共增强剂或第二增强剂定义为本身对鲁米诺或其类似物的化学发光反应没有增强作用,但与增强剂结合使用时其增加光输出的化合物,参见marzocchie,grillis,dellacianal,prodil,mirasolim和rodaa(2008)analbiochem,377:189-194;vdovenkomm,dellacianal和sakharoviy(2009)analbiochem,392:54-58。光输出的增加归因于过氧化物酶酶转换的相应增加,参见sakharoviy和vdovenkomm(2013)analbiochem,434:12-14。
本发明的共增强剂属于两类不同的化合物:4-二烷基氨基吡啶(如us7,803,573中所述)和n-唑(如us9,040,252中所述)。在4-二烷基氨基吡啶中,优选的化合物是4-吗啉代吡啶(morp)、4-二甲基氨基吡啶(dmap)和4-吡咯烷基吡啶(ppy)。在n-唑中,优选的化合物是咪唑和1-甲基咪唑。
过氧化物氧化剂可以是过氧化氢或过氧化氢的任何复合物,其溶解在水溶液中后释放过氧化氢,例如过硼酸盐、过碳酸盐或摩尔比等于1:1的尿素/过氧化氢复合物。在一个优选实施方式中,过氧化物氧化剂选自过氧化氢、尿素/过氧化氢复合物、过硼酸盐、过碳酸盐。
过氧化物酶是适合用于化学发光测定的任何过氧化物酶。根据一个实施方式,过氧化物酶选自辣根过氧化物酶(例如sigmavia或ix型),或阴离子过氧化物酶,如大豆过氧化物酶和甘薯过氧化物酶。过氧化物酶可以与待检测分析物的检测试剂缀合或不缀合。
根据一个实施方式,化学发光底物中的化学发光化合物8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮的浓度在0.01mm和1mm之间,优选0.05和0.5mm之间。
根据一个实施方式,化学发光底物中的阴离子n-烷基吩噻嗪增强剂的浓度包含在0.1和10mm之间,优选0.5和5mm之间。
根据一个实施方式,化学发光底物中的共增强剂的浓度包含在0.1和100mm之间,优选0.5和50mm之间。
根据一个实施方式,化学发光底物中的过氧化物的浓度包含在0.1和10mm之间,优选0.5和8mm之间。
根据一个实施方式,化学发光底物的ph包含在5.0和9.0之间,优选6.0和8.5之间。
根据一个优选实施方式,具有包含在5.0和9.0之间,优选6.0和8.5之间的ph的化学发光底物含有:
i)8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮,其浓度在0.01mm和1mm之间,优选0.05和0.5mm之间;
ii)阴离子n-烷基吩噻嗪增强剂,其浓度在0.1和10mm之间,优选0.5和5mm之间;
iii)共增强剂,其浓度在0.1和100mm之间,优选0.5和50mm之间;
iv)过氧化物氧化剂,其浓度在0.1和10mm之间,优选0.5和8mm之间。
根据一个实施方式,该方法还包括通过测量由8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮、过氧化物酶、过氧化物氧化剂、增强剂和共增强剂的化学发光反应产生的光发射来检测样品中的分析物的步骤。
本发明还涉及一种用于执行如本文公开的用于增加由8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮的化学发光反应产生的光发射的方法的试剂盒,其中该试剂盒包含8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮、过氧化物氧化剂、增强剂和共增强剂,其中该增强剂为阴离子n-烷基吩噻嗪且该共增强剂选自4-二烷基氨基吡啶或n-唑。
在一个实施方式中,阴离子n-烷基吩噻嗪选自3-(10h-吩噻嗪-10-基)丙烷-1-磺酸、4-(10h-吩噻嗪-10-基)丁烷-1-磺酸、3-(10h-吩噻嗪-10-基)丙酸和4-(10h-吩噻嗪-10-基)丁酸,及其盐。
在一个实施方式中,共增强剂选自咪唑、1-甲基咪唑、4-吗啉代吡啶(morp)、4-二甲基氨基吡啶(dmap)和4-吡咯烷基吡啶(ppy)。
在一个实施方式中,过氧化物氧化剂选自过氧化氢、摩尔比为1∶1的尿素和过氧化氢复合物、过硼酸盐、过碳酸盐。
在另一个实施方式中,试剂盒还包含过氧化物酶。优选地,过氧化物酶选自辣根过氧化物酶、大豆过氧化物酶和甘薯过氧化物酶。在不同实施方式中,过氧化物酶(或其缀合物)可以由最终使用者添加。
在一个实施方式中,试剂盒含有第一小瓶中的8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮和第二小瓶中的过氧化物氧化剂,并且其中增强剂和共增强剂存在于第一小瓶或第二小瓶或两个小瓶中。
试剂盒试剂以液态或固态存在于小瓶中。如果试剂盒试剂为固态,则它们可以粉末或片剂形式存在,并且在使用时必须通过添加水或缓冲溶液而在液相中重构。
最好在不同的小瓶中配制8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮和过氧化物氧化剂,以延长其保存期限。可以将增强剂和共增强剂以及其他添加剂(例如螯合剂和稳定剂)添加至8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮或过氧化物氧化剂小瓶,或两个小瓶中。这两个小瓶还含有缓冲物质,其在混合后会产生化学发光底物或“工作溶液”,其ph值适合进行测定。
如果试剂盒中存在过氧化物酶或其缀合物,则其不与其底物成分(即过氧化物氧化剂)一起存储,而是存储在第三小瓶中。
术语“测定”是指分析物的半定量和定量检测。通常,测定的实施需要将光输出与所使用的过氧化物酶的量相关联。因此检测或测量光发射以使得分析物的存在或量与光的产生有关。
根据本公开,测定的实施需要将由与过氧化物酶、增强剂、共增强剂和过氧化物氧化剂反应的化学发光化合物的化学发光反应产生的光输出与任何反应伴侣(即(8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮、过氧化物酶、过氧化物氧化剂、增强剂和共增强剂中的任何一种)的量相关联。根据一个优选实施方式,光输出与所使用的过氧化物酶的量相关联。
在进行用于检测目的分析物(定性或定量方式)的测定中,过氧化物酶为与待检测分析物的检测试剂的缀合物形式。根据待检测的分析物的种类,检测试剂可以选自抗体、核苷酸、寡核苷酸或核酸分子。与过氧化物酶缀合的检测试剂可以是能够特异性结合分析物的检测试剂,或是能够结合特异性结合分析物的检测试剂的第二检测试剂。
本发明的化学发光反应适用于检测和定量分析物,例如使用分析物(例如蛋白质或核酸分子)和固体支持物(例如膜或微量滴定板)之间的键形成,并使用过氧化物酶作为示踪剂。通过将如本文公开的化学发光底物添加至固体支持物(先前与含分析物的样品反应),然后将含过氧化物酶的溶液添加至固体支持物来引发发光反应。光发射是长期的,并可通过胶卷、照相机或其他仪器进行测量。
根据本发明的基于化学发光底物的化学发光测定包括针对蛋白质的斑点印迹和蛋白印迹测定以及针对核酸的dna和rna印迹测定。
根据本公开的基于化学发光底物的印迹测定使用凝胶电泳来将目标分析物(蛋白质或核酸分子)与存在于待测样品中的其他组分(其他蛋白质或其他核酸分子)相分离。然后将分析物和其他组分转移到膜上,在此使用如本文公开的化学发光底物和能够特异性结合目标分析物的检测试剂对其进行探测(检测),其中检测试剂与过氧化物酶缀合。
在实施例12中描述了使用本发明的基于l-012的底物(b3/实施例10)和市售的基于鲁米诺的底物(cyanagen的westarsupernova)获得的蛋白印迹之间的比较。如图13中所示,本发明的基于l-012的底物允许检测相对于基于鲁米诺的底物的大约另外三个带。
基于本发明化学发光底物的化学发光测定还包括酶免疫测定(eia),如例如elisa测定。酶免疫测定特别适用于检测样品中极少量的分析物,例如肿瘤标志物、甲状腺激素、病毒蛋白(例如hiv、hcv、hpv蛋白)或类固醇激素(例如雌二醇、醛固酮)。进行用于检测分析物的elisa分析涉及至少一种对目标分析物具有特异性的检测试剂。将样品中的分析物非特异性地(通过吸附至固体支持物表面)或特异性地(通过由另一种对相同分析物特异的检测试剂捕获至固体支持物表面,在“夹心elisa”中)固定在固体支持物(通常是聚苯乙烯微量滴定板)上。在将分析物固定在固体支持物表面上之后,添加检测试剂,与分析物形成复合物。检测试剂可以与作为示踪剂的过氧化物酶共价连接,或者本身可以由通过(生物)缀合(例如经由生物素或链霉亲和素)与过氧化物酶连接的第二检测试剂检测。在每个步骤之间,通常用温和的清洁剂溶液洗涤板,以去除未特异性结合的任何蛋白质或抗体。在最后的洗涤步骤之后,通过添加本文所述的化学发光底物使板显影,并且,在检测试剂未直接与过氧化物酶缀合的情况下,溶液含有与第二检测试剂缀合的过氧化物酶以产生光信号,其指示样品中分析物的量。
实施例13描述了人hdac-1elisa测定,其中采用本发明的基于l-012的底物(b3/实施例10)和可商购的基于鲁米诺的底物(thermoscientific的supersignalfemtoelisa)进行检测。从图14中可以看出,就灵敏度而言,本发明的l-012/b3底物优于基于鲁米诺的底物约五倍。
根据本发明采用sptz增强的l-012化学发光底物产生的化学发光信号比经优化的luminol/sptz底物高约三倍,如实施例1、图2中所示。实施例3至11说明了将共增强剂添加至l-012化学发光底物的效果,所述l-012化学发光底物在选自4-二烷基氨基吡啶和n-唑的共增强剂的存在下采用阴离子n-烷基吩噻嗪进行增强。
由3-(10'-吩噻嗪基)丙烷-1-磺酸盐(sptz)增强的l-012/过氧化物/过氧化物酶化学发光反应的ph依赖性(实施例1)
hrp的最适ph在6.0至6.5范围内。7.5处的活性为最大活性的84%。该酶在5.0至9.0的ph范围内最稳定[schomberg等,enzymehandbook7,ec1.11.1.7:1–6(1993)]。另一方面,通过过氧化物的鲁米诺的非酶促化学发光氧化对于毫摩尔过氧化物浓度而言在约ph11.0下达到其最大效率[merenyig.和lindjohans."roleofaperoxideintermediateinthechemiluminescenceofluminol.amechanisticstudy."journaloftheamericanchemicalsociety102.18(1980):5830-5835]。过氧化物酶催化的增强的鲁米诺化学发光氧化对于典型的增强剂如对碘苯酚[thorpe等,"phenolsasenhancersofthechemiluminescenthorseradishperoxidase-luminol-hydrogenperoxidereaction:applicationinluminescence-monitoredenzymeimmunoassays."clinicalchemistry31.8(1985):1335-1341],对碘苯硼酸[kricka等,"synthesisandcharacterizationof4-iodophenylboronicacid:anewenhancerforthehorseradishperoxidase-catalyzedchemiluminescentoxidationofluminol."analyticalbiochemistry240.1(1996):119-125]以及最近的3-(10’-吩噻嗪基)丙烷-1-磺酸盐(sptz)[marzocchi等,"chemiluminescentdetectionsystemsofhorseradishperoxidaseemployingnucleophilicacylationcatalysts."analyticalbiochemistry377.2(2008):189-194]而言在ph8.4-8.6下最为有效。该8.4-8.6的最佳ph是hrp的最佳转换(6.0-6.5)和鲁米诺的过氧化物氧化(ph11.0)之间的折衷。
与鲁米诺体系相反,由3-(10'-吩噻嗪基)丙烷-1-磺酸盐(sptz)增强的l-012/过氧化物/过氧化物酶化学发光反应在ph7.2或以下达到其最佳,图2。
在共增强剂的存在下,l-012/过氧化物/sptz底物中化学发光信号的ph依赖性(实施例7和8)
向l-012/过氧化物/sptz底物中添加共增强剂(morp,实施例7;咪唑,实施例8)对化学发光信号的最佳ph值没有影响,其仍以约ph7.0为中心(morp,图9;咪唑,图10)。再次,这与相应的鲁米诺/过氧化物/sptz/共增强剂底物形成了鲜明的对比(morp,最佳ph值为ph9.0[];咪唑,最佳ph:8.6[]。
化学发光信号对l-012/过硼酸盐/sptz/morp底物中l-012浓度的依赖性(实施例3)
鲁米诺和l-012底物之间的另一显著差异是达到最佳信号水平所需的化学发光材料量要少得多。例如,在实施例3的l-012/过硼酸盐/sptz/morp底物中(实施例3),仅仅约0.15mm的l-012浓度足以达到信号输出的平稳水平,图4。在具有l-012的其他配方(例如l-012/过硼酸盐/sptz/咪唑底物)中观察到类似的行为。另一方面,优化的鲁米诺底物(鲁米诺/a1-a3底物实施例10)需要远高浓度的鲁米诺,5.0mm。因此,l-012底物所需的化学发光材料比鲁米诺基底物少33倍。
化学发光信号对l-012/过硼酸盐/sptz/morp底物中sptz浓度的依赖性(实施例4)
在共增强剂为morp的l-012/过硼酸盐底物中,包含2和3mmol之间的sptz增强剂时的信号水平达到峰值,图5。采用咪唑作为共增强剂获得了相似的结果。
化学发光信号对l-012/过硼酸盐/sptz/共增强剂(morp;咪唑)底物(实施例5,morp;实施例9,咪唑)中共增强剂浓度的依赖性
诸如morp和咪唑的共增强剂对采用sptz增强的l-012/过硼酸盐底物具有非常强大的作用。两种共增强剂均将光输出增加了超过一个数量级18倍(morp,图6;咪唑,图10)。与咪唑相比,达到信号输出平稳所需的morp要少得多(3mm对50mm),但咪唑对光输出的影响要强得多。
化学发光信号对l-012/过硼酸盐/sptz/morp底物中过硼酸盐浓度的依赖性(实施例6)
在实施例6,图7中,观察到在l-012/过硼酸盐/sptz/morp底物中实现最大信号所需的过硼酸盐量约为6mm。在过硼酸盐值高于7mm时,信号输出开始下降。针对l-012/过硼酸盐/sptz/咪唑底物记录了相似的结果。
l-012和鲁米诺化学发光过氧化物酶底物之间的比较(实施例10)
当将本发明的基于l-012的化学发光底物与优化的鲁米诺底物进行比较时,出现了若干主要差异。特别是:(a)l-012底物的最佳ph比鲁米诺底物的最佳ph低1.5至2个ph单位之间;(b)l-012的有效浓度比鲁米诺的有效浓度低30倍以上;(c)与sptz增强的底物相比,sptz增强的l-012底物中的共增强剂的效果要强得多(图11);(d)本发明的l-012底物的化学发光光输出强度比可用的巢式(nest)鲁米诺底物高一个数量级。
结论
出乎意料的是,在l-012化学发光底物中共增强剂的效果比在鲁米诺化学发光底物中要高得多。加入咪唑作为共增强剂后,优化的鲁米诺/sptz底物的化学发光信号增加了8倍,而morp产生的信号增加为10倍。相比之下,如实施例10和图11中所示,在l-012/sptz化学发光底物中包含这些共增强剂使信号输出增加了约40倍(咪唑)和23倍(morp)。
因此,根据本公开的l-012化学发光底物实现了比最有效的已知鲁米诺底物高一个数量级(7-12x)的信号水平。
下列实施例用于说明本发明的具体方面。然而,它们无意限制本发明。
实施例
本申请中使用的所有试剂均购自sigma-aldrich,tcieurope和panreac。
根据本领域技术人员的公知常识合成sptz和cptz增强剂。sptz:marzocchie,grillis,dellacianal,prodil,mirasolim和rodaa(2008)analbiochem,377:189-194;cptz:han,f,chi,l,wu,w,liang,x,fu,m和zhao,j.photochem.photobiol.a:chemistry196.1(2008):10-23。
采用微孔板、多标记光谱仪victor3(perkin-elmer)以发光模式(无发射滤片)进行化学发光测量。使用黑色96孔微孔板(optiplate-96f)。
制备hrp测试溶液,用缓冲液(浓度:6ng/ml)将15μl辣根过氧化物酶(hrp)储备溶液(20mg/l)稀释至50ml。将28μlhrp添加至每个孔(最终孔内体积228μl)。因此,每个孔中的hrp最终量为168pg。
实施例1-不同水平的3-(吩噻嗪-10-基)丙烷-1-磺酸钠(sptz)增强剂下的l-012/过氧化物/过氧化物酶化学发光反应的ph依赖性
制备了具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4mm
[sptz]=0.1mm
在ph7.2-8.0的50mmtris/30mm磷酸盐缓冲液中。
作为参考底物,制备了以下溶液:
[鲁米诺]=5mm
[过硼酸钠]=4mm
[sptz]=1.5mm
在ph9.0的150mmtris缓冲液中。
将初始信号水平相对于ph作图,图2(参考底物的信号设为1)。
实施例2-筛选l-012/过氧化物/过氧化物酶化学发光反应的共增强剂
制备了具有以下组成的化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4mm
[sptz]=1mm;[cptz]=1mm(增强剂)
在ph7.9的50mmtris/30mm磷酸盐缓冲液中。
[共增强剂]=1mm
如图3中所示,将每种共增强剂:咪唑、1-甲基咪唑、1,2,3-三唑、4-吗啉代吡啶(morp)、4-二甲基氨基吡啶(dmap)、4-吡咯烷基吡啶(ppy)的初始信号水平绘制为柱状图。
实施例3-化学发光信号对l-012/过硼酸盐/sptz/morp底物中l-012浓度的依赖性
制备了具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4mm
[sptz]=3mm(增强剂)
[morp]=3mm(共增强剂)
在ph7.9的50mmtris/30mm磷酸盐缓冲液中。
如图4中所示,将初始信号水平相对于l-012浓度作图。
实施例4-化学发光信号对l-012/过硼酸盐/sptz/morp底物中sptz浓度的依赖性
制备了具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4mm
[sptz]=1-10mm(增强剂)
[morp]=3mm(共增强剂)
在ph7.9的50mmtris/30mm磷酸盐缓冲液中。
如图5中所示,将初始信号水平相对于sptz浓度作图。
实施例5-化学发光信号对l-012/过硼酸盐/sptz/morp底物中morp浓度的依赖性
制备了具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4mm
[sptz]=3mm(增强剂)
[morp]=0-6mm(共增强剂)
在ph7.9的50mmtris/30mm磷酸盐缓冲液中。
如图6中所示,将初始信号水平相对于morp浓度作图。
实施例6-化学发光信号对l-012/过硼酸盐/sptz/morp底物中过硼酸盐浓度的依赖性
制备了具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=0.5-8.0mm
[sptz]=3mm(增强剂)
[morp]=3mm(共增强剂)
在ph7.9的50mmtris/30mm磷酸盐缓冲液中。
如图7中所示,将初始信号水平相对于过硼酸盐浓度作图。
实施例7-l-012/过硼酸盐/sptz/morp底物中化学发光信号的ph依赖性
制备了具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4mm
[sptz]=3mm(增强剂)
[morp]=3mm(共增强剂)
ph5-9(tris缓冲液)
如图8中所示,将初始信号水平相对于过硼酸盐浓度作图。
实施例8-l-012/过硼酸盐/sptz/咪唑(imdz)底物中化学发光信号的ph依赖性
制备了具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4mm
[sptz]=3mm(增强剂)
[imdz]=50mm(共增强剂)
ph范围6.3-8.1
如图9中所示,将初始信号水平相对于ph作图。
实施例9-化学发光信号对l-012/过硼酸盐/sptz/imdz底物中咪唑(imdz)浓度的依赖性
制备了具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4mm
[sptz]=3mm(增强剂)
[imdz]=0-100mm(共增强剂)
在ph7.1的50mmtris缓冲液中。
如图10中所示,将初始信号水平相对于咪唑(imdz)浓度作图。
实施例10-用于过氧化物酶的鲁米诺和l-012化学发光底物之间的比较
制备了以下化学发光底物:
鲁米诺底物
鲁米诺/a1(no:无共增强剂;信号设为1)
[鲁米诺]=5mm
[过硼酸盐]=4mm
[sptz]=3mm
tris缓冲液150mm,ph9.0
鲁米诺/a2(imdz:咪唑作为共增强剂)
[鲁米诺]=5mm
[过硼酸盐]=4mm
[sptz]=3mm
[imdz]=35mm
tris缓冲液150mm,ph9.0
鲁米诺/a3(morp:4-吗啉代吡啶作为共增强剂)
[鲁米诺]=5mm
[过硼酸盐]=4mm
[sptz]=3mm
[morp]=3mm
tris缓冲液150mm,ph9.0
l-012底物
l012/b1(no:无共增强剂)
[l-012]=0.15mm
[过硼酸盐]=4mm
[sptz]=3mm
tris-磷酸盐缓冲液50/30mm,ph7.1
l012/b2(imdz:咪唑作为共增强剂)
[l-012]=0.15mm
[过硼酸盐]=7mm
[sptz]=2mm
[imdz]=100mm
tris缓冲液50mm,ph7.1
l012/b3(morp:4-吗啉代吡啶作为共增强剂)
[l-012]=0.15mm
[过硼酸盐]=4mm
[sptz]=3mm
[morp]=3mm
50mmtris/30mm磷酸盐缓冲液,ph7.9。
记录每个底物的初始化学发光信号水平。无共增强剂的鲁米诺过硼酸盐/sptz产生的信号作为参考信号(ref),将其值设为1(unity)。
鲁米诺底物:no(a1)=ref设为1;imdz(a2)=8;morp(a3)=10
l-012底物:no(b1)=3;imdz(b2)=115;morp(b3)=70
如图11中所示,将结果绘制为柱状图。
实施例11-化学发光底物l-012/b3和化学发光底物鲁米诺/a3的化学发光信号vshrp浓度
如实施例11中所述制备化学发光底物l-012/b3和鲁米诺/a3。将200μl的这些底物分配在96孔板的每个孔中。将辣根过氧化物酶(hrp)(20μg/ml)稀释以获得1600ng/ml溶液,然后使用victor3(perkin-elmer)多标记读板器的自动泵系统自其将各种等分试样分配到每个孔中,以实现一系列稀释,跨度范围为30-300ng/l。板中的第1列用作空白(仅底物,不添加酶)。如图12中所示,相对hrp浓度绘制了两种底物的初始信号。计算出每种底物的回归线。l-012/b3底物的回归斜率比鲁米诺/a3底物高约7倍,而两种底物的测量背景信号相似。
实施例12-人ikbα蛋白印迹测定
在电泳还原样品缓冲液中将纯化的人ikbα(b细胞抑制蛋白中kappa轻多肽基因增强子的核因子,α;abcam)稀释至1.5ng/ml,并进行1.5倍稀释。通过sds-page分离每种稀释液5μl,并采用
实施例13-人hdac-1elisa测定
在ph9.6的50mm碳酸盐/碳酸氢盐缓冲液中稀释兔抗人hdac-1(abcam),并制备了从20ng/ml起始至19.9pg/ml的两倍稀释液。将具有透明平底聚苯乙烯(corning)的96黑色微孔板在4℃下以50μl/孔涂布过夜。除去涂布溶液,并用200μl/孔的pbs-tween0.01%将板洗涤6次。向每个孔中加入100μl的pbs-tween0.01%中的3%ecl封闭剂(gehealthcare),并将板在室温下孵育1小时。在pbs-tween0.01%中短暂洗涤,去除封闭缓冲液,在室温下将100μl稀释为0.4μg/ml浓度的山羊抗兔-hrp(abcam)添加至每个孔中,持续30分钟。除去山羊抗兔-hrp溶液,并用200μl/孔的pbs-tween0.01%将板洗涤6次。将200μl化学发光底物(l012/b3,实施例11;supersignalelisafemto,thermoscientific生产的基于鲁米诺的底物)添加到每个孔中,并在60和120秒时用perkinelmervictor3分析仪分析该板。图14中显示了相对人hdac-1(pg)的信噪比(s/n)。
自然地,尽管本发明的原理保持相同,但是构造的细节和实施方式可以相对于通过实例的方式描述和示出的内容而广泛地变化,而不脱离如所附权利要求书所限定的本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!