本申请涉及纳米晶荧光检测领域,尤其涉及一种细胞内超氧自由基检测用纳米晶材料及其制备方法和检测试剂盒。
背景技术:
超氧自由基(o2·-)是细胞内氧气发生单电子还原反应产生的活性氧自由基(ros)产物。细胞内多种蛋白质和酶参与了上述反应,包括线粒体呼吸链复合物i-iv、nadph氧化酶、黄嘌呤氧化酶、环氧合酶等。产生的o2·-在细胞内短暂驻留或传递,随后与细胞内多种还原性物质或生物大分子发生化学反应,进行相关的氧化还原信号调控。例如,o2·-在sod的歧化作用下,生成h2o2,通过h2o2对nox蛋白的活性进行调控,进而调控细胞的增殖。当机体产生过量o2·-后,可以激活细胞的自噬或凋亡信号通路,导致细胞死亡,最终引发多种疾病。例如,细胞内的o2·-与no反应,迅速生成onoo-,过量的onoo-可以激活caspase凋亡蛋白或引起脂质过氧化,导致细胞的凋亡或坏死。因此,发展高灵敏、高选择性的o2·-检测技术,对o2·-的浓度变化进行动态监测,可以揭示o2·-浓度的变化规律,剖析相关疾病发生发展的分子机制,发现疾病治疗靶点。
目前,检测o2·-的方法较多,包括esr、紫外分光光度法、高效液相色谱法、质谱法等。但是上述方法据需要将细胞或组织离体破碎后进行体外检测,存在样品预处理过程干扰检测结果及检测操作复杂等问题。荧光成像方法具有高灵敏、高时空分辨、易操作等优势。因此为了实现对细胞内o2·-真实浓度检测,原位荧光成像分析方法成为最理想的手段。而应用该方法的关键问题是发展检测o2·-荧光探针。
通过溶剂热或者高温热解等方法合成的纳米材料表面都会存在疏水层,虽然疏水层可以充当无机纳米核心与周围环境之间的屏障,有效地保护和稳定了稀土氟化物的发光性能,但也存在一些问题,如不溶于水或生物缓冲液,限制了其在生物成像、药物递送和生物检测等。因此,这些疏水性的稀土氟化物纳米晶材料能够应用于生物领域的先决条件就是对其进行表面修饰或者表面改性,使其呈现水溶性。
技术实现要素:
为了解决上述的技术问题,本申请的目的是提供一种高水溶性的下转换发光纳米晶材料,由peg包覆kbi3f10:ce/tb或kbi3f10:ce/eu纳米晶构成。本申请中的纳米晶材料是通过三价铈离子在紫外激发条件下的能量传递,实现激活离子tb3+或eu3+的下转移发光。且本申请还通过peg对该纳米晶进行了表面修饰,使其获得高水溶性、良好的生物兼容性和分散性,结合其下转换发光光学性能,能够很好的实现其在生物医学方面作为荧光探针的应用,具有高灵敏、高时空分辨、易操作等优势。
为了实现上述的目的,本申请采用了以下的技术方案:
一种高水溶性的下转换发光纳米晶材料,该纳米晶材料的纳米晶分子式如下:kbi3f10:ce/tb@peg或kbi3f10:ce/eu@peg。
优选,该纳米晶材料为水溶性材料,由peg包覆kbi3f10:ce/tb或kbi3f10:ce/eu纳米晶构成。
优选,kbi3f10:ce/tb@peg纳米晶为kbi3f10:20ce/10tb@peg,kbi3f10:ce/eu@peg纳米晶为kbi3f10:20ce/6eu@peg。
进一步,本申请提供了一种高水溶性的下转换发光纳米晶材料的制备方法,该方法包括以下的步骤:
1)1毫摩尔硝酸钾kno3,2.1毫摩尔硝酸铋bi(no3)3∙5h2o,0.6毫摩尔硝酸铈ce(no3)3∙5h2o,0.3毫摩尔硝酸铽tb(no3)3∙5h2o或0.18毫摩尔硝酸铕eu(no3)3∙5h2o溶于6毫升去离子水中,搅拌20分钟后,加入8毫摩尔氟化铵(nh4f)和40毫升聚乙二醇;
2)搅拌1小时后,在油浴锅120℃条件下,加热12小时,加热过程中及时补充去离子水;3)产物用乙醇和去离子水的混合液洗涤3-5次;
4)将1gpeg溶于25ml去离子水中,将15ml步骤3)中的产物加入该溶液中,在室温条件下,磁力搅拌10分钟;
5)将上述混合物密封在50ml的高压反应釜中,在180℃条件下,加热24小时,待反应釜冷却到室温通过离心获得peg包覆的纳米晶材料。
进一步,本申请提供了所述纳米晶材料用于胞内超氧自由基的检测应用。
进一步,本申请提供了一种细胞内超氧自由基荧光检测探针,该荧光检测探针包括所述纳米晶材料。
进一步,本申请提供了一种细胞内超氧自由基荧光检测试剂盒,该试剂盒包括所述的荧光检测探针。
本申请由于采用了上述的技术方案,通过一种溶剂热法制备出立方相kbi3f10:ce/tb与kbi3f10:ce/eu纳米晶,并在其表面修饰了聚乙二醇,使其获得良好的生物兼容性和高水溶性,减少了纳米晶与生物环境之间的相互作用,能够很好的分散在水溶液中和与生物组织兼容。当纳米晶作为荧光探针进入体内细胞,三价ce3+离子能与超氧自由基o2·-反应被氧化成四价ce4+,导致tb3+离子与eu3+离子在紫外激发条件下的下转换发光强度明显减弱,且减弱的幅度与o2·-浓度相关。通过拟合tb3+离子或者eu3+离子的发光强度与o2·-浓度的关系曲线,并结合荧光成像分析,能够很好地应用于细胞内超氧自由基o2·-的定性定量检测。
附图说明
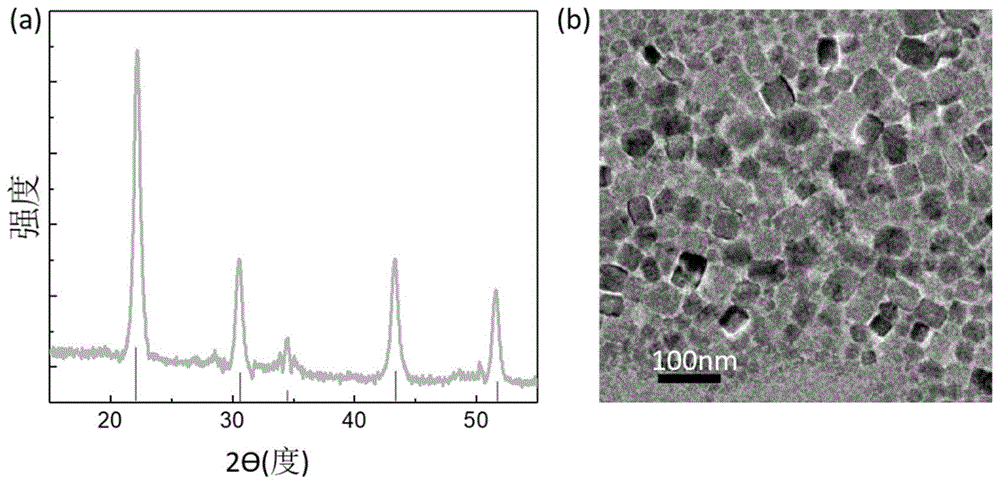
图1(a)和(b)分别为产物的xrd图谱和透射电子显微镜图。
图2(a)kbi3f10:20ce/10tb纳米晶中tb3+离子在紫外区域的激发谱,(b)kbi3f10:20ce/10tb纳米晶在紫外激发条件下的发射谱,产物在紫外激发条件下的发光强度随敏化离子ce3+(c)与激活离子tb3+(d)的变化关系曲线。
图3kbi3f10:20ce/10tb@peg纳米晶的发光强度随超氧自由基o2·-浓度变化的关系曲线。
图4细胞毒性实验。
图5细胞荧光成像。
图6(a)kbi3f10:20ce/6eu@peg纳米晶在紫外激发条件下的发射谱,(b)产物在紫外激发条件下的发光强度随超氧自由基o2·-浓度变化的关系曲线。
具体实施方式
1实验部分
1.1主要仪器和试剂:
硝酸钾(99.0%),硝酸铋(98.0%),硝酸铈(99.9%),硝酸铽(99.9%),硝酸铕(99.9%),氟化铵(99.99%)、乙二醇(99.8%)购买于sigma-aldrich公司,无水乙醇、超氧化钾、二巯基乙醇(2-me)、钛铁试剂(trion)和二甲亚砜(dmso)购买于国药集团化学试剂有限公司,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(mtt)购买于碧云天试剂有限公司。
1.2kbi3f10:ce/tb@peg纳米晶的制备
以kbi3f10:20ce/10tb@peg为例,1毫摩尔硝酸钾(kno3),2.1毫摩尔硝酸铋(bi(no3)3∙5h2o),0.6毫摩尔硝酸铈(ce(no3)3∙5h2o),0.3毫摩尔硝酸铽(tb(no3)3∙5h2o)溶于6毫升去离子水中,搅拌20分钟后,加入8毫摩尔氟化铵(nh4f)和40毫升聚乙二醇,搅拌1小时后,在油浴锅120℃条件下,加热12小时,加热过程中及时补充去离子水。产物用乙醇和去离子水的混合液洗涤3-5次。将1gpeg溶于25ml去离子水中,将15ml产物加入该溶液中,在室温条件下,磁力搅拌10分钟;将上述混合物密封在50ml的高压反应釜中,在180℃条件下,加热24小时,待反应釜冷却到室温通过离心获得peg包覆的纳米晶材料。
不同浓度的离子掺杂样品或eu离子掺杂的样品,通过改变前驱溶液中相应的离子浓度或种类来实现。
1.3表征仪器
x射线衍射图谱(brukerd8advance,cu-kα(λ=1.5405å)),透射电子显微镜(tem,feitecnaig2f20),光谱仪(flurohub-b,horibajobinyvon),紫外灯功率为50w,电感耦合等离子体原子发射仪(perkinelmeroptima3300dv)。
x射线衍射样品的制备:将烘干的纳米晶铺满样品支架的凹槽;
透射电子显微镜样品的制备:将每次合成的全部纳米晶溶于4毫升乙醇溶液中,超声5分钟后,滴3-6滴液体于超薄碳膜上。
o2•−配制和检测:o2•−是将ko2溶于dmso中制成。将纳米晶溶于水溶液,分成若干组,将不同浓度的o2•−等体积加入到纳米晶水溶液中,通过荧光光谱仪表征其荧光变化的性能,并拟合出标准曲线。
1.4细胞毒性实验和荧光成像
利用mtt试剂进行了l929细胞毒性试验。选取五个不同浓度梯度的纳米晶(1000μm,100μm,10μm,1μm,0.1μm)分别孵育l929细胞12h。使用酶标仪测量吸光度。
成像实验中用纳米晶孵育l929细胞,然后利用2-me刺激l929细胞,使细胞内o2•−浓度增加,利用tiron清除细胞内o2•−进行荧光成像分析。
2.数据分析与讨论
kbi3f10:20ce/10tb产物的x射线衍射图谱如图1a所示,所有衍射峰均与标准pdf卡片jcpds41-0842号一一对应,且无多余的衍射峰,表明本申请得到的产物为纯立方相kbi3f10。透射电子显微镜分析结果表明产物为片状,分散性良好。
如图2a所示,激发谱为典型的ce3+:4f→5d宽谱带跃迁峰,最佳激发波长约为350nm。在紫外激发条件下,产物在绿光区域表现出明亮的下转移发光,对应于tb3+离子的f→f跃迁(图2b)。随着敏化离子ce3+离子浓度从10增到20mol%,纳米晶的吸收能力增大,因此发光强度显著增强,当ce3+离子浓度超过20mol%,敏化离子与激活离子之间的无辐射交叉弛豫几率增大,导致发光强度下降(图2c)。与之类似,tb3+离子的最佳掺杂浓度约为10mol%(图2d)。kbi3f10:20ce/10tb纳米晶的荧光量子效率高达56%。
如图3所示,当溶液中加入o2•−后,在紫外激发条件下,tb3+离子的发光强度明显减弱,且在0至10微摩尔/升的范围内单调下降,能够很好地应用于o2•−的定量检测。检测极限约为0.02微摩尔/升,能够很好的荧光响应o2•−。以上机理解释如下:当kbi3f10:20ce/10tb@peg纳米晶水溶液中加入o2•−后,三价ce3+离子被氧化成四价ce4+离子,导致纳米晶在紫外区域的吸收能力大幅减弱,ce3+→tb3+的能量传递效率也明显下降,最终导致tb3+离子的发光减弱。
如图4所示,实验结果显示,kbi3f10:20ce/10tb@peg纳米晶的存在对细胞成活率无明显影响,而且计算纳米晶的半抑制率为5.13mm。因此说明使用远低于ic50浓度的纳米晶进行细胞成像实验,是安全可靠的。如图5所示,成像实验中发现o2•−浓度增加时,细胞内绿色荧光降低(5b),o2•−浓度降低时细胞内绿色荧光增强(5a),说明kbi3f10:20ce/10tb@peg纳米晶能够高选择性检测细胞内的o2•−。
为了验证本实验方案的通用性,本申请进一步制备了水溶性kbi3f10:20ce/6eu@peg纳米晶。如图6a所示,产物在紫外激发条件下,表现出eu3+特有的发射峰。与tb3+离子类似,当溶液中加入o2•−后,在紫外激发条件下,eu3+离子的发光强度明显减弱,且在0至10微摩尔/升的范围内单调下降图(6b)。这一结果表明三价稀土铈离子敏化的纳米晶能够很好地应用于o2•−的定量检测。
3.结论
本申请通过溶剂热法和表面修饰peg制备出水溶性kbi3f10:ce/tb@peg与kbi3f10:ce/eu@peg纳米晶,具有良好的水溶性和生物兼容性。实验结果表明三价铈离子容易被氧化,转变为四价,导致其在紫外区域的吸收能力大幅减弱,使得下转换发光强度降低。因此经peg包覆的含ce3+的下转换发光纳米晶能够作为荧光探针用于细胞内的超氧基离子的定量检测。这种荧光检测方法具有响应快与空间分辨率高的优势,具有很好的应用前景。
以上为对本申请实施例的描述,通过对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本申请。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的。本文中所定义的一般原理可以在不脱离本申请的精神或范围的情况下,在其它实施例中实现。因此,本申请将不会被限制于本文所示的这些实施列,而是要符合与本文所公开的原理和新颖点相一致的最宽的范围。