一种新型仿生粘附材料及其制备方法和应用与流程
本发明涉及一种新型仿生粘附材料及其制备方法和应用。
背景技术:
单细胞分析和细胞疗法在疾病诊断、癌症治疗和新药开发等方面得到了广泛的探索和应用。例如,单细胞分析揭示了细胞行为的多样性,并提供了比通常使用的细胞集合分析更丰富的数据;循环肿瘤细胞(ctcs)的检测和分离对癌症的诊断和治疗具有重要意义。因此,细胞的捕获和释放对细胞的诊断和治疗具有重要意义。为了开发高效的细胞捕获和释放方法,人们做了大量的努力。通常,基于对ph、温度、电压和光敏感的表面修饰的细胞粘附方法已经被开发出来作为控制细胞粘附在表面上的控制方式。例如,使用温度敏感的聚(n-异丙基丙烯酰胺)(pnipaam)水凝胶涂层捕获目标细胞,然后通过改变温度释放。而其他研究人员也通过使用含有偶氮苯的光刺激响应聚合物材料实现了这一目标。然而,这些方法的生物相容性或捕获效率还不能满足实际应用。因此,开发有效的细胞捕获和释放方法仍然具有挑战性。
近年来,生物胶粘剂由于其在水下的强附着强度和高生物相容性而受到人们的广泛关注。3,4-二羟基苯丙氨酸(dopa)是一种被海洋生物广泛应用于水下粘附的分子,是迄今为止最具吸引力的生物粘附分子之一。含有多巴的材料由于配位键、氢键和疏水相互作用对无机和有机表面具有很强的相互作用力,因而对各种材料表现出优异的粘附能力。此外,最近的研究也表明,含多巴的分子自组装可以大大提高粘附能。多巴的高效粘附能力和生物相容性使其非常适合于细胞捕获。但是,单个多巴分子的粘附强度较弱,而且大部分的多巴粘附是永久性的,不可控的,限制了在细胞捕获上的应用。因此,将粘连的协同增强和适度释放机制引入到含多巴的材料的黏附设计中是细胞捕获和释放的关键因素。
技术实现要素:
针对上述现有技术的不足之处,本发明解决的问题为:提供一种具备高强度粘附性能的新型仿生粘附材料及其制备方法和应用。
为解决上述问题,本发明采取的技术方案如下:
一种新型仿生粘附材料,以含多巴的多肽纳米纤维自组装形成智能粘附材料;所述多肽纳米纤维包括自组装结构多肽序列和粘附基;所述自组装结构多肽序列通过疏水相互作用自组装形成纳米纤维结构;所述粘附基依靠儿茶酚结构实现粘附。
进一步,所述自组装结构多肽序列为2-萘乙酸-甘氨酸-苯丙氨酸-苯丙氨酸(2-napgff);所述粘附基为多巴氨基酸;所述自组装结构多肽序列和粘附基通过脱水缩合作用形成一个包含四个氨基酸的短肽。
进一步,所述粘附材料在pbs缓冲液中自组装形成纳米纤维,进一步缠绕结合形成纤维网络结构。
一种新型仿生粘附材料的制备方法,步骤如下:
s1、多巴分子的修饰与保护:首先在无水ch3cn(23.0ml)中加入二羟基苯丙氨酸(dopa)(2.0g,10.1mmol)和tbdms-cl(4.6g,30.5mmol);用冰水浴冷却10min,然后滴加dbu(4.6ml,30.2mmol)10min以上;之后,让反应混合物冰浴4h,然后在室温反应20h;当反应结束后,旋蒸除去溶剂,将混合产物加入到硅胶柱(高度30厘米,直径2.5厘米)中,用甲醇:二氯甲烷(从1:9逐渐提升到3:7)混合液进行洗脱除去杂质,洗脱液旋蒸除去溶剂得到白色产物dopa(tbdms)2-oh;将dopa(tbdms)2-oh(8.62g,31.3mmol)和40ml10%na2co3溶液加入到113mlthf中,这一过程在冰浴中进行的;混合物搅拌反应10分钟后加入fmocosu(6.39g,19.0mmol),在冰浴下搅拌反应4h后,在室温下继续反应18h;旋蒸除去溶剂,然后将混合产物加入到50毫升水中并用盐酸酸化至ph=1。然后用ch2cl2(3×50ml)进行萃取,将萃取完的ch2cl2层结合,用h2o(3×50ml)和饱和食盐水(50ml)洗涤,并加入无水na2so4干燥,最后对溶液进行过滤浓缩,浓缩产物经含0.5%甲醇的二氯甲烷溶液洗脱处理而后旋蒸得到白色粉末产品fmoc-dopa(tbdms)2-oh(2.8g,4.4mmol);
s2、粘附多肽2-napgffdopa的合成:将s1中得到的fmoc-dopa(tbdms)2-oh(1eq.)和dipea(4eq.)溶于ch2cl2(20mlg-1树脂)中,然后加入2-氯三苯甲基氯树脂(1mmol/g,1eq.),在室温下搅拌1h,然后过滤溶剂,用17:2:1的ch2cl2:meoh:dipea(v:v:v,3×20ml/g树脂)洗涤反应后的树脂;然后分别用ch2cl2、dmf和ch2cl2彻底清洗树脂,并进行真空干燥;采用2%dbu/dmf测定产物连接率约为0.5mmolg-1;将干燥后的树脂在dmf中溶胀约0.5h,过滤除去溶剂,加入20%哌啶/dmf(3×5ml)除去fmoc保护基团,搅拌5min,而后分别用ch2cl2和dmf洗涤3次,然后将fmoc保护的氨基酸(4eq.),hbtu(4eq.)和dipea(8eq.)加入到dmf(5ml)中,再和树脂混合在室温下搅拌2h,然后溶剂过滤,分别用dmf、ch2cl2和dmf洗涤3次;fmoc保护的氨基酸加入顺序分别依次为fmoc-phe-oh,fmoc-phe-oh,和2-nap-gly-oh;反应完成后将树脂加入到tbaf/thf(15ml,0.13m)中反应45分钟以除去tbdms保护基;最后,用15%的tfa/ch2cl2(20mlg-1树脂)和树脂在室温下反应3h来切下多肽分子;过滤将得到的反应液旋蒸浓缩除去溶剂,加入冷的乙醚沉淀多肽;过滤收集,乙醚洗涤,真空干燥得到多肽产品。
进一步,所述步骤s1中满足用tbdms-cl对多巴儿茶酚结构进行保护合成dopa(tbdms)2-oh,满足用fmocosu对氨基端进行保护合成fmoc-dopa(tbdms)2-oh。
进一步,所述步骤s2中满足氨基酸加入顺序分别依次为fmoc-phe-oh,fmoc-phe-oh,和2-nap-gly-oh。
一种新型仿生粘附材料的应用,应用于生物细胞的高效粘附以及非特异性粘附。
一种新型仿生粘附材料的应用,应用于生物细胞的高效释放且对细胞无损害。
本发明的有益效果
1.相对于以其他传统化学高分子为主要粘附组分的粘附材料,本粘附材料采用新型仿生技术,利用生物多肽作为粘附剂,不含有任何毒有害物质,具有极好的生物相容性和环境友好性,对于生物科学的研究具有非常大的作用和价值。
2.相对于依靠机械力或者刺激性较大的化学手段进行解粘附或者根本难以解粘附的粘附材料,本粘附材料利用生物分子的ph响应,依靠小幅度的提升ph使多肽分子解组装,即可完成解粘附的过程。整个过程不仅方便快捷效率高,而且几乎对细胞不产生威胁,保证了粘附前后细胞生命活性的一致性。对于生物研究和医药研发具有非常好的实践价值。
3.相对于其他依靠单一非共价相互作用进行粘附的粘附涂料,本粘附材料还克服了单一非公价相互作用粘附能力较弱,粘附效率低下的问题,本发明在依靠多巴作为主要粘附基的前提下,利用多肽分子的自组装能力形成纳米纤维网络,实验研究表明这种自组装纳米纤维网络结构和多巴分子之间存在着协同作用,可以有效的提升整体的粘附效果,进一步增强粘附剂的粘附效率。
4.本粘附材料在粘附和释放细胞的过程中都具有操作简洁,生效迅速的特点,可以极大的提升工作效率。
5.本粘附材料对于不同的细胞的粘附没有表现出很明显的选择性,因此具有较好的普适性,可以适用于不同生物细胞的粘附与释放,应用范围相对较广。
附图说明
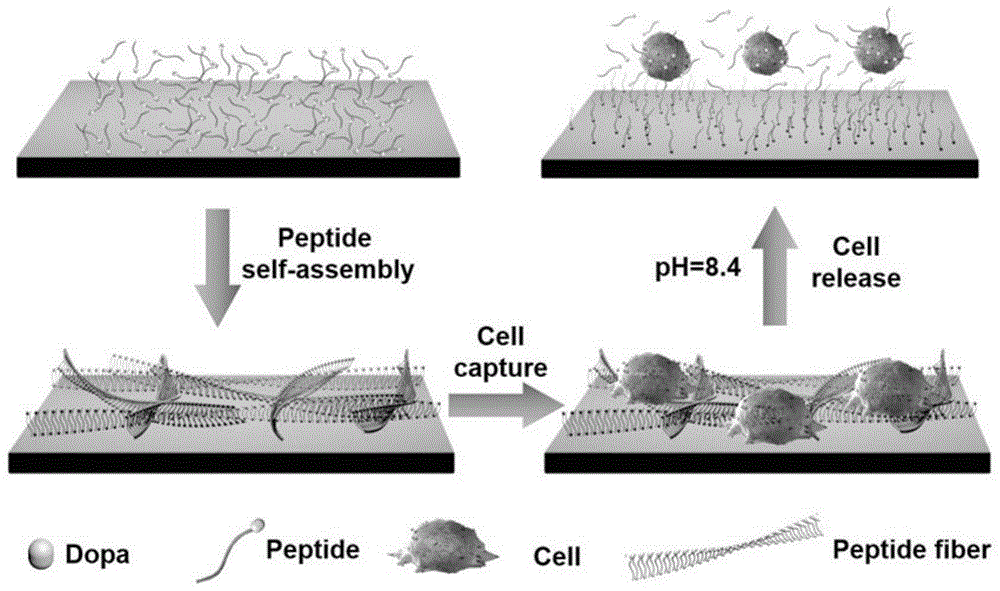
图1为新型仿生粘附材料设计原理示意图。
图2为实验中用于对照的不同的多肽样品的表征图谱。
图3为2-napgffdoap的ph响应解组装的表征图谱。
图4为研究不同的多肽样品和玻璃基板相互作用的粘附能的单分子力谱实验图谱。
图5为研究不同的多肽样品和97h细胞相互作用的粘附能的单分子力谱实验图谱。
图6为不同的多肽涂层以及常用生物交联剂fibringlue对于细胞的捕获实验以及2-napgffdopa对于不同细胞的粘附的特异性研究图谱。
图7为2-napgffdopa释放细胞的实验,以及ph改变对于细胞生命活性的影响的实验图谱。
具体实施方式
下面结合附图对本发明内容作进一步详细说明。
一种新型仿生粘附材料,以含多巴的多肽纳米纤维自组装形成智能粘附材料;所述多肽纳米纤维包括自组装结构多肽序列和粘附基;所述自组装结构多肽序列通过疏水相互作用自组装形成纳米纤维结构;所述粘附基依靠儿茶酚结构实现粘附。所述自组装结构多肽序列为2-萘乙酸-甘氨酸-苯丙氨酸-苯丙氨酸(2-napgff);所述粘附基为多巴氨基酸;所述自组装结构多肽序列和粘附基通过脱水缩合作用形成一个包含四个氨基酸的短肽。所述粘附材料在pbs缓冲液中自组装形成纳米纤维,进一步缠绕结合形成纤维网络结构。
一种新型仿生粘附材料的制备方法,步骤如下:
s1、多巴分子的修饰与保护:首先在无水ch3cn(23.0ml)中加入二羟基苯丙氨酸(dopa)(2.0g,10.1mmol)和tbdms-cl(4.6g,30.5mmol);用冰水浴冷却10min,然后滴加dbu(4.6ml,30.2mmol)10min以上;之后,让反应混合物冰浴4h,然后在室温反应20h;当反应结束后,旋蒸除去溶剂,将混合产物加入到硅胶柱(高度30厘米,直径2.5厘米)中,用甲醇:二氯甲烷(从1:9逐渐提升到3:7)混合液进行洗脱除去杂质,洗脱液旋蒸除去溶剂得到白色产物dopa(tbdms)2-oh;将dopa(tbdms)2-oh(8.62g,31.3mmol)和40ml10%na2co3溶液加入到113mlthf中,这一过程在冰浴中进行的;混合物搅拌反应10分钟后加入fmocosu(6.39g,19.0mmol),在冰浴下搅拌反应4h后,在室温下继续反应18h;旋蒸除去溶剂,然后将混合产物加入到50毫升水中并用盐酸酸化至ph=1。然后用ch2cl2(3×50ml)进行萃取,将萃取完的ch2cl2层结合,用h2o(3×50ml)和饱和食盐水(50ml)洗涤,并加入无水na2so4干燥,最后对溶液进行过滤浓缩,浓缩产物经含0.5%甲醇的二氯甲烷溶液洗脱处理而后旋蒸得到白色粉末产品fmoc-dopa(tbdms)2-oh(2.8g,4.4mmol);步骤s1中满足用tbdms-cl对多巴儿茶酚结构进行保护合成dopa(tbdms)2-oh,满足用fmocosu对氨基端进行保护合成fmoc-dopa(tbdms)2-oh。
s2、粘附多肽2-napgffdopa的合成:将s1中得到的fmoc-dopa(tbdms)2-oh(1eq.)和dipea(4eq.)溶于ch2cl2(20mlg-1树脂)中,然后加入2-氯三苯甲基氯树脂(1mmol/g,1eq.),在室温下搅拌1h,然后过滤溶剂,用17:2:1的ch2cl2:meoh:dipea(v:v:v,3×20ml/g树脂)洗涤反应后的树脂;然后分别用ch2cl2、dmf和ch2cl2彻底清洗树脂,并进行真空干燥;采用2%dbu/dmf测定产物连接率约为0.5mmolg-1;将干燥后的树脂在dmf中溶胀约0.5h,过滤除去溶剂,加入20%哌啶/dmf(3×5ml)除去fmoc保护基团,搅拌5min,而后分别用ch2cl2和dmf洗涤3次,然后将fmoc保护的氨基酸(4eq.),hbtu(4eq.)和dipea(8eq.)加入到dmf(5ml)中,再和树脂混合在室温下搅拌2h,然后溶剂过滤,分别用dmf、ch2cl2和dmf洗涤3次;fmoc保护的氨基酸加入顺序分别依次为fmoc-phe-oh,fmoc-phe-oh,和2-nap-gly-oh;反应完成后将树脂加入到tbaf/thf(15ml,0.13m)中反应45分钟以除去tbdms保护基;最后,用15%的tfa/ch2cl2(20mlg-1树脂)和树脂在室温下反应3h来切下多肽分子;过滤将得到的反应液旋蒸浓缩除去溶剂,加入冷的乙醚沉淀多肽;过滤收集,乙醚洗涤,真空干燥得到多肽产品。步骤s2中满足氨基酸加入顺序分别依次为fmoc-phe-oh,fmoc-phe-oh,和2-nap-gly-oh。
本发明基于ph敏感的新型可控多肽自组装纳米纤维用于细胞捕获和释放。通过将粘附基(dopa)引入自组装肽中,粘附基在纳米纤维的两侧排列良好。这种独特的结构使纳米纤维能够同时附着一边的基底和另一边的细胞。所设计的纳米纤维具有优异的细胞捕获能力,甚至优于纤维蛋白胶。此外,捕获的细胞可以通过ph诱导的肽解聚被有效释放而不被破坏。这种具有粘性的纳米纤维在生物医学和组织工程领域有广泛的应用。这种纳米纤维的设计原理也代表了一种设计高效和生物相容性的生物胶的通用方法。
一种新型仿生粘附材料的应用,应用于生物细胞的高效粘附以及非特异性粘附。
一种新型仿生粘附材料的应用,应用于生物细胞的高效释放且对细胞无损害。
本发明受海洋生物贻贝具有的高强度粘附能力主要来自于其足丝蛋白中含有的多巴的作用的启发,我们提出了一种新型的具有高效粘附和释放效率且无毒无害的粘附材料的设计和制备思路。其主体思路在于,设计研发一种含多巴的多肽纳米纤维凝胶涂层。如图1所示,我们的设计分为两个方面,首先是粘附过程,使用含多巴的多肽自组装分子进行自组装过程,形成缠结的纳米纤维网络结构,由分布在纤维两侧的多巴分子与基板或者细胞之间进行一系列相互作用,实现粘附过程。然后,是粘附后细胞的释放过程。通过改变粘附环境的ph至8.4左右,使得多肽纤维网络解组装被破坏,从而令捕获的细胞被释放出来。整个过程没有使用到任何毒副作用的化学物质,具有非常好的生物相容性,且操作简洁流畅实践效率高。
下面对本发明各项性能进行实施例测试:
实施例1本发明的形态和力学表征。
在实验中,我们使用了另外两组多肽样品作为验证2-napgffdopa优异粘附性能原理的对照。分别是不含有多巴可自组装的2-napgffy和含多巴但不能自组装的2-napgaadopa,如图2a所示。通常情况下,通过将含有2-napgffdopa或者2-napgffy的多肽溶液(dmso溶解)迅速的加入到磷酸盐缓冲液(pbs,ph=7.4)中,并振荡混合均匀,即可得到固体水凝胶产品。而2-napgaadopa因无法自组装形成纤维网络,因而整体还是呈现液态。原子力显微镜(afm)扫图也可以看出,在2-napgffdopa和2-napgffy样品中有非常明显的纤维网络结构,如图2b~d所示。利用流变仪进行的力学测试也可以看出,2-napgffdopa和2-napgffy2-napgffdopa和2-napgffy的储能模量(g’)在1~100rads-1的宽角频率范围内均高于损耗模量(g”),这说明二者形成的水凝胶是物理稳定的。并且2-napgffdopa的储能模量是2-napgffy的4倍,这表明2-napgffdopa有着远强于2-napgffy的机械强度,这可能和多巴形成的氢键密度远多于酪氨酸有关。而与之对应的2-napgaadopa的储能模量在低频范围小于损耗模量,表明整体呈现流体状态。如图2e~g所示。我们预计,2-napgffdopa肽纳米纤维将表现出令人印象深刻的细胞粘附能力,因为其具有排列良好的细胞粘附基(dopa),并且多肽纤维的凝胶化增加了接触面积因而进一步增强粘附效果。
实施例2本发明在ph响应解组装方面的测试。
在ph响应解组装方面,我们使用nahco3溶液来调整ph范围。实验表明,当将环境ph由7.4调整到8.4之后,2-napgffdopa水凝胶在30min时间内逐渐的由固态形貌转变为液态,afm扫图也验证了纤维网络结构的消失。如图3a所示。圆二色谱实验同样也验证了这一点,组装好的2-napgffdopa的圆二色谱(cd)在215nm处呈现出与beta片结构相对应的明显峰,而在分解的肽溶液中没有观察到明显的信号,这与afm成像结果一致(图3b)。流变实验表明,ph升高处理后,2-napgffdopa的储能模量也开始小于损耗模量,同样证明了凝胶的流体化(图3c)。这些结果表明,适当的ph变化可以控制2-napgffdopa水凝胶的解离,有利于细胞的捕获和释放。
实施例3本发明在与基板相互作用强度的单分子力谱实验测试。
为了研究2-napgffdopa纤维的粘附性能,利用原子力显微镜(afm)的力谱进行了微尺度粘附实验,测定了粘附能,如图4a所示。为避免针尖头对细胞的损伤,我们在afm悬臂上用环氧树脂粘接了一个微型玻璃球。玻璃球在afm操控下轻轻地压下2-napgffdopa水凝胶,这样玻璃球就被涂上了2-napgffdopa纳米纤维。在一个典型的力谱测试中,悬臂以2000nms-1的恒定速度下降至和基板接触,然后以1nn的接触力和基板保持接触2s以让多肽纳米纤维和基板相互作用,然后再返回,所有实验均在室温下的pbs缓冲液中进行。不同多肽的典型力谱曲线如图4b所示。通过对力谱曲线峰值面积积分计算得到粘附能,并进行直方图分析。如图4c所示,2-napgffdopa的粘附能(1.3×10-15j)要远远大于不含多巴的2-napgffy(1.11×10-16j)和不能自组装2-napgaadopa(1.21×10-17j),这证明了2-napgffdopa纳米纤维具有较强的粘附能力,粘附能的差异表明多肽的自组装序列和粘附基多巴都是有效粘附的关键。此外,2-napgffdopa在经过ph=8.4的nahco3溶液处理后,粘附能显著降低,进一步证实了在多肽纳米纤维中,自组装形成的纤维网络和dopa的协同作用对黏附的重要作用。
实施例4本发明在与细胞相互作用强度的单分子力谱实验测试。
我们利用原子力显微镜(afm)力谱分析多肽纳米纤维与97h细胞之间的粘附强度(图5a)。多肽纳米纤维与细胞相互作用的典型力谱曲线如图5b所示。各曲线的粘附能计算分析和统计如图5c。和与基板相互作用类似,各类多肽在和细胞相互作用的粘附能统计具有相同的规律。2-napgffdopa的粘附能约为1.12×10-15j而2-napgffy和2-napgaadopa分别为7.73×10-16和5.75×10-16j。并且和猜想的一样,经过ph处理解组装后2-napgffdopa的粘附能急剧下降。2-napgffdopa的高黏附能和ph响应粘附能的迅速降低表明利用这种多肽纳米纤维可用于控制细胞捕获和释放的潜力。
实施例5本发明捕获细胞实验的研究。
通过对2-napgffdopa多肽纳米纤维与聚苯乙烯基板以及细胞之间优异的粘附强度的测试,我们证实了利用2-napgffdopa进行细胞捕获和释放的可行性。于是我们在2-napgffdopa,2-napgffy和2-napgaadopa涂层处理的基板上进行了细胞捕获和释放实验,并且将未涂覆多肽的聚苯乙烯基板作为空白对照。另外,我们还使用了生物实验中常用的生物粘附剂fibringlue来作为参考对照以证明2-napgffdopa粘附细胞的实际应用价值。将97h细胞溶液加入到各涂层吸附一段时间后再清洗处理,然后染色进行荧光成像,具体结果如图6a~e所示。图6f中统计了不同涂层粘附细胞的数量,而图6g则是具体粘附效率的统计。可以看出2-napgffdopa相对于其他多肽都具有非常大的优势,甚至比常用生物粘附剂fibringlue表现出更加高效的粘附效率。图6h则是2-napgffdopa对于不同细胞是否具有特异性粘附的实验验证,分别测试了2-napgffdopa对于97h、hk、b1和7721四种细胞的粘附效率。结果表明2-napgffdopa并没有表现出非常明显的粘附效率上的差异,对不同的细胞均具有相对较高的粘附效率。
实施例6本发明释放细胞以及细胞活性实验的研究。
在进行了细胞粘附实验之后,接下来我们需要进行细胞释放的研究工作。如图7a~b所示,在经过ph处理解组装后,几乎没有细胞还粘附在基板上,大部分细胞都有效的得到了释放。图7c则是ph处理前后细胞密度的统计分析,可以看出本发明的细胞释放效率极高。同时,我们也对释放前后的细胞活力进行了研究,以评估捕获和释放过程中细胞的损伤程度。根据活/死染色法,捕获细胞的存活率约为98.0%,释放细胞的存活率约为91.5%,说明捕获细胞和释放细胞对细胞的损伤可以忽略不计,大多数的细胞都可以保证有效的活性,这表明本发明的实践价值和意义。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!