一种外泌体表面膜蛋白超分辨成像探针及其制备方法与应用
1.本发明涉及纳米材料制备及光学超分辨成像技术,尤其涉及一种外泌体超分辨成像方法及其探针。
背景技术:
2.外泌体是指包含了多种rna和蛋白质的小囊泡,直径通常在30
‑
150nm。不同类型的细胞均可分泌外泌体,且外泌体存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁等。外泌体中包含来自其母细胞的核酸、脂质和蛋白质,可以作为生物标志物和载体,用于预防和治疗包括癌症、传染病和神经退行性疾病在内的各种疾病。到目前为止,人们已经发现外泌体具有多种生物功能,可参与机体免疫应答、细胞迁移、抗原提呈、细胞分化、组织损伤的修复、肿瘤侵袭等。有研究表明肿瘤来源的外泌体参与肿瘤细胞和基底细胞之间的遗传信息交换,导致大量新血管的形成,促进肿瘤的生长和侵袭。并且由于其天然的生物相容性和小尺寸,外泌体可以逃脱吞噬细胞的吞噬作用,从肿瘤血管渗出并扩散到肿瘤组织。因此,研究肿瘤衍生的外泌体在细胞内的分布和行为对肿瘤的初期诊断和治疗具有不可取代的意义
3.目前已有的外泌体成像方法主要有:电子显微镜成像、荧光染色配合光学显微镜成像等。电子显微镜的分辨率可以达到0.1nm,能够以极高的分辨率展现样品的细节。但是电子显微镜也存在各种问题,主要在于电镜的样品制备过程极为复杂苛刻,并且电镜只能看到细胞内部的结构,对于结构的判断需要其他技术辅助辨别。过去,研究人员也使用光学显微镜对外泌体进行了成像,该方法通过各种荧光染色方法,可以标记特定的细胞甚至分子。但是,由于光学显微镜的分辨率受光波通过小孔径或聚焦到微小点时的衍射或“散布”的限制,该方法只能以数百纳米的中等分辨率对外泌体进行成像,而不能实现单分子水平的成像。
4.这些方法在外泌体的研究中有很重要的贡献,但它们都存在不足,如灵敏度低、程序复杂、成本高、分辨率不足等,因此需要设计出具有高灵敏度、高准确性、广泛适用性的外泌体成像技术。
5.半导体量子点是一种把导带电子、价带空穴及激子在三个空间维度上束缚住的准零维半导体纳米材料,它具有激发光谱宽而辐射光谱窄、光化学稳定性高、颜色可调控、抗光漂白能力强、荧光寿命长等卓越的荧光属性。量子点直径在2
‑
20nm之间,常由iv,ii
‑
vi或iii
‑
v元素组成。与传统的有机荧光染料相比,量子点可以承受多次激发与光发射而不出现明显的光漂白现象。这一持久的稳定性可以让研究人员进行长时间的荧光成像。量子点的这些特殊的光学性质使得它在生物化学、分子生物学、细胞生物学、基因组学等领域的研究中具有极大的应用前景。同时,量子点的荧光闪烁(blinking)特性使得它成为适用于单分子定位显微镜的一种新型荧光探针,对促进smlm在生物或材料科学中的应用具有重要意义。
6.基于单分子定位的超分辨荧光显微成像(smlm)包括光激活定位成像(palm)与随
机光学重构超分辨成像(storm),将量子点探针与超分辨光学显微成像技术紧密结合在一起,量子点探针为研究其超分辨成像提供了有力的工具。
技术实现要素:
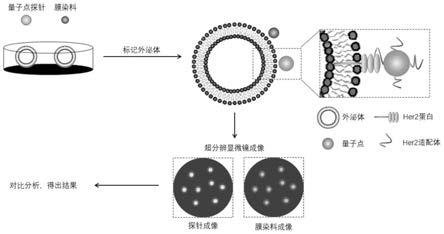
7.为解决目前检测外泌体的超分辨成像方法操作复杂、灵敏度不高、成本高的问题,本发明的目的是提供一种外泌体表面膜蛋白超分辨成像探针及其制备方法与应用,借助量子点荧光闪烁(blinking)特性实现外泌体表面膜蛋白超分辨单分子定位成像(smlm)。
8.为实现上述目的,本发明采用的技术方案为:
9.一种外泌体表面膜蛋白超分辨成像探针,所述探针以cdsse/zns核壳量子点为内核,其表面偶联氨基修饰的膜蛋白适配体。
10.所述cdsse/zns核壳量子点的发射波长为520nm或630nm,所述氨基修饰的膜蛋白适配体为her2核酸适配体或cd63核酸适配体,发射波长为520nm的量子点与her2核酸适配体相连组成her2膜蛋白探针,发射波长为630nm的量子点与cd63核酸适配体相连组成cd63膜蛋白探针。
11.一种外泌体表面膜蛋白超分辨成像探针的制备方法,包括以下步骤:
12.(1)取cdsse/zns核壳量子点,在量子点中加入催化剂并分散在缓冲溶液中,置于摇床上水浴加热反应,反应结束后离心并清洗,再将所得量子点分散至缓冲溶液中,得到量子点溶液;
13.(2)将步骤(1)得到的量子点溶液与修饰有氨基的膜蛋白适配体混合均匀,置于摇床上,水浴加热反应,使两者充分连接,得到所述外泌体表面膜蛋白超分辨成像探针,离心并清洗后将其分散在缓冲溶液中,得到探针溶液。
14.所述步骤(1)中,缓冲溶液为浓度为10mm pbs(磷酸盐)缓冲液;cdsse/zns核壳量子点为浓度为50nm的油相转水相的cdsse/zns核壳量子点;催化剂为以pbs缓冲液为溶剂的浓度为10mm的edc(1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐)溶液和以pbs缓冲液为溶剂的浓度为10mm的nhs(n
‑
羟基琥珀酰亚胺)溶液;反应条件为37℃水浴摇床加热,反应时间大于等于1.5h,反应结束后经超滤管超滤离心,并清洗两次,其中超滤管截留分子量50kda,离心时的转速为6000rpm,时间为20min。
15.所述步骤(2)中,修饰有氨基的膜蛋白适配体为浓度为50nm的her2或cd63核酸适配体,其中发射波长为520nm的量子点与her2核酸适配体相连,发射波长为630nm的量子点与cd63核酸适配体相连;反应条件为37℃水浴摇床加热,反应时间大于等于12h,反应结束后经超滤管超滤离心并清洗,其中超滤管截留分子量50kda,离心时的转速为6000rpm,时间为20min。
16.所述外泌体表面膜蛋白超分辨成像探针在外泌体表面膜蛋白超分辨单分子定位成像中的应用。
17.所述应用包括以下步骤:
18.(a)将所述外泌体表面膜蛋白超分辨成像探针分散在缓冲溶液中,得到探针溶液;在缓冲溶液中加入待测外泌体,并加入探针溶液,混合均匀,置于摇床上,水浴加热反应;
19.(b)将连接有探针的外泌体进行离心和重悬;
20.(c)将重悬后的外泌体加入到八孔板中并固定,洗去待测外泌体上多余的外泌体
表面膜蛋白量子点探针;
21.(d)将膜染料稀释后加入八孔板内,静置后取出并清洗;
22.(e)利用全内反射照明模式采集外泌体表面膜蛋白上的量子点荧光信号,对膜染料以及量子点通道分别进行荧光图像的采集和超分辨单分子定位成像。
23.所述步骤(a)中,待测外泌体为浓度为50nm的表达有her2或cd63的细胞外泌体;反应温度为37℃,反应时间大于等于2h。
24.所述步骤(b)中,离心转速为6000转,离心时间20min,重悬使用pbs缓冲液。
25.所述步骤(c)中,八孔板用质量浓度为0.1%的pei(聚乙烯亚胺)溶液在板底修饰氨基,固定操作为将外泌体静置20min后取出;洗去待测外泌体上多余的外泌体表面膜蛋白量子点探针时采用的洗涤剂为pbs缓冲液,清洗3次,温度为室温。
26.所述步骤(d)中,膜染料为浓度为10nm的dii膜染料溶液,稀释溶剂为pbs缓冲液,静置时长为15min,清洗时采用的洗涤剂为pbs缓冲液,清洗3次。
27.所述步骤(e)中,膜染料激发波长561,采集570波段的光子;her2膜蛋白探针激发波长488nm,采集630nm波段的光子;cd63膜蛋白探针激发波长405,采集520nm波段的光子,实现三色成像;进行荧光图像的采集时,图像曝光时间50毫秒,采集至少3000帧。
28.有益效果:本发明提供的外泌体表面膜蛋白超分辨成像探针的结构为以cdsse/zns核壳量子点为内核,表面偶联氨基修饰的膜蛋白适配体。经过探针与外泌体膜蛋白连接、膜染料标记外泌体、固定外泌体、清洗和成像等步骤,利用全内反射照明显微镜实现探针的量子点荧光信号的开和关,实现外泌体上her2及cd63膜蛋白的同时双色超分辨单分子定位成像。这种单分子定位探针成像时只需要一个激发波长即可对两种蛋白进行双色超分辨成像,具有实验成本低、周期短、特异性好、准确度高的优点。
附图说明
29.图1为本发明中的外泌体超分辨成像方法的示意图;
30.图2为本发明中使用的外泌体膜蛋白量子点探针的结构示意图;
31.图3为在520nm和630nm两个量子点通道下分别对her2蛋白和cd63蛋白量子点探针进行smlm超分辨成像的图像;
32.图4为外泌体量子点通道和膜染料通道所成的宽场图像。
具体实施方式
33.下面结合实施例对本发明作更进一步的说明。
34.本发明中原料来源如下:
35.1、pbs缓冲液的ph=7.4,浓度为10mm;
36.2、skbr3细胞购自中国科学院上海生命科学研究院细胞库;
37.3、其余材料均为市售所得。
38.实施例
39.取cdsse/zns核壳量子点(发射光峰值在520nm),取500μl至试管中。加入3倍体积的甲醇溶液。配平离心20min,转速8000r。将离心后的样品中废液取出,沉淀敞口晾干。用1~2ml氯仿再次溶解样品,将溶解后的样品转移至洗好的瓶子中。加入150ml mpa(巯基丙
酸)、200ml tmah(四甲基氢氧化铵),盖好瓶盖。在避光的情况下,加入蒸馏水1~2ml,以转速400rpm剧烈搅拌2h,使其混合均匀。静置,产生分层,上层即为量子点水溶液(下层为氯仿),取出上层量子点水溶液并保存于4℃备用。
40.将20μl转水的量子点加入试管中,用pbs缓冲液稀释至500μl。配置浓度10mm的edc溶液以及浓度10mm的nhs溶液,溶剂为pbs缓冲液。取edc溶液与nhs溶液,加入量子点中,混合均匀,置于摇床上,37℃水浴加热1.5h,使充分反应。反应结束后,将量子点转移至超滤管(截留分子量50kda)中,转速6000r离心20min。再加入500μl的pbs缓冲液,以同样的转速清洗一次。将量子点重新分散在pbs缓冲液中,并加入10μl的修饰有氨基的her2核酸适配体,混合均匀,置于摇床上,37℃过夜反应。反应结束之后,再次用截留分子量50kda的超滤管对量子点进行提纯并清洗一次,除去多余的核酸适配体,得到her2膜蛋白探针,将her2膜蛋白探针重新分散在pbs缓冲液中,得到探针溶液。
41.采用与制备her2膜蛋白探针同样的方法,将发射波长为630nm的量子点与cd63核酸适配体相连,制成cd63膜蛋白探针。
42.在500μl pbs缓冲液中加入20μl skbr3外泌体,并加入5μl制备的探针溶液,混合均匀,置于摇床上,37℃水浴加热2h,使充分反应。反应结束后,将量子点转移至超滤管中,6000转离心20min。离心结束后加入400μl的pbs缓冲液重悬外泌体。在eppendorf 8腔室盖玻片中的一室加入400μl质量浓度为0.1%的pei(聚乙烯亚胺),静置10min后取出并用pbs缓冲液清洗3次。在腔室内加入重悬外泌体,静置20min后取出,并用pbs缓冲液清洗3次。在400μl pbs缓冲液内加入10μl dii膜染料。稀释后将溶液加入腔室内,静置15min后取出并用pbs缓冲液清洗3次。
43.用波长为405nm或488激光激发量子点探针成像,用波长为561nm激光激发dii膜染料成像。对比量子点通道和膜染料通道所成的图像,两个通道图像的发光位置重合(如图4所示),证明量子点探针成功标记外泌体。
44.本发明中,外泌体超分辨成像方法需要用到两种外泌体膜蛋白量子点探针,一种为能与外泌体hre2蛋白特异性识别的量子点探针,另一种为能与外泌体cd63蛋白特异性识别的量子点探针。将两种量子点探针加入到用固定剂固定好的外泌体样品上,使该两种探针能分别杂交到外泌体膜上her2蛋白和cd63蛋白上。利用全内反射照明实现两种量子点探针荧光信号的开和关,进行外泌体的超分辨单分子定位成像(smlm)。该方法具有实验成本低、周期短、特异性好、准确度高的优点。
45.以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1