一种pH激活的近红外I区发射荧光的碳量子点的制备方法及其产品和应用
一种ph激活的近红外i区发射荧光的碳量子点的制备方法及其产品和应用
技术领域
1.本发明涉及纳米材料技术领域,特别是涉及一种ph激活的近红外i区发射荧光的碳量子点的制备方法及其产品和应用。
背景技术:
2.设计特异性的探针,使探针在肿瘤区显示出信号,而在正常组织中不显示信号,以达到成像肿瘤的效果,不仅能为肿瘤诊断与治疗的基础研究创造条件,而且为临床肿瘤预后判断和采用干预措施治疗提供了依据,对肿瘤诊断治疗有实际意义。
3.目前实现肿瘤区特异性的方法有利用肿瘤标志物的靶向性,以及利用肿瘤区的微环境指标与正常组织的差异性。已知肿瘤的微环境指标,如低ph、低氧和高隙间压力是所有实体瘤的普遍特征,利用肿瘤微环境指标的探针相比标志物靶向性的探针更具有普适性和实用性。肿瘤低ph的主要原因是肿瘤细胞葡萄糖摄取率升高而氧化磷酸率降低,从而导致乳酸聚集。肿瘤组织内的ph值为4.5
–
6.8,正常组织的ph值通常在7.0
‑
7.4,因此酸性ph响应的材料适合用于检测肿瘤。如陈美、郑南峰等人在此理论基础上,用ph响应的超小钯纳米片进行肿瘤的高灵敏放射性成像和治疗,解决了肿瘤成像背景高的问题。相比其它检测方法,荧光拥有其固有的优势,如灵敏度高,无辐射伤害,低成本,可应用于光学成像引导的精确手术治疗等。因此,研究者们在肿瘤荧光成像探针方面做了许多研究。如,di xu等人设计合成酸性ph响应的双光子荧光探针,在酸性条件下分子结构改变,发生分子内电子转移,从而分子从蓝光发射转变为红光发射,以比率荧光实现肿瘤的区分(anal.chem.,2018,90,8800
‑
8806.);xiqun jiang等人设计的探针则同时利用了肿瘤微环境中的低ph与低氧,进一步提高了肿瘤成像的专一性(nature biomedical engineering,2017,1,0057.)。这些研究都选用染料作为荧光剂,具有较大的毒性,背景高,且容易受光漂白影响。另外,有的研究者选用ph响应的纳米胶束来实现酸性ph的荧光成像。这类纳米胶束由两亲性共聚物形成,在中性至碱性条件下形成致密的纳米胶束,可包含各种荧光染料和药物,此时胶束内的荧光染料聚集而不发射荧光;而在肿瘤酸性的微环境下,胶束发生解离,使内容物分散游离,从而发射出荧光(nature biomedical engineering,2016,1,0006;nat.mater.,2014,13,204
‑
212.)。这种设计策略允许将各种具有优势的荧光材料应用于肿瘤成像和光学引导精准手术。而碳点作为一种新型荧光碳纳米材料,具有优良的光学性能、小尺寸特性、良好的生物相容性、低毒性和易于实现表面功能化等特点,亦被应用于该设计中(acta physico
‑
chimica sinica 2020,doi:10.3866/pku.whxb201905067.)。但纳米胶束增加了探针的制备难度,且应用中存在一定的背景。因此,新型的ph响应肿瘤荧光成像探针研究仍面临巨大挑战。
技术实现要素:
4.本发明的目的是提供一种ph激活的近红外i区发射荧光的碳量子点的制备方法及
其产品和应用,以解决上述现有技术存在的问题,本发明的制备方法简单,其制备的碳量子点具有良好的生物相容性,并且在中性至碱性条件下不发光,酸性条件下在620nm及700nm范围内发射出强烈红光,非常适用于肿瘤低ph荧光成像。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供一种ph激活的近红外i区发射荧光的碳量子点的制备方法,包括以下步骤:
7.(1)将柠檬酸、邻苯二胺、磷酸和水混合均匀,制得混合水溶液;
8.(2)将步骤(1)的混合水溶液进行水热反应;
9.(3)待步骤(2)的水热反应完成后进行纯化,冻干,得到所述ph激活的近红外i区发射荧光的碳量子点。
10.进一步地,在步骤(1)中,所述柠檬酸、邻苯二胺和磷酸的质量体积比为0.018g:(0.08~0.2)g:(0~1.2)ml。
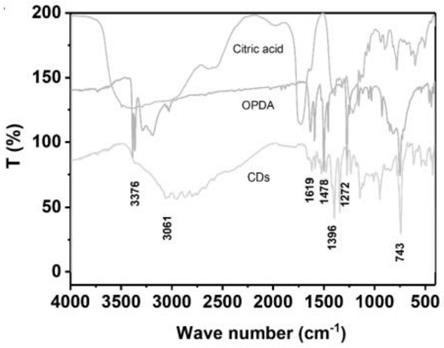
11.进一步地,在步骤(1)中,所述柠檬酸、邻苯二胺、磷酸和水的混合方法为在柠檬酸和邻苯二胺中加入磷酸和水,超声3~10min。
12.进一步地,在步骤(2)中,所述水热反应的温度为160~200℃。
13.进一步地,在步骤(2)中,所述水热反应的反应时间为45~180min。
14.进一步地,在步骤(3)中,所述纯化的方法为高速离心、透析、超滤或凝胶色谱中的一种或几种。
15.进一步地,在步骤(3)中,所述纯化的具体方法包括以下步骤:将步骤(2)完成水热反应的混合溶液降温冷却,再加入盐酸水溶液对在步骤(2)中合成的碳点进行溶解,之后进行透析处理得到含有碳点的透析液,再对含有碳点的透析液进行葡聚糖凝胶分离,得到纯化后的碳点溶液。
16.进一步地,在步骤(3)中,所述透析是采用透析袋进行透析,所述透析袋的截流分子量为14kd。
17.本发明还提供根据以上制备方法制备得到的ph激活的近红外i区发射荧光的碳量子点。
18.本发明还提供上述ph激活的近红外i区发射荧光的碳量子点在制备肿瘤成像的试剂中的应用。
19.本发明以柠檬酸和邻苯二胺为原料,在磷酸的存在下制备出了ph激活的近红外i区发射荧光的碳量子点(r
‑
cds)。本技术制备的荧光碳量子点的粒径约为3nm,在570nm激发下,600
‑
720nm范围内发射荧光,最大发射波长为621nm。各种表征结果表明,r
‑
cds表面含有胺基、亚胺和少量磷酸基团,使其在酸性条件下具有更好的分散性。重要的是,r
‑
cds表现出有趣的ph响应性,在中性至碱性条件下不发射荧光,在酸性条件下,随ph的下降,荧光强度迅速增强。综合各种数据分析,这种ph响应性来源于两方面,一是酸性条件下r
‑
cds表面的各种含氮基团质子化,改变了粒子的能级结构,消除了含氮基团中孤对电子形成的分子内pet效应;二是随着ph的升高,含氮基团去质子化,r
‑
cds溶解性下降而发生聚集,由此带来的acq效应使r
‑
cds的荧光被猝灭。
20.r
‑
cds的这种ph响应性,加之其红色的荧光发射,优异的光稳定性,以及良好的生物相容性,使其成为出色的肿瘤酸性微环境纳米荧光探针,可应用于体内、体外肿瘤成像。
研究结果表明,本发明制备的r
‑
cds只对肿瘤细胞产生响应,而对正常的组织细胞不响应,具有高度选择性。体内成像结果表明,肿瘤小鼠注射r
‑
cds后,短时间内便可观察到肿瘤,1h后肿瘤的荧光达到最强,随后强度逐渐下降,24h后碳点被完全排出体外。通过分析小鼠各个器官和肿瘤组织的成像,r
‑
cds只在肿瘤组织中发射荧光,其它正常组织均完全不发射荧光。因此,r
‑
cds在肿瘤的早期诊断和治疗中具有广阔的应用前景。
21.本发明公开了以下技术效果:
22.本发明的ph激活的近红外i区发射荧光的碳量子点制备简单,易于实现量产;在中性至碱性条件下不发光,酸性条件下在620nm及700nm范围内发射出强烈红光,非常适用于肿瘤低ph荧光成像;利用碳量子点在肿瘤区的被动富集,以及酸性ph激活的荧光性质,消除了荧光成像中的背景信号,特异性强;碳量子点发射在近红外i区,组织吸收少,穿透深度大,利于深层肿瘤成像;碳量子点良好的生物相容性,使其在医学中具有巨大潜在应用价值。
附图说明
23.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
24.图1为ph激活的近红外i区发射荧光的碳量子点的制备和应用示意图;
25.图2为实施例1制备的ph激活的近红外i区发射荧光的碳量子点在不同放大倍数下的透射电镜图,其中左图的标尺是5nm,右图的标尺是2nm;
26.图3为柠檬酸、邻苯二胺与实施例1制备的ph激活的近红外i区发射荧光的碳量子点的ftir光谱分析图;
27.图4为实施例1制备的ph激活的近红外i区发射荧光的碳量子点的xps扫描图;
28.图5为实施例1制备的ph激活的近红外i区发射荧光的碳量子点的c1s、o1s、n1s,和p2p的xps扫描图,其中a为c1s的xps扫描图,b为o1s的xps扫描图,c为n1s的xps扫描图,d为p2p的xps扫描图;
29.图6为实施例1制备的ph激活的近红外i区发射荧光的碳量子点在不同ph下紫外可见光谱图;
30.图7为实施例1制备的ph激活的近红外i区发射荧光的碳量子点在ph值为1.0和7.0时的dls测试图;
31.图8为实施例1制备的ph激活的近红外i区发射荧光的碳量子点在不同ph条件下的荧光光谱图;
32.图9为实施例1制备的ph激活的近红外i区发射荧光的碳量子点在不同ph条件下最大发射波长621nm处的荧光强度与ph的关系图;
33.图10为实验例1中柠檬酸与邻苯二胺不同比例所获得的ph激活的近红外i区发射荧光的碳量子点的荧光光谱图;
34.图11为实验例2中不同磷酸用量反应所获得的ph激活的近红外i区发射荧光的碳量子点的荧光强度与磷酸用量关系图;
35.图12为实验例3中不同水热反应时间所获得的ph激活的近红外i区发射荧光的碳量子点的荧光光谱图;
36.图13为实验例4中不同水热反应温度所获得的ph激活的近红外i区发射荧光的碳量子点的荧光强度与温度的关系图;
37.图14为实施例2制备的ph激活的近红外i区发射荧光的碳量子点在ph4.5和ph6.0下1300秒内的光稳定性测试图;
38.图15为实施例2制备的ph激活的近红外i区发射荧光的碳量子点在不同浓度下对hela细胞存活的影响测试图;
39.图16为nih3t3系正常组织细胞与hela细胞分别与实施例2制备得到的ph激活的近红外i区发射荧光的碳量子点孵育后的共聚焦荧光成像图;
40.图17为以hela细胞建模的荷瘤小鼠注射实施例2制备得到的ph激活的近红外i区发射荧光的碳量子溶液后不同时间的活体荧光成像结果,以及注射该荧光碳量子点溶液1h后,解剖小鼠所得不同组织器官与肿瘤组织的荧光成像图。
具体实施方式
41.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
42.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
43.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
44.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
45.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
46.在以下实施例、实验例或效果验证中:
47.高分辨透射电镜采用的仪器是fei tecnai g2 f30,测试条件:加速电压200kv;
48.可见光吸收光谱的测试方法:在酶标仪(tecan infinite m200pro)上使用透明96孔板,波长扫描范围400
‑
700nm。
49.荧光强度的测试方法:在荧光光谱仪(horiba fluoromax
‑
4)上,激发波长570nm,发射波长621nm,进行荧光光谱扫描或荧光强度测定。
50.所用磷酸为浓磷酸。
51.本发明的ph激活的近红外i区发射荧光的碳量子点的制备和应用示意图参见图1。
52.实施例1
53.(1)称量0.018g柠檬酸和0.12g邻苯二胺于烧杯中,加入0.6ml的磷酸和2.4ml的蒸馏水,超声5min,使其充分溶解,得到混合水溶液;
54.(2)将步骤(1)得到的混合水溶液转移至水热反应釜的聚四氟乙烯内衬中,并密封,然后将反应釜置于190℃烘箱中反应75min;
55.(3)步骤(2)的水热反应完成后,温度自然降至室温后,往反应釜内衬中加入10ml 0.1mol/l盐酸,溶解刚合成的碳点,取出所有碳点溶液放进14000透析袋中,并将透析袋放进装有3l蒸馏水的大烧杯中进行透析,多次更换蒸馏水,直至烧杯中的水放在暗箱式紫外分析仪中没有观察到有荧光为止。取出碳点溶液,用0.1mol/l盐酸稀释溶解后,以0.1mol/l盐酸为洗脱剂,进行葡聚糖凝胶分离,获得纯的红色碳点溶液,将碳点溶液冻干获得ph激活的近红外i区发射荧光的碳量子点粉末。
56.对本实施例制备得到的ph激活的近红外i区发射荧光的碳量子点进行透射电镜测试,结果如图2所示。由图2可知,所制备荧光碳点的尺寸约为3nm。
57.对本实施例制备得到的ph激活的近红外i区发射荧光的碳量子点进行ftir、紫外可见光光谱分析,以及xps扫描和dls测试,结果见图3
‑
7。
58.再对本实施例制备得到的ph激活的近红外i区发射荧光的碳量子点在不同ph条件下进行荧光强度测试,结果如图8、9所示。当ph大于7.0时,碳点不发射荧光。在酸性条件下,随着ph下降,碳点的荧光强度逐渐增强。
59.实施例2
60.(1)称量0.018g柠檬酸和0.08g邻苯二胺于烧杯中,加入0.3ml的磷酸和2ml的蒸馏水,超声3min,使其充分溶解,得到混合水溶液;
61.(2)将步骤(1)得到的混合水溶液转移至水热反应釜的聚四氟乙烯内衬中,并密封,然后将反应釜置于160℃烘箱中反应180min;
62.(3)步骤(2)的水热反应完成后,温度自然降至室温后,往反应釜内衬中加入15ml 0.1mol/l盐酸,溶解刚合成的碳点,取出所有碳点溶液放进14000透析袋中,并将透析袋放进装有3l蒸馏水的大烧杯中进行透析,多次更换蒸馏水,直至烧杯中的水放在暗箱式紫外分析仪中没有观察到有荧光为止。取出碳点溶液,用0.1mol/l盐酸溶解后,以0.1mol/l盐酸为洗脱剂,进行葡聚糖凝胶分离,获得纯的红色碳点溶液,将碳点溶液冻干获得ph激活的近红外i区发射荧光的碳量子点。
63.实施例3
64.(1)称量0.018g柠檬酸和0.2g邻苯二胺于烧杯中,加入1.2ml的磷酸和2.2ml的蒸馏水,超声10min,使其充分溶解,得到混合水溶液;
65.(2)将步骤(1)得到的混合水溶液转移至水热反应釜的聚四氟乙烯内衬中,并密封,然后将反应釜置于200℃烘箱中反应45min;
66.(3)步骤(2)的水热反应完成后,温度自然降至室温后,往反应釜内衬中加入20ml 0.1mol/l盐酸,溶解刚合成的碳点,取出所有碳点溶液放进14000透析袋中,并将透析袋放进装有3l蒸馏水的大烧杯中进行透析,多次更换蒸馏水,直至烧杯中的水放在暗箱式紫外分析仪中没有观察到有荧光为止。取出碳点溶液,用0.1mol/l盐酸溶解后,以0.1mol/l盐酸
为洗脱剂,进行葡聚糖凝胶分离,获得纯的红色碳点溶液,将碳点溶液冻干获得ph激活的近红外i区发射荧光的碳量子点。
67.实验例1
68.将柠檬酸与邻苯二胺的质量比分别调整为9:40、9:50、9:60、9:75、9:100,其它操作步骤同实施例1,进行优化实验,实验结果如图10所示。根据实验结果,柠檬酸与邻苯二胺的质量比在9:(40~100)的范围内均可获得目标荧光碳点,其中质量比为9:60时,所得产物的荧光强度最大。
69.实验例2
70.将磷酸的用量分别调整为0ml、0.3ml、0.6ml、1ml、1.2ml,其它操作步骤同实施例2,进行优化实验,实验结果如图11所示。根据实验结果,磷酸的用量从0到1.2ml的范围内变化,均可获得目标荧光碳点,当磷酸体积为0.6ml时所得产物的荧光强度最强。表明磷酸虽然不是形成荧光碳点所必需,但p掺杂可使碳点的荧光强度增加5倍左右。
71.实验例3
72.将水热反应的时间分别调整为40min、60min、75min、120min、140min、160min,其它操作步骤同实施例1,进行优化实验,实验结果如图12所示。根据实验结果,在190℃反应不同时间均可获得目标荧光碳点,其中反应75min所得产物的荧光强度最大。
73.实验例4
74.将水热反应的温度分别调整为160℃、170℃、180℃、190℃、200℃,其它操作步骤同实施例1,进行优化实验,实验结果如图13所示。根据实验结果,水热反应温度在160~200℃范围内均可获得目标荧光碳点,温度越高,产物的荧光强度越强,温度达到190℃后,荧光强度达到最大。
75.实验例5
76.将实施例2制备的ph激活的近红外i区发射荧光的碳量子点用细胞培养基分别配制成1μg/ml、5μg/ml、10μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml、300μg/ml,分别测试hela细胞在上述碳量子点溶液中培养24小时后的存活率,实验结果见图15。根据图15可以看出,实施例2制备的碳量子点在1
‑
200μg/ml的浓度范围内,hela细胞的存活率均在80%以上,这充分说明本发明制备的碳量子点具有很好的生物相容性。
77.效果验证
78.在对nih3t3系正常细胞和hela细胞进行体外培养时添加实施例2制备得到的ph激活的近红外i区发射荧光的碳量子点,共同孵育1小时后,在共聚焦荧光显微镜下进行观察,结果如图16所示。由图16可知,由于正常组织细胞内部微环境的ph为7.4左右,所以荧光碳点不发射荧光。而hela肿瘤细胞内的ph小于6.8,可激活荧光碳点,使碳点在580nm激发下发射出强烈的红色荧光。因此,本发明的荧光碳点可用于肿瘤细胞的特异性荧光成像。
79.在5
‑
6周左右的雌性裸鼠(15
‑
20g)右腋下接种肿瘤细胞,至肿瘤面积达到150mm2后进行活体成像实验。通过尾静脉注射实施例2制备得到的ph激活的近红外i区发射荧光的碳量子点缓冲溶液到荷瘤裸鼠体内(5mg/kg),然后在不同时间点利用活体成像仪拍摄荧光信号(580nm激发,620nm发射),除此之外,将注射1h后的荷瘤裸鼠解剖得到肌肉、脑、肾、肠、脾、肺、心和肿瘤组织,在活体成像仪下观察各个器官的成像,结果如图17所示。由图17可知,肿瘤小鼠注射荧光碳点后,短时间内便可在活体成像仪中观察到荧光,1h后肿瘤的荧光
强度达到最大,随后荧光强度逐渐降低,24h后消失,表明碳点可正常排出体外。此外,解剖并对小鼠体内各主要器官和肿瘤进行成像,结果表明,注射荧光碳点1h后,只有肿瘤组织发射出强烈的荧光强度,其它正常组织均无荧光,表现出对肿瘤组织优异的选择性。
80.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1