一种基于具有聚集诱导发光性柱芳烃大环的可调控性近红外光敏剂及其制备方法和应用
1.本发明涉及超分子化学材料技术领域,具体地,涉及一种基于具有聚集诱导发光性柱芳烃大环的可调控性近红外光敏剂及其制备方法和应用。
背景技术:
2.光动力疗法(pdt)是目前最高效的癌症治疗策略之一,具有无创性、低毒性、精确的可调控性等优点。pdt通常需要三种成分光敏剂(ps)、氧气及光源来产生活性氧物种(singlet oxygen,ros),主要机制是通过ps在光照条件下产生具有毒性的ros来损伤癌细胞或细菌从而达到治疗效果。理想的光敏剂应具有暗毒性极小(即仅在辐射照射下才能激活)、但大多数传统的光敏剂存在较低的光穿透深度,以及在聚集或高浓度下会导致荧光降低等限制。
3.荧光共振能量传递(fret)是一种分子间的电偶极作用,两个能够吸收并发射荧光的荧光基团,其中一个是能量给体(donor),另一个是能量受体(acceptor)。通过给体激发态能量转移到受体激发态导致给体能量降低的非辐射跃迁过程。fret技术具有高灵敏度、简单方便等优点,在生物成像、细胞检测等生物化学、生命分析领域起到了不可缺的桥梁作用。
4.主客体相互作用是形成刺激响应型超分子材料的驱动力,主要涉及多种非共价相互作用的协同作用如疏水相互作用、静电相互作用、范德华力和多重氢键作用等。通过超分子大环主体分子和功能性客体分子的主客体作用,两个或多个分子可以整合到一起实现功能化应用。由于主体分子对客体分子的尺寸、电荷、极性及形状等方面都有严格的要求,因此具有高度的选择性和动态可逆性,使得主客体复合材料对外界刺激(温度、光照、ph等)具有特有的刺激响应性和一定的可逆性,在构筑智能纳米材料方面表现出优异的性能。
5.如何将荧光共振能量传递和主客体相互作用同时应用于一种光敏剂中,共同实现二者的优点,是目前一个很有前景的发展方向。聚集诱导发光(aie)是一类在稀溶液中具有弱发射或非发射的物质,但在聚集态和固态时发出特别强的荧光。基于aie特性的光敏剂拥有在聚集状态下抗荧光淬灭以及高效的ros产生能力等优点,尤其是开发近红外光敏剂被认为是最有潜力的光动力诊疗之一。
技术实现要素:
6.针对现有技术中的缺陷,本发明的目的是提供一种基于具有聚集诱导发光性柱芳烃大环的可调控性近红外光敏剂及其制备方法和应用。
7.本发明的目的是通过以下方案实现的:
8.本发明的第一方面提供一种基于具有聚集诱导发光性柱芳烃大环的可调控性近红外光敏剂,包括二元超分子纳米粒子和近红外染料尼罗蓝,所述近红外染料尼罗蓝作为受体负载到作为给体的二元超分子纳米粒子中实现近红外发光;所述二元超分子纳米粒子
由具有四苯乙烯构象的aie水溶性柱[5]芳烃作为主体功能分子和螺吡喃衍生物客体分子通过主客体作用构筑而成;其中,具有四苯乙烯构象的aie水溶性柱[5]芳烃的结构式如下:
[0009]
螺吡喃衍生物的结构式如下:
[0010]
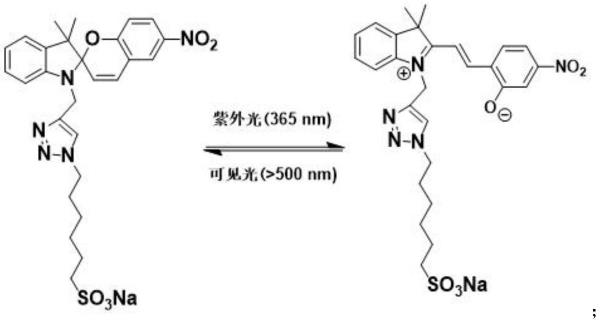
该结构式在紫外光和可见光的照射下,会发生如下变化:
[0011][0012]
尼罗蓝的结构式如下:
[0013]
本发明的第二方面提供基于具有聚集诱导发光性柱芳烃大环的可调控性近红外光敏剂的制备方法,包括如下步骤:
[0014]
步骤1、分别制备具有四苯乙烯构象的aie水溶性柱[5]芳烃和螺吡喃衍生物;
[0015]
步骤2、采用具有四苯乙烯构象的aie水溶性柱[5]芳烃和螺吡喃衍生物制备二元超分子纳米粒子溶液;
[0016]
步骤3、将尼罗蓝作为受体负载到步骤2得到的二元超分子纳米粒子中制备三元纳米粒子溶液,其中二元超分子纳米粒子作为能量给体,尼罗蓝作为能量受体。
[0017]
进一步地,步骤1中,螺吡喃衍生物的合成路线如下:
[0018][0019]
螺吡喃衍生物的合成步骤如下:
[0020]
步骤1a、在惰性气体氛围保护下,将溴丙炔加入到2,3,3-三甲基二氢吲哚溶液中,回流反应,得到粗产物a;
[0021]
步骤1b、在惰性气体氛围保护下,将粗产物a加入碱性溶液中反应,得到化合物b;
[0022]
步骤1c、在惰性气体氛围和回流条件下,将化合物b加入到2-羟基-5-硝基苯甲醛的有机溶液中进行回流反应,得到化合物c;
[0023]
步骤1d、将化合物c、叠氮磺酸钠化物、三[(1-苄基-1h-1,2,3-三唑-4-基)甲基]胺溶解在干燥的混合溶剂中搅拌反应,然后将[cu(ch3cn)4]pf6加入其中,继续反应得到螺吡喃衍生物。
[0024]
优选地,所述粗产物a不经纯化处理可直接用于下一步反应。
[0025]
优选地,步骤1a中,溴丙炔与2,3,3-三甲基二氢吲哚的摩尔比为1:1~1.5:1;步骤1c中,化合物b与2-羟基-5-硝基苯甲醛的摩尔比为1:1~1.5:1;步骤1d中,化合物c、叠氮磺酸钠化物、三[(1-苄基-1h-1,2,3-三唑-4-基)甲基]胺、[cu(ch3cn)4]pf6的摩尔比为1:(1~1.5):0.1:0.1。
[0026]
进一步地,步骤1中,具有四苯乙烯构象的aie水溶性柱[5]芳烃的合成路线如下:
[0027][0028]
具体合成步骤为:
[0029]
s1、将化合物1加入四氯化碳中,在引发剂2,2
’‑
偶氮双(异丁腈)的作用下,与n-溴代丁二酰亚胺反应得到化合物2,其中,r=och2ch2br,化合物1与n-溴代丁二酰亚胺的摩尔比为1:0.7~1:1.5,化合物1与2,2
’‑
偶氮双(异丁腈)的摩尔比为1:0.02~1:0.05;
[0030]
s2、将化合物2加入二氯甲烷中,在氧化剂重铬酸吡啶鎓的作用下,发生氧化反应得到化合物3,化合物2与重铬酸吡啶鎓的摩尔比为1:2~1:5;
[0031]
s3、将化合物3加入四氢呋喃中,在四氯化钛和锌粉的作用下,与二苯甲酮进行偶联反应得到化合物4,化合物3与二苯甲酮的摩尔比为1:8~1:12,化合物3与锌粉的摩尔比为1:30~1:60,化合物3与四氯化钛的摩尔比为1:15~1:25;
[0032]
s4、将化合物4和三甲胺加入到四氢呋喃中,回流反应后重结晶,得到阳离子型水溶性柱[5]芳烃化合物5,化合物4和三甲胺的摩尔比为1:4-1:8。
[0033]
进一步地,步骤2中,二元超分子纳米粒子溶液的制备方法如下:
[0034]
将具有四苯乙烯构象的aie水溶性柱[5]芳烃和螺吡喃衍生物分别溶解于水中,然后将螺吡喃衍生物水溶液快速注入到aie水溶性柱[5]芳烃水溶液中,均匀混合后得到二元超分子纳米粒子溶液;其中,螺吡喃衍生物水溶液的浓度为2μm-2mm,aie水溶性柱[5]芳烃水溶液的浓度为1μm-1mm。
[0035]
优选地,步骤2中,所述二元超分子纳米粒子溶液中,aie水溶性柱[5]芳烃和螺吡喃衍生物的摩尔比为1:1-1:10,优选1:4。
[0036]
进一步地,步骤3中,三元纳米粒子溶液的制备方法如下:
[0037]
将浓度为1μm-0.1mm的尼罗蓝滴加到步骤2得到的二元超分子纳米粒子溶液中,均匀混合后得到aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子溶液;其中,aie水溶柱[5]芳烃、螺吡喃衍生物、尼罗蓝的最终浓度比值为1:(4-6):0.1。
[0038]
本发明的第三方面提供基于具有聚集诱导发光性柱芳烃大环的可调控性近红外光敏剂的应用,所述应用包括在制备抗癌药物或抗菌产品中的应用。
[0039]
meso-位嵌入四苯乙烯构象的aie水溶性柱[5]芳烃拥有良好的聚集诱导发光的特性,可以作为能量给体,同时柱芳烃的空腔可以很好的包载客体分子,提高客体分子的水溶性;螺吡喃衍生物客体分子具有良好的光响应性,紫外灯和可见光照射下会产生两种光异构体,其中紫外灯照射下的螺吡喃衍生物(开环花青素状态)可以作为第一步的能量受体,同时也是一种光敏剂;近红外染料尼罗蓝可以负载到aie水溶性柱[5]芳烃-螺吡喃衍生物构筑的二元纳米粒子,作为第二步的能量受体实现近红外发光,同时得到的aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子作为光敏剂在抗癌细胞活性和细菌活性具有良好的应用。可作为一种智能光敏剂在制备治疗肿瘤产品和抑制细菌产品方面具有比较广阔的应用前景。
[0040]
aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元超分子纳米粒子是以aie水溶性柱芳烃为主体,同时也是能量传递的给体,以螺吡喃衍生物为客体,同时也是第一步能量传递的受体,通过主客体作用构筑了二元超分子纳米粒子组装体,该二元纳米粒子组装体可进一步作为第二次能量传递的能量给体,尼罗蓝作为第二次能量受体负载到疏水的纳米粒子组装体中,构筑了一种基于具有聚集诱导发光性柱芳烃主客体作用的可调控近红外光敏剂。
[0041]
与现有技术相比,本发明具有如下的有益效果:1、通过合成具有光响应性的螺吡喃衍生物作为光敏剂和客体分子,同时利用具有aie活性的水溶性柱[5]芳烃作为主体分子,它的空腔可以包载螺吡喃衍生物客体分子,一方面提高螺吡喃客体分子的水溶性,另一方面得到的aie荧光纳米粒子可以进一步包载近红外疏水染料尼罗蓝,通过荧光共振能量传递技术,可得到具有aie活性的可调控性近红外光敏剂,该光敏剂拥有在聚集状态下抗荧光淬灭且发射近红外光以及高效的ros产生能力等优点。2、制备的近红外光敏剂,是基于非共价键相互作用构建的光敏剂,可以对外界刺激具有很好的响应性,作为光动力治疗所需的必备物质,可有效提高光动力治疗的效果。
附图说明
[0042]
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
[0043]
图1为化合物b的氢谱;
[0044]
图2为化合物c的氢谱;
[0045]
图3为螺吡喃衍生物sp-g的氢谱;
[0046]
图4为螺吡喃衍生物sp-g的碳谱;
[0047]
图5为螺吡喃衍生物sp-g的质谱;
[0048]
图6为螺吡喃衍生物客体分子在紫外灯(365nm)和可见光(》500nm)照射的紫外可见吸收变化谱图;
[0049]
图7为aie水溶性柱[5]芳烃-螺吡喃衍生物二元超分子纳米粒子的tem图:
[0050]
图8为aie水溶性柱[5]芳烃-螺吡喃衍生物二元超分子纳米粒子的dls数据;
[0051]
图9为aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子的tem图;
[0052]
图10为aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子的dls数据;
[0053]
图11为aie水溶性柱[5]芳烃与螺吡喃衍生物的光谱重叠图;图中结果说明aie水溶性柱[5]芳烃可以与螺吡喃衍生物之间发生荧光共振能量转移过程;
[0054]
图12为用紫外灯(365nm,32w/cm-2
)照射二元纳米粒子不同时间前后的荧光发射变化光谱图;
[0055]
图13为aie水溶性柱[5]芳烃-螺吡喃衍生物二元超分子纳米粒子和尼罗蓝光谱重叠图;说明aie水溶性柱[5]芳烃与螺吡喃衍生物构筑的二元超分子纳米粒子可以与尼罗蓝之间发生荧光共振能量转移过程;
[0056]
图14为尼罗蓝滴定aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝二元纳米粒子的荧光发射变化光谱图;
[0057]
图15为aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子在水中产生单线态氧能力图;
[0058]
图16为aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子与孟加拉玫瑰红产生单线态氧能力对比图;
[0059]
图17为aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子抗癌细胞效果图;
[0060]
图18为aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子抑菌活性效果图。
具体实施方式
[0061]
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变化和改进。这些都属于本发明的保护范围。
[0062]
本发明公开了一种基于具有聚集诱导发光性柱芳烃大环的可调控性近红外光敏剂的制备方法,该方法首先制备了在柱芳烃结构的meso-位嵌入四苯乙烯单元的水溶性柱芳烃主体功能分子,并进一步制备了具有优异光响应性的螺吡喃衍生物客体分子作为光敏剂及荧光能量传递的桥梁,通过主客体作用构筑了二元超分子纳米粒子。近红外染料尼罗蓝可以负载到该二元超分子纳米粒子中,通过高效的能量转移过程,从而形成具有近红外发光性能的超分子光敏剂材料。制得的超分子光敏剂具有良好的单线态氧(活性氧,ros,会使肿瘤细胞和细菌的细胞膜和细胞壁氧化损伤、蛋白质失活、dna链断裂,最终导致肿瘤细胞、细菌死亡)产生能力和优异的生物相容性(生物相容性是指材料与生物体之间相互作用后,与人体相容程度,也就是说是否会对人体组织造成毒害作用),并且对癌细胞和大肠杆
菌表现出显著的杀伤性。
[0063]
本发明得到的光敏剂三元纳米粒子荧光发射在675nm左右,属于近红外光发射,同时具有aie性能,所以拥有在聚集状态下抗荧光淬灭的优点。在紫外灯(365nm,32w/cm-2
)照射下,其中的螺吡喃衍生物分子为开环状态,可实现荧光共振能量传递(fret)过程和单线态氧产生;在可见光(》500nm,60w/cm-2
)照射下,荧光共振能量传递(fret)过程和单线态氧产生过程关闭,无法产生单线态氧,因此,该光敏剂的荧光性能和单线态氧的产生能力均可通过紫外灯(365nm)和可见光(》500nm)循环照射进行调控,在构建具有可调控性的光敏剂材料方面具有良好的应用前景。
[0064]
实施例1
[0065]
步骤1、制备具有四苯乙烯构象的aie水溶性柱[5]芳烃和螺吡喃衍生物
[0066]
具有聚集诱导发光性的柱芳烃合成工艺如下:
[0067][0068]
(1)1,4-二(2-溴乙氧基)苯的合成:将对苯二酚二羟基醚和三苯基膦按照摩尔比为1:3加入乙腈(或丙酮),在0℃,分批加入四溴化碳(对苯二酚二羟基醚与四溴化碳摩尔比为1:3),在室温下继续搅拌24h,加去离子水淬灭,过滤,洗涤,柱层析分离,得到白色粉末状固体即为1,4-二(2-溴乙氧基)苯。也可以加入去离子水淬灭反应,抽滤并用甲醇与水的混合溶液洗,得到1,4-二(2-溴乙氧基)苯。1h nmr(400mhz,cdcl3)δ(ppm):6.86(s,4h),4.25(t,j=6.2hz,4h),3.62(t,j=6.2hz,4h)。
[0069]
(2)化合物1的合成:将1,4-二(2-溴乙氧基)苯与三聚甲醛按照摩尔比1:1.1加入到二氯甲烷(或三氯甲烷)中,在0℃,加入催化剂三氟化硼乙醚,三氟化硼乙醚与1,4-二(2-溴乙氧基)苯的摩尔比为1:1;室温反应36h后,加去离子水淬灭,分液萃取,干燥,柱层析纯化,白色粉末状固体二(2-溴乙氧基)柱[5]芳烃(化合物1)。化合物1的氢谱如下:1h nmr
(400mhz,cdcl3)δ(ppm):6.91(s,10h),4.23(t,j=5.5hz,20h),3.84(s,10h),3.63(t,j=5.6hz,20h)。
[0070]
(3)化合物2的合成:将化合物1、n-溴代丁二酰亚胺与2,2`-偶氮双(异丁腈)按照摩尔比为1:1.5:0.03加入到四氯化碳,(分批加入n-溴代丁二酰亚胺);回流过夜,加入1勺硅胶,旋干溶剂,柱层析纯化,得到黄色固体meso位羟基修饰的柱[5]芳烃(化合物2)。化合物2的氢谱、碳谱、高分辨数据如下:1h nmr(400mhz,cdcl3)δ(ppm):7.02(s,2h),6.98(s,2h),6.94(s,2h),6.85(s,2h),6.84(s,2h),5.95(s,1h),4.35
–
4.18(m,18h),3.92
–
3.83(m,8h),3.74
–
3.58(m,18h),3.51(s,4h)。
13
c nmr(100mhz,dmso-d6)δ(ppm):131.55,129.37,128.51,128.36,118.22,115.28,115.11,114.87,69.18,68.55,54.75,32.13,32.07,32.02,31.99,31.49,28.68,27.60。hr-esi-ms:m/z[m+h]
+
calcd for[c
55h60o11
br
10
h]
+
1696.5945,found 1696.5722。
[0071]
(4)化合物3的合成:将化合物2与重铬酸吡啶鎓按照摩尔比1:4加入到二氯甲烷,回流1h,抽滤,滤液旋干,得到黄色固体meso位羰基修饰的柱[5]芳烃(化合物3)。化合物3的氢谱、碳谱、高分辨数据如下:1hnmr(400mhz,cdcl3)δ(ppm):7.13(s,2h),7.07(s,2h),6.89(s,2h),6.77(s,2h),6.07(s,2h),4.44
–
4.20(m,18h),3.95(s,8h),3.79
–
3.65(m,14h),3.56(t,j=6.0hz,4h),3.12(s,4h)。
13
c nmr(100mhz,cdcl3)δ(ppm):150.99,150.17,150.12,149.91,149.53,135.76,129.96,129.54,129.37,128.93,116.64,115.98,115.92,114.98,112.19,69.35,69.23,69.12,68.87,68.16,30.65,30.24,29.93,29.51,29.33,29.21。hr-esi-ms:m/z[m+h]
+
calcd for[c
55h58o11
br
10
h]
+
1694.5789,found 1694.8491。
[0072]
(5)化合物4的合成:将化合物3、锌粉和二苯甲酮按照摩尔比为1:40:10加入到四氢呋喃,在0℃,加入四氯化钛,化合物3与四氯化钛摩尔比为1:20,回流过夜,淬灭,抽滤,分液萃取,干燥,柱层析纯化,得到白色固体meso位二苯甲酮偶联的柱[5]芳烃(化合物4)。化合物4的氢谱、碳谱、高分辨数据如下:1hnmr(400mhz,cdcl3)δ(ppm):7.09(d,j=5.1hz,10h),7.01(s,2h),6.96(s,2h),6.70(s,2h),6.47(s,2h),6.34(s,2h),4.32
–
4.16(m,14h),3.85(d,j=31.3hz,12h),3.71
–
3.59(m,12h),3.49(s,2h),3.40(s,4h),3.29(s,4h)。
13
c nmr(100mhz,cdcl3)δ(ppm):149.42,148.84,148.77,147.61,141.89,141.52,129.52,129.49,126.52,117.60,115.26,115.09,114.95,114.87,114.59,68.11,68.05,67.36,29.68,29.63,29.29,29.17,28.96,28.52,27.58。hr-esi-ms:m/z[m+na]
+
calcd for[c
68h68o10
br
10
na]
+
1866.6442,found 1866.6461。
[0073]
(6)阳离子型水溶性柱[5]芳烃化合物5的合成:将化合物4与三甲胺(三甲胺的醇溶液、三甲胺的吡啶溶液或三甲胺的咪唑溶液)按照摩尔比为1:4加入到四氢呋喃,回流36h,重结晶,得到白色固体阳离子型水溶性柱[5]芳烃(化合物5)。化合物5的氢谱、碳谱、高分辨数据如下:1h nmr(400mhz,d2o)δ(ppm):7.21(s,10h),7.09(s,10h),4.52(d,j=39.4hz,20h),3.88(d,j=27.2hz,28h),3.24
–
3.09(m,90h).
13
c nmr(101mhz,d2o)δ149.23(s),131.11(s),128.33(s),127.59(s),64.97(s),64.09(d,j=50.9hz),63.54
–
62.44(m),55.45
–
55.12(m),54.15(d,j=13.0hz),29.21(s)。hr-esi-ms:[m
–
2br]
2+
calcd for[c
98h158o10n10
br8]
2+
1137.7791,found 1137.7810。
[0074]
螺吡喃衍生物客体分子合成工艺如下:
[0075][0076]
步骤1a、化合物a的合成:在氮气氛围保护下,将2,3,3-三甲基二氢吲哚(3.02g,18.73mmol)溶于乙腈(60ml)。然后将溴丙炔(3.30ml,27.74mmol)加入上述溶液中,并在氮气氛围下回流过夜。反应结束后,将反应液在减压条件下蒸除乙腈溶剂,得到粗产物a为棕色油状物(5.45g)。混合物可直接应用于下一步。
[0077]
步骤1b、化合物b的合成:在氮气氛围保护和室温条件下,将(1)中制得的粗产物a(3.6g,18.16mmol)在koh溶液(1.6m,50ml)中搅拌30分钟。然后将上述溶液用乙酸乙酯(3
×
50ml)萃取,所得有机相经水(3
×
50ml)洗涤和无水硫酸钠干燥后,减压蒸除溶剂,柱色谱分离纯化(正己烷),得到目标产物b为棕色油状物,可直接应用于下一步。化合物b的氢谱如图1所示:1h nmr(400mhz,cdcl3,298k)δ(ppm):7.17
–
7.10(m,2h),6.82(s,1h),6.65(d,j=7.8hz,1h),4.26(s,2h),4.01(d,j=12.9hz,2h),2.14(s,1h),1.36(s,6h)。
[0078]
步骤1c、化合物c的合成:在回流条件下,将2-羟基-5-硝基苯甲醛(0.79g,4.0mmol)溶解在乙醇中。然后将化合物b(0.75g,4.5mmol)加入上述溶液中,并在氮气氛围保护下回流3小时。反应结束后,将所得反应液在减压条件下蒸除溶剂,用柱色谱法分离纯化(正己烷/乙酸乙酯=50:1,v/v),得到目标产物c为棕色固体(0.69g,产率为50%)。化合物c的氢谱如图2所示:1h nmr(400mhz,cdcl3,298k)δ(ppm):8.06
–
8.00(m,2h),7.22(dd,j=7.7,1.1hz,1h),7.12(dd,j=7.3,0.6hz,1h),6.99
–
6.92(m,2h),6.82(d,j=7.8hz,1h),6.75(d,j=9.9hz,1h),5.89(d,j=10.3hz,1h),4.07
–
3.83(m,2h),2.09(s,1h),1.30(s,3h),1.20(s,3h)。
[0079]
步骤1d、螺吡喃衍生物sp-g的合成:将化合物c(0.15g,0.43mmol)、叠氮磺酸钠化物(0.13g,0.56mmol)和三[(1-苄基-1h-1,2,3-三唑-4-基)甲基]胺(0.023g,0.043mmol)溶解在干燥的混合溶剂二氯甲烷/甲醇(1:1,10ml)中,并在室温下搅拌10分钟。然后将[cu(ch3cn)4]pf6(0.02g,0.043mmol)加入上述溶液中,并在室温下搅拌24小时。反应结束后,减压蒸除溶剂,将所得的粗产物溶解在甲醇中,并加入到乙醚中,会有浅粉色沉淀析出,减压抽滤后用乙醚洗涤沉淀,得到目标产物螺吡喃衍生物sp-g为粉色粉末(0.18g,产率为72%)。螺吡喃衍生物sp-g的氢谱如图3所示,碳谱如图4所示,质谱如图5所示:1h nmr(400mhz,dmso-d6,298k)δ(ppm):8.21(d,j=2.5hz,1h),8.00(dd,j=8.9,2.5hz,1h),7.92
(s,1h),7.24(d,j=10.4hz,1h),7.12(dd,j=16.3,7.3hz,2h),6.86
–
6.77(m,2h),6.58(d,j=7.8hz,1h),6.07(d,j=10.3hz,1h),4.47(d,j=15.8hz,1h),4.32(d,j=15.2hz,1h),4.25(t,j=7.0hz,2h),2.38
–
2.33(m,2h),1.75
–
1.67(m,2h),1.54
–
1.49(m,2h),1.31
–
1.13(m,10h).
13
c nmr(100mhz,dmso-d6,298k):δ(ppm):159.53,146.72,140.99,136.08,129.03,128.01,126.15,123.31,122.10,119.86,119.29,115.94,107.53,106.59,52.85,51.80,49.66,30.10,28.17,26.21,25.46,20.01.hr-esi-ms:m/z[m+h]
+
calcd for[c
27h31
n5nao6s]
+
576.1893,found 576.1944;[m+na]
+
calcd for[c
27h30
n5na2o6s]
+
598.1712,found 598.1767.
[0080]
步骤2、采用具有四苯乙烯构象的aie水溶性柱[5]芳烃和螺吡喃衍生物制备二元超分子纳米粒子溶液
[0081]
aie水溶性柱[5]芳烃-螺吡喃衍生物二元超分子荧光纳米粒子是以具有四苯乙烯构象的aie水溶性柱[5]芳烃为主体,以螺吡喃衍生物作为客体分子,通过主客体作用构筑的二元超分子荧光纳米粒子。
[0082]
构筑方法如下:常温下配制浓度为1mm的具有四苯乙烯构象的aie水溶性柱[5]芳烃水溶液和浓度为2mm的螺吡喃衍生物水溶液,将螺吡喃衍生物水溶液快速注入到aie水溶性柱[5]芳烃水溶液中,均匀混合后得到二元超分子纳米粒子溶液,后取定量加水稀释至制定浓度。稀释后得到二元超分子纳米粒子溶液中aie水溶性柱[5]芳烃的最终浓度为0.02mm,螺吡喃衍生物的最终浓度为0.08mm。
[0083]
如图7所示,构筑的aie水溶性柱[5]芳烃-螺吡喃衍生物二元纳米粒子透射电镜图,从图中我们可以看出该纳米粒子尺寸均一,且粒径大约为200-300nm。
[0084]
如图8所示,构筑的aie水溶性柱[5]芳烃-螺吡喃衍生物二元纳米粒子的dls数据显示,粒径大约276nm。
[0085]
步骤3、将尼罗蓝作为受体负载到二元超分子纳米粒子中制备三元纳米粒子溶液
[0086]
将染料受体尼罗蓝负载到二元纳米粒子的方法如下:配制浓度为0.1mm尼罗蓝水溶液为,将尼罗蓝水溶液滴加到aie水溶性柱[5]芳烃-螺吡喃衍生物二元超分子纳米粒子溶液中,均匀混合后得到aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子溶液;其中,尼罗蓝、aie水溶性柱[5]芳烃和螺吡喃衍生物的最终浓度分别为0.002mm、0.02mm、0.08mm。
[0087]
如图9所示,构筑的aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子透射电镜图,从图中我们可以看出该纳米粒子尺寸均一,且粒径为200-350nm;
[0088]
如图10所示,aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子的dls数据显示,粒径大约333nm,进一步表明染料尼罗蓝已经成功包载入二元纳米粒子中。
[0089]
性能测试:
[0090]
(一)将步骤1中制备的螺吡喃衍生物客体分子进行光响应能力测试:
[0091]
螺吡喃衍生物客体分子在紫外灯(365nm,32w)和可见光(》500nm,60w)循环照射下,通过紫外可见吸收光谱图变化,测试螺吡喃衍生物客体分子光响应性,如图6所示,图中显示螺吡喃衍生物客体分子在避光条件下,随着在紫外灯(365nm,32w)照射时间的增长,螺吡喃衍生物客体分子的紫外可见光光谱发生了明显的变化,在500-600nm区域内出现了新的吸收峰;随后用可见光(》500nm,60w)照射螺吡喃衍生物客体分子,在500-600nm的吸收峰
逐渐消失并且颜色可以在红色和无色(在紫外灯(365nm)照射下,溶液为红色:在可见光(》500nm)照射下,溶液为无色)之间进行转换,这表明螺吡喃衍生物客体分子具有非常好的光响应性。
[0092]
(二)aie水溶性柱[5]芳烃-螺吡喃衍生物二元纳米粒子的光控性质测试
[0093]
图11为aie水溶性柱[5]芳烃与螺吡喃衍生物的光谱重叠图;图中结果说明aie水溶性柱[5]芳烃作为给体,螺吡喃衍生物作为受体,两者之间具有很好的光谱重叠,可以发生荧光共振能量转移过程;
[0094]
图12为用紫外灯365nm照射二元纳米粒子不同时间前后的荧光发射变化图,图中显示:当用紫外灯(365nm,32w/cm-2
)不断照射aie水溶性柱[5]芳烃-螺吡喃衍生物二元纳米粒子溶液,属于aie主体化合物特征荧光峰强度不断下降,这是由于在紫外灯照射下,螺吡喃衍生物客体分子的结构发生了开环,与主体分子之间发生了荧光共振能量转移,从而导致主体分子的荧光强度下降,客体分子的荧光强度升高,此时溶液中荧光的颜色由主体化合物的蓝绿色逐渐变化为客体化合物的粉红色。
[0095]
(三)aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子的光控性质测试
[0096]
图13为aie水溶性柱[5]芳烃-螺吡喃衍生物二元超分子纳米粒子和尼罗蓝光谱重叠图;图中结果说明aie水溶性柱[5]芳烃-螺吡喃衍生物二元超分子纳米粒子可以与尼罗蓝之间发生荧光共振能量转移过程;
[0097]
图14为不断向aie水溶性柱[5]芳烃-螺吡喃衍生物二元纳米粒子溶液滴加受体染料尼罗蓝,并用紫外灯(365nm,32w/cm-2
,2min)照射aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子的荧光发射变化图,图中显示:当不断向aie水溶性柱[5]芳烃-螺吡喃衍生物二元纳米粒子溶液滴加染料尼罗蓝,并用紫外灯(365nm,32w/cm-2
,2min)照射三元纳米粒子,属于aie水溶性柱[5]芳烃和螺吡喃衍生物客体化合物的特征荧光峰强度不断下降,属于尼罗蓝化合物的特征荧光峰强度升高,这是由于在紫外灯照射下,客体分子的结构处于开环状态,aie水溶性柱[5]芳烃-螺吡喃衍生物二元纳米粒子与尼罗蓝之间发生了荧光共振能量转移,从而导致aie水溶性柱[5]芳烃-螺吡喃衍生物二元纳米粒子的荧光强度下降,尼罗蓝的荧光强度升高,此时荧光的颜色由二元纳米粒子的粉红色逐渐变化为尼罗蓝化合物的深红色。
[0098]
(四)aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子产生单线态氧能力测试:
[0099]
采用9,10-蒽二基-二(亚甲基)二丙二酸(abda)为指示剂检测单线态氧的产生。配制aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子为1mm的标准溶液,配制abda和孟加拉玫瑰花(rb)为2mm的标准溶液,将一定量的abda的标准溶液分别加入到三元纳米粒子溶液和rb样品溶液中,再用水稀释。稀释后的所得溶液中abda的最终浓度为0.2mm,三元纳米粒子和孟加拉玫瑰花(rb)的最终浓度为15μm。使用紫外可见分光光度计检测样品溶液的吸光度,并根据abda吸光度的变化检测单线态氧的产生情况。图15所示,abda吸光度的降低表明aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子导致单线态氧的产生过程,即该三元纳米粒子可以产生单线态氧(ros)。图16所示,以孟加拉玫瑰红(rb)为参照物,证明aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子的单线态氧产生能力十分优异,即有高效的ros产生能力。
[0100]
实施例2
[0101]
将实施例1构筑的aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子进行肿瘤细胞毒性实验,将hela细胞以每孔1
×
104个细胞的密度,接种在96孔deme培养基中,保持每孔100μl,在37℃和5%co2环境下的培养箱内培养24h,加入不同浓度的三元纳米粒子药物(0μm,0.05μm,0.1μm,0.2μm,0.3μm),并进行循环照射(每次循环照射包括:使用紫外灯(32w/cm-2
,365nm)照射1分钟,可见光(60w/cm-2
,》500nm)照射2分钟),继续培养4h后更换deme培养液并继续培养24h,每孔加入10μlcck-8溶液,继续培养4h后,用酶标仪测定450nm吸光值,并计算细胞存活率,无光照条件下的实验操作相同。结果如图17所示,表明加入三元纳米粒子后对hela肿瘤细胞具有一定的致死能力,而在非光照条件下,该三元纳米粒子对肿瘤细胞不具有毒性,即具有很好的生物相容性。
[0102]
实施例3
[0103]
将实施例1构筑的aie水溶性柱[5]芳烃-螺吡喃衍生物-尼罗蓝三元纳米粒子进行抗菌实验,取10μl三元纳米粒子药物(0.2μm)加入到浓度为1.0
×
108cfu/ml大肠杆菌培养液中(不加入三元纳米粒子药物的作为空白组作对照),并在黑暗环境中静置30分钟,然后使用紫外灯(32w/cm-2
,365nm)照射1分钟,可见光(60w/cm-2
,》500nm)照射2分钟,将稀释的菌液分别涂抹在固体lb琼脂培养基,在37℃恒温箱中培养24h后,通过计数培养基上长出的菌落个数,以确定细菌的存活率和抑菌率。结果如图18所示,空白菌落数1156个左右,实验组菌落数109个左右,表明加入三元纳米粒子后具有抑制大肠杆菌增殖的能力,抑菌率在90%左右。
[0104]
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。在不冲突的情况下,本技术的实施例和实施例中的特征可以任意相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1