一类含苯并菲的多环芳烃盘状液晶化合物及其制备方法
1.本发明属于有机光电功能材料技术领域,涉及一类含苯并菲的多环芳烃盘状液晶化合物的制备方法、及其作为有机光电材料的用途。
背景技术:
2.现有技术中,盘状液晶分子通常由中心的刚性芳香内核及其围绕的多条柔性链构成,是一类具备着独特自组装有序的各向异性超分子结构的材料。盘状液晶的自组装和自修复功能使其较其他材料在器件加工工艺、制作成本上有明显的优势,并且在有机光电子学领域作为有机发光二极管、有机场效应晶体管、有机光伏器件、有机太阳能电池、存储元件、传感器等中的应用已经进行了广泛研究,显现出巨大的应用前景。苯并菲盘状向列相(nd)单体和光聚合产物已经成功应用于液晶显示屏视角扩展光学补偿薄膜,成为盘状液晶第一个商业化产品。
3.苯并菲衍生物分子具有易合成、易加工的优点,同时其熔点较低,因而目前成为研究较多的盘状液晶材料之一。从应用角度来说,扩大液晶相的温度范围,降低熔点,是盘状液晶材料实用化首先亟待解决的问题,这主要可以通过改变侧链的长度和对称性来实现。通过引入不同取代基,苯并菲衍生物的熔点能降低至室温而同时保持较高的清亮点。
4.有机半导体材料可以通过分子设计调控其物理性质。研究与开发有实用价值的液晶半导体材料,提高其电荷迁移速率是关键。研究发现,液晶分子电子结构、分子间排列紧密程度以及液晶相态结构,与电荷迁移速率密切相关。分子间排列有序度越高,其电荷载流子迁移速率越高。因此,围绕提高迁移率,扩大芳烃共轭体系,用氟原子取代芳核上氢原子改变载流子极性、用噻吩基取代苯环等分子设计手段,可显著改善液晶相稳定性和堆积有序度,提高电荷传输速率,改善材料在空气中的稳定性和器件的使用寿命。
技术实现要素:
5.针对上述问题,本发明提供了一类含苯并菲的多环芳烃盘状液晶化合物的制备方法,该类液晶化合物在合成上简单便捷,主要是通过suzuki偶联后再环化二聚得到的;以一些芳基卤化物为原料,可以与硼酸或硼酸酯化合物发生suzuki 偶联;因此通过简单的偶联反应,取代反应等一系列步骤,合成含苯并菲的多环芳烃盘状液晶化合物;该类化合物产率较高,合成路线简单,且可进一步制备有机半导体材料。
6.本发明的技术方案是:本发明所述的一类含苯并菲的多环芳烃盘状液晶化合物,所述化合物具有下述通式(i)的结构:
[0007][0008]
进一步的,在通式(i)中,所述的r为直链烷基-c
nh2n+1
;
[0009]
其中,n表示碳原子数为14~18的一些整数,
[0010]
直链烷基包括正十四烷、正十六烷及正十八烷。
[0011]
进一步的,通式(i)中所述的一类含苯并菲的多环芳烃盘状液晶化合物的制备方法,具体操作步骤如下:
[0012]
步骤(1):中间体a的制备,即suzuki偶联反应:
[0013][0014]
首先,在氮气保护下,将1摩尔份的4-溴-1-碘-2-甲氧基苯和0.1摩尔份的四(三苯基膦)钯加入至脱气的1,4-二氧六环中,室温下搅拌30min;
[0015]
然后,依次加入1摩尔份的3,4-二甲氧基苯硼酸、1.5摩尔份的碳酸钾、3 摩尔份的四丁基溴化铵,在80℃下反应8h,反应完全后,将反应液冷却至室温,二氯甲烷/水(v/v=1/1)萃取,收集有机层,用无水硫酸镁干燥,过滤,旋干有机溶剂,通过硅胶柱层析分离纯化,真空干燥得到产物:中间体a;
[0016]
步骤(2):中间体b的制备,即miyaura硼酸酯化反应:
[0017][0018]
在氮气保护下,将1摩尔份的化合物a、1.1摩尔份的双(频哪醇合)二硼、3 摩尔份的醋酸钾、0.05摩尔份的[1,1'-双(二苯基膦基)二茂铁]二氯化钯依次加入至干燥的n,n-二甲基甲酰胺中,在90℃下反应24h,反应完全后,将反应液冷却至室温,二氯甲烷/水(v/v
=1/1)萃取,收集有机层,用无水硫酸镁干燥,过滤,旋干有机溶剂,通过硅胶柱层析分离纯化,真空干燥得到产物:中间体b;
[0019]
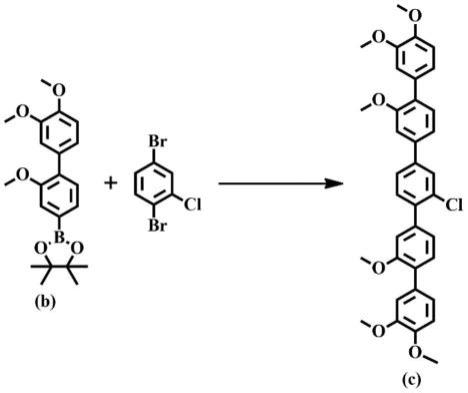
步骤(3):中间体c的制备,即suzuki偶联反应:
[0020][0021]
在氮气保护下,将2.2摩尔份的化合物b、1摩尔份的2-氯-1,4-二溴苯、0.1 摩尔份的[1,1'-双(二苯基膦基)二茂铁]二氯化钯、6摩尔份的氟化铯依次加入至脱气的混合溶剂1,4-二氧六环/水(v/v=2/1)中,在110℃下反应12h,反应完全后,将反应液冷却至室温,用二氯甲烷/水(v/v=1/1)萃取,收集有机层,无水硫酸镁干燥,过滤,旋干有机溶剂,通过硅胶柱层析分离纯化,真空干燥得到产物:中间体c;
[0022]
步骤(4):中间体d的制备,即脱甲基化反应:
[0023][0024]
在氮气保护下,将1摩尔份的化合物c加入至干燥的二氯甲烷中,置于
–
78℃使其充分冷却,缓慢加入15摩尔份的三溴化硼,在
–
78℃下反应2h,之后将反应混合物自然升温至0℃再搅拌3h,然后将反应混合物再次冷却至
–
78℃,加入甲醇淬灭反应,自然升温至室温后再搅拌5h,旋干有机溶剂;
[0025]
向所得混合物中加入去离子水并在70℃下搅拌2h,过滤,通过硅胶柱层析分离纯化,真空干燥得到产物:中间体d;
[0026]
步骤(5):中间体e的制备,即取代反应:
[0027][0028]
在氮气保护下,将1摩尔份的化合物d和30摩尔份的碳酸钾加入至干燥的 n,n-二甲基甲酰胺中,室温搅拌30min,然后在80℃下缓慢加入18摩尔份的正溴代烷烃(c
nh2n+1
br),在此温度下回流反应48h,反应完全后,将反应液冷却至室温,用乙醚/水(v/v=1/1)萃取,收集有机层,无水硫酸镁干燥,过滤,旋干有机溶剂,通过硅胶柱层析分离纯化,真空干燥得到产物:中间体e;
[0029]
步骤(6):通式(i)稠环芳烃盘状液晶化合物的制备,即环化二聚反应;
[0030][0031]
在氮气保护下,将1摩尔份的化合物e、0.05摩尔份的二氯化钯、0.1摩尔份的正丁基二(1-金刚烷基)膦、3摩尔份的碳酸铯依次加入至脱气的环戊基甲醚中,在140℃下回流反应24h,反应完全后,将反应液冷却至室温,加入水淬灭反应,用二氯甲烷/水(v/v=1/1)进行萃取,收集有机层,无水硫酸镁干燥,旋干有机溶剂,通过硅胶柱层析分离纯化,真空干燥得到产物(i)。
[0032]
进一步的,一类含苯并菲的多环芳烃盘状液晶化合物的制备方法,所述的室温在20-25℃。
[0033]
进一步的,所述制备方法制备的一类含苯并菲的多环芳烃盘状液晶化合物在有机光电材料中的应用。
[0034]
本发明的有益效果是:本发明的特点是:1、本发明提供的一种含苯并菲核的稠环芳烃盘状液晶化合物是一类室温盘状液晶;其化学和热稳定性较好,具有较宽的介晶相温
度范围,呈现高度有序的层状液晶相,可作为潜在的制备光电器件的π共轭盘状液晶材料;2、本发明提供的一种含苯并菲的多环芳烃盘状液晶化合物的制备方法,该合成路线简单快捷且条件温和,收率适中;该类化合物通过稠合的方式将多个芳基连在一起,形成了一个较大芳香共轭体系,有效地加强了分子的刚性核以及分子之间的π-π作用,在具有强的刚性核以及外围的多条烷氧基柔性链的调节作用下,其可以在较宽的温度范围内自组装成高度有序且稳定的层状液晶中间相。
具体实施方式
[0035]
为了更清楚地说明本发明的技术方案,下面对本发明的技术方案做进一步的详细说明:
[0036]
本实施例提供的化合物是通式(i)中化合物的中间体,其制备反应如下:
[0037]
中间体a的制备:
[0038][0039]
在氮气保护下,将4-溴-1-碘-2-甲氧基苯(5.163g,16.5mmol)和四(三苯基膦)钯(1.733g,1.5mmol)加入至脱气的1,4-二氧六环(100ml)中,室温下搅拌30min,然后依次加入3,4-二甲氧基苯硼酸(2.730g,15.0mmol)、碳酸钾水溶液(11.3ml,2m)、四丁基溴化铵(14.507g,45.0mmol),在80℃下反应8h,反应完全后,将反应液冷却至室温,二氯甲烷/水(v/v=1/1)萃取,收集有机层,用无水硫酸镁干燥,过滤,旋干有机溶剂,通过硅胶柱层析分离纯化(v石油醚/v乙酸乙酯=50/1),真空干燥得到产物a(4.363g,产率90%)。
[0040]1h nmr(600mhz,cdcl3):δppm 7.18-7.14(m,2h),7.10(d,j=1.56hz,1h), 7.05-7.03(m,2h),6.93(d,j=8.88hz,1h),3.92(s,3h),3.90(s,3h),3.82(s,3h). 13
c nmr(151mhz,cdcl3):δppm 155.90,147.33,147.27,130.63,129.01,128.37, 122.76,120.63,120.32,113.62,111.65,109.77,54.86,54.84,54.80.hrms(esi) m/z calcd for c
15h15
bro3[m+h]
+
:323.02828,found 323.02822.
[0041]
实施例2
[0042]
本实施例提供的化合物是通式(i)中化合物的中间体,其制备反应如下:
[0043]
中间体b的制备:
[0044]
[0045]
在氮气保护下,将化合物a(3.232g,10.0mmol)、双(频哪醇合)二硼(2.793 g,11.0mmol)、醋酸钾(2.944g,30.0mmol)、[1,1'-双(二苯基膦基)二茂铁]二氯化钯(0.366g,0.5mmol)依次加入至干燥的n,n-二甲基甲酰胺(40ml)中,在90℃下反应24h,反应完全后,将反应液冷却至室温,二氯甲烷/水(v/v= 1/1)萃取,收集有机层,用无水硫酸镁干燥,过滤,旋干有机溶剂,通过硅胶柱层析分离纯化(v石油醚/v乙酸乙酯=30/1),真空干燥得到产物b(2.703g,产率73%)。
[0046]1h nmr(600mhz,cdcl3):δppm 7.49(d,j=7.38hz,1h),7.39(s,1h),7.34 (d,j=7.38hz,1h),7.11(d,j=5.88hz,2h),6.93(d,j=8.76hz,1h),3.92(s,3h), 3.90(s,3h),3.87(s,3h),1.37(s,12h).
13
c nmr(151mhz,cdcl3):δppm 154.79, 147.25,147.21,132.28,129.98,129.12,126.49,120.81,115.72,111.86,109.72, 54.85,54.85,54.65,23.83.hrms(esi)m/z calcd for c
21h27
bo5[m+h]
+
: 371.20298,found 371.20284.
[0047]
实施例3
[0048]
本实施例提供的化合物是通式(i)中化合物的中间体,其制备反应如下:
[0049]
中间体c的制备:
[0050][0051]
在氮气保护下,将化合物b(8.148g,22.0mmol)、2-氯-1,4-二溴苯(2.701g,10.0mmol)、[1,1'-双(二苯基膦基)二茂铁]二氯化钯(0.732g,0.1mmol)、6摩尔份的氟化铯(19.549g,60.0mmol)依次加入至脱气的混合溶剂1,4-二氧六环(90 ml)和水(45ml)中,在110℃下反应12h,反应完全后,将反应液冷却至室温,用二氯甲烷/水(v/v=1/1)萃取,收集有机层,无水硫酸镁干燥,过滤,旋干有机溶剂,通过硅胶柱层析分离纯化(v石油醚/v乙酸乙酯=10/1),真空干燥得到产物c(4.478g,产率75%)。
[0052]1h nmr(600mhz,cdcl3):δppm 7.78(d,j=1.80hz,1h),7.62-7.61(m,1h), 7.52(d,j=7.86hz,1h),7.44-7.41(m,2h),7.30-7.28(m,1h),7.21(d,j=1.62hz, 1h),7.17-7.13(m,6h),6.97(d,j=8.76hz,2h),3.94-3.93(m,15h),3.88(s,3h). 13
c nmr(151mhz,cdcl3):δppm 155.81,154.97,147.43,147.39,147.34,147.25, 140.63,138.58,138.08,138.03,131.85,130.66,130.14,129.77,129.57,129.34, 129.18,128.83,127.48,124.51,120.91,120.86,120.82,118.57,112.05,111.97, 111.72,109.93,109.89,109.02,54.93,54.92,54.91,54.89,54.79,54.75.hrms(esi) m/z calcd for c
36h33
clo6[m+h]
+
:597.20439,found 597.20504.
[0053]
实施例4
[0054]
本实施例提供的化合物是通式(i)中化合物的中间体,其制备反应如下:
[0055]
中间体d的制备:
[0056][0057]
在氮气保护下,将化合物c(597mg,1.0mmol)加入至干燥的二氯甲烷(10 ml)中,置于
–
78℃使其充分冷却,缓慢加入15摩尔份的三溴化硼(15ml, 15.0mmol,1.0m二氯甲烷溶液),在
–
78℃下反应2h,之后将反应混合物自然升温至0℃并再搅拌3h,然后将反应混合物再次冷却至
–
78℃,加入甲醇淬灭反应,自然升温至室温并再搅拌5h,旋干有机溶剂。向所得混合物中加入去离子水(10ml)并在70℃下搅拌2h,过滤,通过硅胶柱层析分离纯化(v石油醚/v二氯甲烷=1/1),真空干燥得到产物d(487mg,产率95%)。
[0058]1h nmr(600mhz,dmso-d6):δppm 9.62(s,1h),9.59(s,1h),8.92-8.91(m, 4h),7.75(d,j=1.62hz,1h),7.66-7.64(m,1h),7.51(d,j=7.98hz,1h),7.30(d,j =8.34hz,1h),7.27(d,j=7.80hz,1h),7.22-7.21(m,2h),7.07(d,j=1.50hz, 2h),7.02(d,j=1.38hz,1h),6.94-6.93(m,1h),6.87-6.86(m,2h),6.78(d,j=8.04 hz,2h).
13
c nmr(151mhz,thf-d8):δppm 155.18,154.34,145.34,145.26, 145.18,141.88,139.46,138.89,138.79,132.92,132.03,131.09,130.31,130.23, 130.10,130.01,129.16,128.73,128.29,125.51,121.10,120.94,120.87,118.50, 117.49,116.77,116.70,115.24,115.18,114.74.hrms(maldi-tof,positive)m/z calcd for c
30h21
clo6[m]
+
:512.103,found 512.074.
[0059]
实施例5
[0060]
本实施例提供的化合物是通式(i)中化合物的中间体,其中r为直链烷基
ꢀ‑c14h29
,其制备反应如下:
[0061]
中间体e的制备:
[0062][0063]
在氮气保护下,将化合物d(103mg,0.2mmol)和碳酸钾(829mg,6.0mmol) 加入至干燥的n,n-二甲基甲酰胺(30ml)中,室温搅拌30min,然后在80℃下缓慢加入1-溴十四烷(998mg,3.6mmol),在此温度下回流反应48h,反应完全后,将反应液冷却至室温,用乙醚/水(v/v=1/1)萃取,收集有机层,无水硫酸镁干燥,过滤,旋干有机溶剂,通过硅胶柱层析分离纯化(v石油醚/v二氯甲烷=10/1),真空干燥得到产物e(162mg,产率48%)。
[0064]1h nmr(600mhz,cdcl3):δppm 7.75(d,j=1.62hz,1h),7.59-7.58(m,1h), 7.49(d,j=7.92hz,1h),7.44-7.41(m,2h),7.25(d,j=1.26hz,2h),7.23-7.22(m, 1h),7.18(d,j=1.50hz,1h),7.13-7.10(m,4h),6.94(d,j=8.40hz,2h), 4.06-3.99(m,12h),1.87-1.82(m,8h),1.79-1.75(m,4h),1.51-1.35(m,36h), 1.26-1.25(m,96h),0.89-0.86(m,18h).
13
c nmr(151mhz,cdcl3):δppm 155.37, 154.48,147.38,147.34,147.28,140.60,138.29,138.24,138.06,137.77,131.80, 130.61,130.06,129.98,129.78,129.33,129.26,128.87,127.41,124.44,123.34, 122.44,120.99,120.76,118.42,114.67,113.04,112.92,112.35,110.22,68.29,68.25, 67.69,67.61,30.92,30.48,29.11,28.72,28.67,28.49,28.37,25.20,25.19,25.12, 25.09,21.68,13.10.hrms(maldi-tof,positive)m/z calcd for c
114h189
clo6[m]
+
: 1690.421,found 1690.417.
[0065]
实施例6
[0066]
本实施例提供的化合物是通式(i)的化合物,其中r为直链烷基-c
14h29
,其制备反应如下:
[0067][0068]
在氮气保护下,将化合物e(169mg,0.1mmol)、二氯化钯(0.9mg,0.005 mmol)、正丁基二(1-金刚烷基)膦(3.6mg,0.01mmol)、碳酸铯(98mg,0.3mmol) 依次加入至脱气的环戊基甲醚(0.10ml)中,在140℃下回流反应24h,反应完全后,将反应液冷却至室温,加入水淬灭反应,用二氯甲烷/水(v/v=1/1) 进行萃取,收集有机层,无水硫酸镁干燥,旋干有机溶剂,通过硅胶柱层析分离纯化(v石油醚/v二氯甲烷=10/1),真空干燥得到产物(i)(252mg,产率76%)。
[0069]1h nmr(600mhz,8:2thf-d8:dmso-d6):δppm 7.74(s,6h),7.39-7.38(d,j =7.68hz,4h),7.30-7.28(m,6h),7.23(d,j=1.92hz,4h),7.08-7.06(m,4h),6.93 (m,4h),4.09(t,j=6.36hz,8h),4.02-3.99(m,16h),1.83-1.78(m,24h),1.62-1.45 (m,48h),1.41-1.30(m,216h),0.90-0.88(m,36h).
13
c nmr(151mhz,cdcl3):δ ppm 156.31,148.40,148.30,140.72,140.10,131.03,130.99,129.80,127.44,121.96, 119.48,115.712,113.40,111.39,69.31,68.68,31.95,31.45,30.20,29.74,29.70, 29.51,29.40,26.24,26.15,26.12,22.71,14.13.hrms(maldi-tof,positive)m/z calcd for c
228h376o12
[m]
+
:3308.888,found 3309.113.
[0070]
最后,应当理解的是,本发明中所述实施例仅用以说明本发明实施例的原则;其他的变形也可能属于本发明的范围;因此,作为示例而非限制,本发明实施例的替代配置可视为与本发明的教导一致;相应地,本发明的实施例不限于本发明明确介绍和描述的实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1