一种纳米金刚石键接荧光染料的制备方法及应用
1.本发明属于纳米金刚石加工技术领域,尤其涉及一种纳米金刚石键接荧光染料的制备方法及应用。
背景技术:
2.目前,纳米金刚石与荧光分子的化学偶联可以很好地找到它们在细胞内不同时刻的位置。利用纳米金刚石与靶向分子的生物结合和次级抗体的荧光免疫检测也是目前寻找癌症生物标记的一种方法。
3.lim等人以羧基化纳米金刚石为原料,经过表面修饰改性后,成功地与荧光素结合,制备出具有很强绿色荧光的纳米粒子。(lim d g,kim k h,kang e,et al.comprehensive evaluation of carboxylated nanodiamond as a topical drug delivery system[j].international journal of nanomedicine,2016,2016(11):2381-2395)先将羧基化纳米金刚石转化为酰氯,随后分散在无水二甲基亚砜(dmso)中,采用吡啶和乙二胺与nd-cocl反应,获得相应的酰胺后成功与荧光素结合,得到荧光纳米粒子。
[0004]
而pedroso-santana等人则通过将表面功能化的纳米金刚石与荧光分子结合,提出了电子转移过程中荧光增强的存在。(seidy p s,noralvis f s,andrei s s,et al.a nanodiamond-fluorescein conjugate for cell studies[j].advances in natural sciences:nanoscience&nanotechnology,2018,9(2018):e015013.)证明了纳米金刚石-荧光素偶联物可以用来跟踪纳米粒子在细胞内的位置。
[0005]
但是,目前纳米金刚石本征荧光强度较低,纳米金刚石表面直接胺化过程中还存在的杂质引入且不能直接得到单分散纳米金刚石的技术问题。
[0006]
通过上述分析,现有技术存在的问题及缺陷为:
[0007]
(1)现有的纳米金刚石本征荧光强度较低。
[0008]
(2)目前纳米金刚石表面直接胺化过程中还存在的杂质引入且不能直接得到单分散纳米金刚石的技术问题。
[0009]
(3)有机荧光染料易于沾染皮肤,无法轻易用水清除。
技术实现要素:
[0010]
针对现有技术存在的问题,本发明提供了一种纳米金刚石键接荧光染料的制备方法及应用。
[0011]
本发明是这样实现的,一种纳米金刚石键接荧光染料的制备方法,所述纳米金刚石键接荧光染料的制备方法包括以下步骤:
[0012]
步骤一,选择合适粒径的纯化纳米金刚石粉体,在室温条件下将纯化纳米金刚石粉体与乙二胺、丙二胺,置于研磨釜中进行研磨;
[0013]
步骤二,将研磨后的混合物离心分离、真空干燥,制得单分散胺化纳米金刚石黑色粉末;
[0014]
步骤三,将nd-etnh2分别与钙黄绿素和罗丹明b反应,制备nd-etnh
2-calcein和nd-etnh
2-rhb两种复合纳米粒子。离心条件为:离心力为10000g,离心时间为10min。
[0015]
进一步,所述步骤三中制得的nd-etnh
2-calcein和nd-etnh
2-rhb的平均粒径分别为126.7nm和111.4nm,且在水中具有较好的稳定性。
[0016]
进一步,两种复合纳米粒子的最大发射波长分别为527nm和575nm。
[0017]
进一步,所述步骤三中的nd-etnh
2-calcein的制备包括:
[0018]
称取纯化后得纳米金刚石粉末于蒸馏水中,待金刚石分散后加入球磨罐中,在球磨罐中加入乙二胺,将球磨罐放入球磨机中进行球磨;球磨完成后得液体经超声、洗涤、离心得乙二胺胺化的纳米金刚石在水中的分散液nd-etnh2;量取nahco3溶液,加入nd-etnh2及钙黄绿素,在室温下搅拌24h;反应完成后,用去离子水洗涤,离心,重复,直至在上清液中检测不到钙黄绿素。
[0019]
进一步,设置球磨机的转速为580rpm,球磨时间为3h;所述nahco3溶液浓度为0.1mol/l,所述nd-etnh2浓度为5mg/ml;所述离心条件为,离心力为10000g,离心时间为10min。
[0020]
进一步,所述步骤三中的nd-etnh
2-rhb复合纳米粒子的制备包括:
[0021]
称取nd-etnh2粉体和罗丹明b加入三颈烧瓶,并加入无水乙醇,将三颈烧瓶置于磁力搅拌油浴锅中,加入磁子后塞上活塞,使整个装置处于密闭条件;将温度升高到80℃后保持温度加热回流6h;反应结束后,将产物倒出并加入去离子水洗涤,离心,重复,直至紫外可见光谱中没有检测到罗丹明b。
[0022]
本发明的另一目的在于提供一种应用所述的纳米金刚石键接荧光染料的制备方法制备得到的纳米金刚石键接荧光染料。
[0023]
本发明的另一目的在于提供一种所述的纳米金刚石键接荧光染料在药物传递、生物荧光标记以及生物成像中的应用。
[0024]
进一步,所述纳米金刚石键接荧光染料作为荧光探针对细胞进行标记的浓度为0.001~2mg/ml。
[0025]
结合上述的技术方案和解决的技术问题,请从以下几方面分析本发明所要保护的技术方案所具备的优点及积极效果为:
[0026]
第一、针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
[0027]
本发明的目的是基于目前纳米金刚石表面直接胺化过程中还存在的杂质引入且不能直接得到单分散纳米金刚石的技术问题,提出一种胺化纳米金刚石连接荧光基团在生物标记方面的应用。
[0028]
与现有技术相比,本发明涉及的一种可单分散在溶剂中的胺化纳米金刚石的制备方法及其分散工艺和在细胞标记中的应用具有如下有益效果:
[0029]
通过绿色、简单的方法实现了纳米金刚石与钙黄绿素和罗丹明b两种荧光分子的有效结合,解决了荧光小分子接触皮肤后,无法洗掉的问题,为纳米金刚石在药物传递、荧光标记、生物成像等方面的研究提供了新的策略。
[0030]
第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案
具备的技术效果和优点,具体描述如下:
[0031]
本发明通过化学连接荧光基团到纳米金刚石上制备具有较强荧光的复合纳米粒子以有效解决纳米金刚石本征荧光强度较低这一问题。
[0032]
第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
[0033]
(1)本发明的技术方案填补了国内外业内技术空白:
[0034]
通过绿色、简单的方法实现了纳米金刚石与钙黄绿素和罗丹明b两种荧光分子的有效结合,为纳米金刚石在药物传递、荧光标记、生物成像等方面的研究提供了新的策略。
[0035]
(2)本发明的技术方案是否解决了人们一直渴望解决、但始终未能获得成功的技术难题:
[0036]
解决了荧光小分子接触皮肤后,无法洗掉的问题,
附图说明
[0037]
为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
[0038]
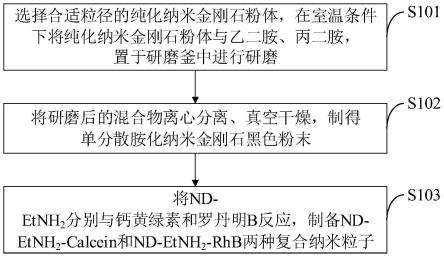
图1是本发明实施例提供的纳米金刚石键接荧光染料的制备方法流程图;
[0039]
图2是本发明实施例提供的纳米金刚石样品红外光谱图;
[0040]
图3是本发明实施例提供的纳米金刚石样品热重分析图;
[0041]
图4是本发明实施例提供的离心上清液紫外可见吸收光谱图;
[0042]
图5是本发明实施例提供的纳米金刚石的紫外可见吸收光谱图;
[0043]
图6是本发明实施例提供的离心上清液荧光发射光谱图;
[0044]
图7是本发明实施例提供的纳米金刚石的荧光发射光谱图;
[0045]
图8是本发明实施例提供的纳米金刚石的粒径分布图;
[0046]
图9是本发明实施例提供的纳米金刚石作用与hepg2和lo2细胞不同时间的细胞存活率示意图;
[0047]
图10是本发明实施例提供的腹腔注射nd-etnh
2-calcein后小鼠活体成像图;
[0048]
图11是本发明实施例提供的(a,b)nd-etnh
2-calcein复合纳米粒子和(c,d)calcein在405nm和488nm双激发光下的体外皮肤渗透图像;
[0049]
图12是本发明实施例提供的nd-etnh
2-calcein分别孵育(a)lo2细胞和(b)hepg2细胞20min后的明场和492nm激发波长下的荧光场图像;
[0050]
图13是本发明实施例提供的(a,b)nd-etnh
2-rhb复合纳米粒子和(c,d)罗丹明b在405nm和561nm双激发光下的体外皮肤渗透图像;
[0051]
图14是本发明实施例提供的nd-etnh
2-rhb分别作用于lo2和hepg2细胞24小时的mts结果示意图;
[0052]
图15是本发明实施例提供的nd-etnh
2-rhb分别孵育(a)lo2细胞和(b)hepg2细胞20min后的明场(左)和550nm激发波长下的荧光场(右)图像;
[0053]
图16是本发明实施例提供的ftir谱图分析示意图;
[0054]
图17是本发明实施例提供的纳米金刚石的粒径分布示意图;其中,(a)为nd-cooh
的粒径分布示意图;(b)为nd-etnh
2-rhb的粒径分布示意图;
[0055]
图18是本发明实施例提供的nd-etnh
2-rhb的紫外可见吸收光谱图;
[0056]
图19是本发明实施例提供的nd-etnh
2-rhb的荧光发射光谱图;
[0057]
图20是本发明实施例提供的nd-etnh
2-rhb在不同浓度下的荧光发射光谱图。
具体实施方式
[0058]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0059]
针对现有技术存在的问题,本发明提供了一种纳米金刚石键接荧光染料的制备方法及应用,下面结合附图对本发明作详细的描述。
[0060]
一、解释说明实施例。为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
[0061]
如图1所示,本发明实施例提供的纳米金刚石键接荧光染料的制备方法包括以下步骤:
[0062]
s101,选择合适粒径的纯化纳米金刚石粉体,在室温条件下将纯化纳米金刚石粉体与乙二胺、丙二胺,置于研磨釜中进行研磨;
[0063]
s102,将研磨后的混合物离心分离、真空干燥,制得单分散胺化纳米金刚石黑色粉末;
[0064]
s103,将nd-etnh2分别与钙黄绿素和罗丹明b反应,制备nd-etnh
2-calcein和nd-etnh
2-rhb两种复合纳米粒子。
[0065]
本发明实施例提供的步骤s103中的nd-etnh
2-calcein的制备包括:
[0066]
称取纯化后得纳米金刚石粉末于蒸馏水中,待金刚石分散后加入球磨罐中,在球磨罐中加入乙二胺,将球磨罐放入球磨机中进行球磨;球磨完成后得液体经超声、洗涤、离心得乙二胺胺化的纳米金刚石在水中的分散液nd-etnh2;量取nahco3溶液,加入nd-etnh2及钙黄绿素,在室温下搅拌24h;反应完成后,用去离子水洗涤,离心,重复,直至在上清液中检测不到钙黄绿素。
[0067]
本发明实施例提供的球磨机转速580rpm,球磨时间3h;nahco3溶液浓度0.1mol/l,nd-etnh2浓度5mg/ml;所述离心条件为,离心力为10000g,离心时间为10min。
[0068]
本发明实施例提供的步骤s103的nd-etnh
2-rhb复合纳米粒子的制备包括:
[0069]
称取nd-etnh2粉体和罗丹明b加入三颈烧瓶,并加入无水乙醇,将三颈烧瓶置于磁力搅拌油浴锅中,加入磁子后塞上活塞,使整个装置处于密闭条件;将温度升高到80℃后保持温度加热回流6h;反应结束后,将产物倒出并加入去离子水洗涤,离心,重复,直至紫外可见光谱中没有检测到罗丹明b。
[0070]
作为优选实施例,本发明实施例提供了一种可在溶剂中单分散的胺化纳米金刚石的制备方法,该方法包括如下步骤:
[0071]
选择合适粒径的纯化纳米金刚石粉体,在室温条件下将所述纯化纳米金刚石粉体与乙二胺、丙二胺,置于研磨釜中进行研磨,研磨后的混合物离心分离、真空干燥即可制得本发明所述的单分散胺化纳米金刚石黑色粉末。
etnh
2-calcein的紫外吸收光谱。
[0087]
4、荧光光谱分析
[0088]
本实验利用美国安捷伦科技公司生产的cary eclipse型荧光分光光度计对nd-etnh
2-calcein离心后的上清液进行测试。测试相同浓度下的nd-cooh、nd-etnh2、nd-etnh
2-calcein的荧光发射光谱。设置激发和发射狭缝均为10nm,扫描速度为600nm/min。
[0089]
5、粒度测试
[0090]
本实验利用马尔文zeta电位仪分别对纯化纳米金刚石、乙二胺胺化纳米金刚石进行粒度测试。采用动态光散射法(dls)原理,将样品配置成一定浓度的稀溶液测试,前三次时间设置为120s,之后时间设置为30s,在常温下进行粒径测定。
[0091]
6、zeta电位表征
[0092]
本实验利用马尔文zeta电位仪分别对纯化纳米金刚石、乙二胺胺化纳米金刚石进行电位测试。将样品配置成一定浓度的稀溶液测试,前三次时间设置为120s,之后时间设置为30s,在常温下进行电位测定。
[0093]
7、细胞毒性测试mts测试
[0094]
7.1接种细胞
[0095]
取生长状态较好的细胞,用胰酶进行消化,1000rpm离心5min;吸出上层液体,加入1ml细胞培养基后吹打;吹打后在显微镜下进行计数,实验组(平行三组)对应孔每孔加入5000个细胞(100μl)于96孔板中,对照组每孔加入等量(100μl)的培养基;将接种完细胞的96孔板放入恒温(37℃)二氧化碳培养箱中培养。
[0096]
7.2加入样品
[0097]
将在培养箱中培养12h后的96孔板取出,实验组的孔每孔加入相应的不同浓度的纳米金刚石样品100μl,对照组每组加100μl细胞培养基;将加完样品的96孔板放入培养箱中培养。
[0098]
7.3进行mts测试
[0099]
将在培养箱中培养24h、48h后的96孔板取出,每孔加入20μl mts后放入培养箱;4h后将96孔板放入酶标仪中,在492nm的波长下对每孔进行吸光度测试;根据吸光度的数据计算出细胞在24h、48h的存活率。
[0100]
7.4统计分析
[0101]
mts测试所显示数据均为平均值
±
标准差(sd)。在其他条件相同的情况下采用单因素annova分析计算p值,当p值小于0.05时,实验数据间具有显著性差异,具有统计学意义,p值大于0.05时,实验数据间没有显著性差异,不具有统计学意义。
[0102]
8、半致死量测试
[0103]
灌胃实验
[0104]
8.1实验小鼠的选择
[0105]
本实验所用小鼠均购买于武汉动物实验中心。为了避免个体之间的差异性,动物实验中一般选取同一种类、鼠龄、体重相近的雄鼠为实验对象。本实验中,我们选用6周左右,体重在20~30g的昆明鼠。实验前12h禁止给小鼠喂食。
[0106]
8.2灌胃实验步骤
[0107]
用左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部,使其头、
颈和身体呈一条直线,用1ml的注射器吸取样品,将注射器的针头取下,换上灌胃针头。灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入胃部后就可以推注药液了。
[0108]
在灌胃的过程中,应该注意的是防止药液从口中流出。在灌胃结束后,给予小鼠正常的生活条件,恢复进食,观察记录小鼠的生存状态。
[0109]
8.3半致死量预实验
[0110]
随机选取5只体重相近的小鼠为一组,再选取其中一组先进行灌胃实验,如果灌胃实验后小鼠全死则减少注射剂量,如果全不死则增加注射剂量,直到确定出全致死量。实验过程中,通过小鼠的体重,纳米金刚石分散液的浓度及注射的分散液的体积计算注射纳米金刚石的量。
[0111]
8.4半致死量实验
[0112]
根据预实验中的剂量进行半致死量实验,若得出最小致死量及最大致死量,则应用寇氏法进行半致死量实验计算半致死量。若最大剂量时小鼠未死亡,则按最大剂量进行正式实验。
[0113]
9、纳米金刚石的小鼠体内分布
[0114]
9.1腹腔注射
[0115]
9.1.1实验小鼠的选择
[0116]
本实验所用小鼠均购买于武汉动物实验中心。为了避免个体之间的差异性,动物实验中一般选取同一种类、鼠龄、体重相近的雄鼠为实验对象。本实验中,我们选用6周左右,体重在20~30g的昆明鼠。实验前12h禁止给小鼠喂食。
[0117]
9.1.2腹腔注射实验步骤
[0118]
用左手的小指和无名指抓住小鼠的尾巴,另外三只手指抓住小鼠的颈部,使小鼠的腹部向上,其尾部略高于头部,右手使用注射器,找到小鼠腹部下1/3处,略靠外侧的位置,朝头的方向平行的刺入皮肤约0.7cm左右,把注射器针头呈45
°
穿过腹肌和腹膜刺入腹腔后缓慢注射纳米金刚石分散液。腹腔注射完成后,给予小鼠正常的生活条件,恢复进食,观察记录小鼠的生存状态。
[0119]
9.1.3半致死量预实验
[0120]
随机选取5只体重相近的小鼠为一组,再选取其中一组先进行腹腔注射实验,如果小鼠全死则减少注射剂量,如果全不死则增加注射剂量,直到确定全致死量。实验过程中,注射的纳米金刚石的量的计算同灌胃实验。
[0121]
9.1.4半致死量实验
[0122]
根据预实验中的剂量进行半致死量实验,若得出最小致死量及最大致死量,则应用寇氏法进行半致死量实验计算半致死量。若最大剂量时小鼠未死亡,则按最大剂量进行正式实验。
[0123]
9.2小动物成像
[0124]
对注射了纳米金刚石的小鼠进行解剖处理,取出小鼠的肝脏,肾脏和脾脏。本实验利用bruker小动物活体成像仪对刚解剖出的小鼠的器官进行成像(解剖10min内成像),设置激发波长395nm,发射波长535nm,曝光时间20s。
[0125]
9.2.1红外光谱测试(ftir)
[0126]
图2为nd-etnh2、nd-etnh
2-calcein的红外光谱图。从以上数据可以看出,乙二胺胺化的纳米金刚石与钙黄绿素反应后,在1639、1616cm-1
处由c=o伸缩振动引起的“酰胺i”带相对强度增强,主要原因是乙二胺胺化的纳米金刚石与钙黄绿素成功结合,使得酰胺键增加;由于钙黄绿素本身的结构中含有c-o-c和c-h,导致在1483cm-1
、1481cm-1
和1140cm-1
处的峰的相对强度增强。
[0127]
9.2.2热失重表征(tg)
[0128]
图3为nd-etnh
2-calcein复合纳米粒子的热重分析图。在195~315℃的范围内,样品中的钙黄绿素开始分解,失重率约1.77%,即nd-etnh
2-calcein复合纳米粒子中钙黄绿素的含量约为1.77%。在315~376℃的范围内,样品开始分解氨基。在376~521℃范围内,失重量归因于样品分解sp3碳,521℃以后,失重量是由于样品分解sp2碳。
[0129]
9.2.3紫外可见吸收光谱
[0130]
图4为nd-etnh
2-calcein制备过程中,最后一次离心后所得上清液得紫外吸收光谱。经过测定,钙黄绿素水溶液的紫外可见吸收光谱在497nm处有明显的吸收峰,从图中可以发现,在离心上清液的紫外可见吸收光谱中,未在497nm处发现钙黄绿素(calcein)的紫外吸收峰,说明在离心的过程中,未与金刚石发生反应的钙黄绿素经过洗涤离心已被完全洗出。
[0131]
图5为nd-cooh、nd-etnh2、nd-etnh
2-calcein的紫外可见吸收光谱图。从图中可以看出,nd-cooh与nd-etnh2在497nm处无吸收峰,而nd-etnh
2-calcein在497nm处有吸收峰。由于其中含有的荧光素的含量较少,所以峰的存在不明显。在图4中,洗涤上清液中无钙黄绿素,而合成的nd-etnh
2-calcein中含有钙黄绿素的吸收峰,也可以证明乙二胺胺化的纳米金刚石已成功地与钙黄绿素相结合。
[0132]
9.2.4荧光光谱
[0133]
图6为nd-etnh
2-calcein制备过程中,最后一次离心后所得上清液得紫外吸收光谱。经过测定,钙黄绿素水溶液在527nm处存在发射峰。从图中可以看出,在527nm处并未发现钙黄绿素的荧光发射峰,证明未参与反应的钙黄绿素已成功的通过洗涤离心去除,这也与上清液的紫外可见吸收光谱图相印证。
[0134]
图7为0.5mg/ml的浓度下的nd-etnh2和nd-etnh
2-calcein的荧光发射光谱。从图6中可以看出,在527nm处,nd-etnh2并未发现明显的发射峰,而nd-etnh
2-calcein在527nm处有明显的荧光发射峰,证明钙黄绿素已成功地与乙二胺胺化得到纳米金刚石相结合。
[0135]
9.2.5粒度测试与zeta电位表征
[0136]
表1不同纳米金刚石的平均粒径与zeta电位值
[0137][0138]
图8为nd-cooh、nd-etnh2、nd-etnh
2-calcein复合纳米粒子的粒径分布图。表1为nd-cooh、nd-etnh2、nd-etnh
2-calcein复合纳米粒子的平均粒径及zeta电位值。从粒径分布
图及表中的平均粒径可知,氧化后的纳米金刚石的平均粒径为136.4nm,而乙二胺胺化的纳米金刚石的平均粒径在72.75nm,粒径减少的原因是在乙二胺胺化的过程中,球磨罐中球磨珠的动能作用导致纳米金刚石本身的粒径的减小。钙黄绿素与乙二胺胺化的纳米金刚石的结合产物的平均粒径在106.9nm,比乙二胺胺化的纳米金刚石的平均粒径有所增加,是由于钙黄绿素与乙二胺胺化的纳米金刚石结合后,导致纳米金刚石表面的碳链增长,致使纳米金刚石的粒径增加。同时也可以说明乙二胺胺化的纳米金刚石与钙黄绿素结合。
[0139]
9.2.6细胞毒性测试
[0140]
图9为nd-etnh
2-calcein复合纳米粒子加入hepg2细胞和lo2细胞在24h和48h后的细胞存活率柱状图。如图中所示,nd-etnh
2-calcein复合纳米粒子加入两种不同的细胞后,细胞的存活率均大于80%,证明nd-etnh
2-calcein复合纳米粒子对两种细胞的毒性很微弱,可以应用于生物医学领域。
[0141]
9.2.7小鼠半致死量测试
[0142]
表2纳米金刚石灌胃实验记录数据
[0143][0144]
表2为nd-etnh
2-calcein复合纳米粒子通过腹腔注射的方式进入小鼠体内后小鼠的实验记录。从表中的数据可以看出,当小鼠摄入nd-etnh
2-calcein复合纳米粒子的量达到1.5g/kg时,并无小鼠出现死亡现象,证明nd-etnh
2-calcein复合纳米粒子的半致死量大于1.5g/kg,对小鼠的毒性很小。
[0145]
9.2.8小鼠体内分布
[0146]
图10为腹腔注射水(对照组)和nd-etnh
2-calcein复合纳米粒子不同天数后的小鼠器官活体成像图。从图中可以看出和腹腔注射水(对照组)的小鼠相比,注射nd-etnh
2-calcein复合纳米粒子1天后的小鼠,肝脏与肾脏的荧光强度增强,脾脏的荧光强度无变化。各器官的具体荧光强度值见表3。
[0147]
表3小鼠各器官荧光强度
[0148][0149]
表3为腹腔注射水(对照组)和nd-etnh
2-calcein复合纳米粒子不同天数后的小鼠器官的荧光强度值(所有值的误差小于5%)。从图10和表3中的数据可以得出,小鼠注射nd-etnh
2-calcein复合纳米粒子一天后,nd-etnh
2-calcein复合纳米粒子主要聚集在小鼠的肝
脏和肾脏,脾脏中无聚集。由于肝脏是小鼠体内重要的排毒器官,在nd-etnh
2-calcein复合纳米粒子聚集在肝脏3天后,肝脏聚集的nd-etnh
2-calcein复合纳米粒子的量被肝脏的排毒系统代谢排出,致使肝脏的荧光强度降低。在腹腔注射nd-etnh
2-calcein复合纳米粒子5天后,nd-etnh
2-calcein复合纳米粒子基本被完全代谢,致使荧光强度恢复与对照组相近的荧光强度。肾脏是生物体内重要的排泄器官,可以发现腹腔注射nd-etnh
2-calcein复合纳米粒子1天后肾脏的荧光强度也有所增加,随着时间的延长,荧光强度逐渐降低。有可能是nd-etnh
2-calcein复合纳米粒子被肝脏代谢后排到肾脏,也有可能是其直接在肾脏聚集,但是随着时间的延长,肾脏也可将其排出,排出方式可能是通过尿液。腹腔注射nd-etnh
2-calcein复合纳米粒子后,脾脏的荧光强度并无明显的增加,证明其并未在脾脏聚集。从以上结论可以得出,nd-etnh
2-calcein复合纳米粒子聚集在小鼠的肝脏和肾脏后,可以通过小鼠本身的代谢能力将其排出体外。
[0150]
9.3体外皮肤渗透成像分析
[0151]
结合纳米金刚石在水溶液中的良好的分散性,将其作为局部药物传递系统的渗透增强剂,可能会发挥良好的功效。为了避免外用制剂中渗透增强剂的不良影响,其必须是无创的,同时促进药物通过皮肤的渗透。一般的,大小为20nm的粒子很难穿透皮肤。虽然纳米金刚石的单个粒径为5nm,但是一般以50~100nm的颗粒聚集体存在,因此很难渗透到皮肤中。药物在分散良好的纳米金刚石颗粒表面吸附具有很高的应用潜力,因此,可将纳米金刚石作为局部药物传递系统的“药物储备或基质”剂。对nd-etnh
2-calcein复合纳米粒子进行体外渗透测试,为后续进一步在药物传递系统的应用奠定基础。
[0152]
用激光共聚焦扫描显微镜检测nd-etnh
2-calcein在猪皮肤表面的渗透情况。从图11(a)~(b)中可以看出,将nd-etnh
2-calcein溶液涂抹在猪皮表面24h后,并没有渗入猪皮中,而仅仅在角质层上可见,即使在48h以后,也没有扩散至真皮层。而由图11(c)~(d)可以看出,荧光素溶液在涂抹24h后便扩散到真皮层。而荧光素渗透到皮肤中,会对身体造成一定的伤害。nd-etnh
2-calcein粒子不能透过角质层的主要原因可能是与小分子荧光素相比,其平均粒径的增大有关。在水溶液中nd-etnh
2-calcein粒子的平均粒径约为126.7nm。而在一般情况下,初始粒径在~20nm或更高的纳米粒子不能穿透活组织。研究发现,当碳纳米颗粒被吸收进入体循环时,会发生如免疫原性和炎症等不良反应。鉴于nd-etnh
2-calcein粒子不能穿透皮肤组织,因此不会对身体产生不利影响。且与其他碳纳米粒子相比,纳米金刚石具有低毒性和高生物相容性,使其在生物医学领域的应用更加可靠。
[0153]
9.4细胞荧光成像分析
[0154]
图12为lo2细胞和hepg2细胞在nd-etnh
2-calcein混合液孵育20min后的细胞图像。从图12(a)明场下的图像可以看出,用nd-etnh
2-calcein和培养基混合液对lo2细胞孵育20min后,细胞形态没有发生明显的改变。同时,可以观察到绝大多数nd-etnh
2-calcein粒子已成功进入lo2细胞中。当转换成荧光场时,图像中的细胞发出明亮的绿色荧光。这说明nd-etnh
2-calcein已成功标记lo2细胞。图12(b)则表明nd-etnh
2-calcein复合粒子也能标记hepg2细胞,并且不会破坏其形态。综上可得出nd-etnh
2-calcein复合粒子可在体外实现多种细胞系的荧光标记。
[0155]
实施例3:nd-etnh
2-rhb复合纳米粒子的制备
[0156]
准确称取0.100g nd-etnh2粉体和0.200g罗丹明b加入三颈烧瓶,并加入60ml无水
乙醇,将三颈烧瓶置于磁力搅拌油浴锅中,加入磁子后塞上活塞,使整个装置处于密闭条件。将温度升高到80℃后保持该温度加热回流6h。反应结束后,将产物倒出并加入100ml去离子水洗涤,在离心力为10000g下离心10min,重复上述步骤,直至紫外可见光谱中没有检测到罗丹明b。
[0157]
1、体外皮肤渗透成像分析
[0158]
图13展示了nd-etnh
2-rhb溶液和罗丹明b溶液涂抹于猪皮表面后的渗透情况。从图13(a)中可以看出,将nd-etnh
2-rhb溶液涂抹在猪皮表面24h后,仅在角质层上观察到红色荧光,这表明nd-etnh
2-rhb在24小时后并没有渗透到皮肤真皮层。图13(b)表明了即使在48h以后,nd-etnh
2-rhb粒子也没有扩散至真皮层。而由图13(c)~(d)可以看出,罗丹明b溶液均匀涂抹在皮肤24小时后便渗透至皮肤真皮层。这进一步表明了纳米金刚石不会渗透到皮肤中。
[0159]
2、细胞毒性测试分析
[0160]
细胞毒性是生物医学领域一个非常重要的性能指标。为了评估nd-etnh
2-rhb的细胞毒性,使用lo2细胞和hepg2细胞进行了mts实验。图14为nd-etnh
2-rhb分别作用于lo2和hepg2细胞24小时的mts结果。从图中可以看出,随着nd-etnh
2-rhb浓度的增加,hepg2细胞和lo2细胞的存活率逐渐降低,但在10-3
~10-1
mg/ml的浓度范围内,nd-etnh
2-rhb复合纳米粒子作用于两种细胞的24小时存活率均高于90%。所以可认为其细胞毒性较低。特别的,当nd-etnh
2-rhb的浓度低于0.01mg/ml时,两种细胞的24小时存活率均高于95%,可以基本上认为对细胞没有毒性。这与nd-etnh
2-fl的细胞毒性测试结果相似,表明所制备的两种纳米复合粒子均具有较低的细胞毒性。可安全的应用于生物医学领域。
[0161]
3、细胞荧光成像分析
[0162]
图15为lo2细胞和hepg2细胞在nd-etnh
2-rhb混合液中孵育20min后的细胞图像。从图15(a)明场下的图像可以看出,用nd-etnh
2-rhb和培养基混合液对lo2细胞孵育20min后,细胞形态没有发生明显的改变。同时,可以观察到绝大多数nd-etnh
2-rhb粒子已成功进入lo2细胞中。当转换成荧光场时,图像中的细胞发出明亮的红色荧光。这说明nd-etnh
2-rhb已成功标记lo2细胞。同时,图15(b)表明nd-etnh
2-rhb复合粒子也能标记hepg2细胞,并且不会破坏其形态。与nd-etnh
2-fl粒子标记的绿色荧光不同,nd-etnh
2-rhb的荧光颜色为红色,并且也能实现多种细胞的标记。多色多细胞的标记能力,为其后续的进一步应用奠定了基础。
[0163]
3.1红外光谱表征(ftir)
[0164]
图16为nd-etnh
2-rhb复合纳米粒子和罗丹明b的红外图谱。从图中可以看出,nd-etnh
2-rhb分别在1641cm-1
,1517cm-1
,1460cm-1
,1390cm-1
,1114cm-1
附近出现吸收峰,在1641cm-1
处对应oh弯曲振动峰,在1517cm-1
处对应c=c伸缩振动,在1460cm-1
和1390cm-1
处对应着c-h弯曲振动,在1114cm-1
处对应着c-o-c振动。这些峰与罗丹明b的峰相一致,表明了罗丹明b已成功与纳米金刚石结合。
[0165]
3.2粒径分布表征
[0166]
如图17所示,nd-etnh
2-rhb复合纳米粒子的平均粒径为111.4nm。表明该复合纳米粒子可较好地分散在水溶液中。与纯化纳米金刚石相比,其平均粒径略有增加,这可能是罗丹明b结合纳米金刚石表面上导致的。
[0167]
4、光学性质研究
[0168]
4.1紫外可见吸收光谱分析
[0169]
图18为nd-etnh
2-rhb复合纳米粒子的紫外可见吸收光谱。从图中可以看出,nd-etnh
2-rhb复合纳米粒子在228nm处出现吸收峰。
[0170]
4.2荧光发射光谱分析
[0171]
图19为nd-etnh
2-rhb复合纳米粒子的荧光发射光谱。由图可以得出,nd-etnh
2-rhb的最大发射波长为575nm。
[0172]
4.3浓度对nd-etnh
2-rhb复合纳米粒子荧光强度的影响
[0173]
图20为不同浓度下nd-etnh
2-rhb复合纳米粒子的荧光发射光谱。从图中可以看出,在350nm的激发波长下,随着溶液浓度的增大,nd-etnh
2-rhb的发射波长基本不变。且荧光强度逐渐增大,当溶液浓度为1.0mg/ml时,其荧光强度达到最大。这是由于溶液浓度的增大,使连接在纳米金刚石上的罗丹明b的含量逐渐增多,nd-etnh
2-rhb的荧光强度逐渐增大。
[0174]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1