一种大孔树脂纯化红花红色素的工艺
1.本发明涉及一种大孔树脂纯化红花红色素的工艺。
背景技术:
2.红花红色素(carthamin)是从菊科红花属植物红花carthamus tinctorius l.干燥管状花中提取的天然色素,在东亚各国被广泛用于面包、糖果、饮料等食品着色,经处理后也能制成脂溶性染色剂,用于口红、胭脂等高档化妆品染色。此外,红花红色素也是红花中的活性成分,还能用于药物糖衣染色。
3.由于红花中除红色素外,还富含红花黄色素及其他成分,提取所得红花红色素粗品中往往含有大量杂质,影响了品质,因此需对红色素粗品进行精制。但红花红色素稳定性较差,光热、ph敏感,高温、碱性环境会使其颜色变黄,降解速率加快,选择合适的纯化方法在红色素研究中至关重要。
4.大孔树脂吸附分离具有操作简便、选择性好、成本低和可反复使用等特点,已被广泛用于诸多天然化合物的分离纯化。已有的红花红色素研究未对大孔树脂的类型进行系统的筛选,并采用的是紫外可见分光光度法计算色价作为参考指标,无法定量说明纯化效果;最优条件采用单因素最高点复合而成,可信度较差。因此,本研究首先通过静态吸附-洗脱试验筛选大孔树脂型号,然后采用单因素、部分因子设计、响应面试验及遗传神经网络模型考察不同工艺条件对红花红色素回收率的影响,寻求大孔树脂纯化红花红色素的最优工艺。
技术实现要素:
5.为了解决以上问题,本发明提供了一种高效、简便、稳定的大孔树脂纯化红花红色素的工艺。
6.一种大孔树脂纯化红花红色素的方法,包括如下步骤:
7.(1)用纯水将红色素粗品溶解成红色素溶液;
8.(2)将大孔树脂用95%乙醇浸泡充分溶胀后,用乙醇淋洗通柱至洗出液不浑浊,改用大量水洗直至无醇味,抽滤备用;所述大孔树脂为hpd400型大孔树脂或x-5大孔树脂;
9.(3)称取经预处理后的湿树脂,置于具塞锥形瓶中,分别加入红花红色素溶液,室温振荡,离心取上清液,定容后进hplc,根据峰面积计算浓度,计算静态吸附率;然后加入乙醇溶液对树脂进行解吸,室温振荡,离心取上清液,定容,根据峰面积计算浓度,计算静态解吸率;
10.(4)称取经预处理活化的树脂,湿法装柱,加入红花红色素溶液,用乙醇洗脱,收集洗脱液旋转蒸发后转移至量瓶,乙醇定容,进hplc仪测定,根据色谱峰面积计算回收率q,q=s/s0,s为大孔树脂处理后红花红色素的峰面积,s0为未处理前红花红色素溶液的峰面积。
11.优选的,所述大孔树脂为hpd400型大孔树脂。
12.优选的,步骤(4)中上样液ph为6-7。
13.优选的,步骤(4)中:上样液质量浓度为0.05-0.125g
·
ml-1
。
14.优选的,步骤(4)中:洗脱乙醇体积分数为58%-70%。
15.优选的,步骤(4)中:洗脱乙醇体积分数58%,上样液质量浓度0.125g
·
ml-1
,上样液ph 6.0。
16.优选的,步骤(4)中:洗脱液用量为4bv;洗脱体积流量为0.5~1.5ml
·
min-1
;上样量与树脂比为0.3~0.4;上样体积流量为0.5~1.0ml
·
min-1
。
17.本方法具体包括如下步骤:
18.(1)用纯水将红色素粗品溶解成按原药材计浓度为0.10g
·
ml-1
的红色素溶液;
19.(2)将hpd400型大孔树脂用95%乙醇浸泡24h充分溶胀后,用乙醇淋洗通柱至洗出液不浑浊,改用大量水洗直至无醇味,抽滤备用;
20.(3)称取经预处理后的湿树脂2g,置于具塞锥形瓶中,分别加入25ml 0.10g
·
ml-1
的红花红色素溶液,室温振荡2h,离心取上清液,定容至25ml后进hplc,根据峰面积计算浓度,计算静态吸附率;然后加入25ml 60%乙醇溶液对树脂进行解吸,室温振荡2h,离心取上清液,定容至25ml,根据峰面积计算浓度,计算静态解吸率;
21.(4)称取经预处理活化的树脂3g,湿法装柱,加入10ml 0.10g
·
ml-1
的红花红色素溶液,上样液质量浓度0.125g
·
ml-1
,上样液ph 6.0,控制上样体积流量为0.5ml
·
min-1
,用4bv的乙醇以1.0ml
·
min-1
的体积流量洗脱,洗脱乙醇体积分数58%,收集洗脱液旋转蒸发后转移至10ml量瓶,60%乙醇定容,进hplc仪测定,根据色谱峰面积计算回收率q,q=s/s0,s为大孔树脂处理后红花红色素的峰面积,s0为未处理前红花红色素溶液的峰面积。
22.其中,所述红花红色素粗品的制备为:红花经过水洗去除大部分黄色素后于25℃干燥,打粉;精密称取10g红花粉末于具塞锥形瓶中,按液料比23:1加入58%丙酮溶液,调节温度40℃,超声41min后过滤,将滤液置于分液漏斗中,加入适量硫酸铵振荡摇匀,静置使其分层,上相为有机相,下相为水相,收集上相将丙酮回收干,冷冻干燥得红色素粗品。
23.本发明通过对部分因子设计筛选出的主要影响因素进行响应面设计与试验,遗传神经网络模型拟合与预测最优参数。
24.本技术通过系统筛选大孔树脂型号,机器学习优化纯化的工艺条件,为高纯度红花红色素的获取以及红色素的工业化规模生产提供了一种高效、简便、稳定的方法。在确定的hpd-400型大孔树脂纯化工艺条件下,红花红色素回收率可达96.68%,为以往报道纯化方法的3~4倍。大孔树脂纯化后红花红色素质量分数为91.76%,约为纯化前的3倍。经重结晶操作后,红花红色素质量分数可达98.74%。
附图说明
25.图1红花红色素经hpd400大孔树脂的洗脱曲线。
26.图2为各因素对回收率的影响曲线图。
27.其中,
28.图2a洗脱乙醇体积分数对回收率的影响(n=3);
29.图2b洗脱液用量对回收率的影响(n=3);
30.图2c洗脱体积流量对回收率的影响(n=3);
31.图2d上样量与树脂比对回收率的影响(n=3);
32.图2e上样体积流量对回收率的影响(n=3);
33.图2f上样液质量浓度对回收率的影响(n=3);
34.图2g上样液ph对回收率的影响(n=3)。
35.图3标准化效应的pareto图(响应为q,α=0.05)。
36.图4实验数据与模型预测数据误差分析结果。
具体实施方式
37.2材料与方法
38.2.1仪器和材料
39.agilent1260型高效液相色谱仪,tg16-ws台式高速离心机,fe28型ph计,揺床等。ab-8、ads-8、cad-40、d-101、dm130、hpd-300、hpd-400、nka-9、s-8、x-5型大孔树脂,红花、丙酮、乙醇、碳酸钾、柠檬酸。
40.2.2红花红色素粗品的制备
41.红花经过水洗去除大部分黄色素后于25℃干燥,打粉。精密称取10g红花粉末于具塞锥形瓶中,按液料比23:1加入58%丙酮溶液,调节温度40℃,超声41min后过滤,将滤液置于分液漏斗中,加入适量硫酸铵振荡摇匀,静置使其分层,上相为有机相,下相为水相,收集上相将丙酮回收干,冷冻干燥得红色素粗品。
42.2.3高效液相色谱法定量红花红色素
43.2.3.1对照品的制备
44.由于市面上没有红花红色素标准品出售,本实验依据课题组以往建立的方法,采用碱提酸沉法提取,提取液经制备型高效液相色谱仪分离,冻干后得红色素对照品(纯度》98%)。
45.2.3.2红色素的hplc含量测定
46.对照品溶液的制备:精密称取一定量红花红色素对照品,用50%丙酮溶解并定容,制成浓度为0.3mg
·
ml-1
的红色素对照品溶液。
47.供试品溶液制备:精密称取一定量红花红色素粗品,用50%丙酮溶解,过0.22μm微孔滤膜,即得。
48.色谱条件为alltech alltima c
18
色谱柱(4.6mm
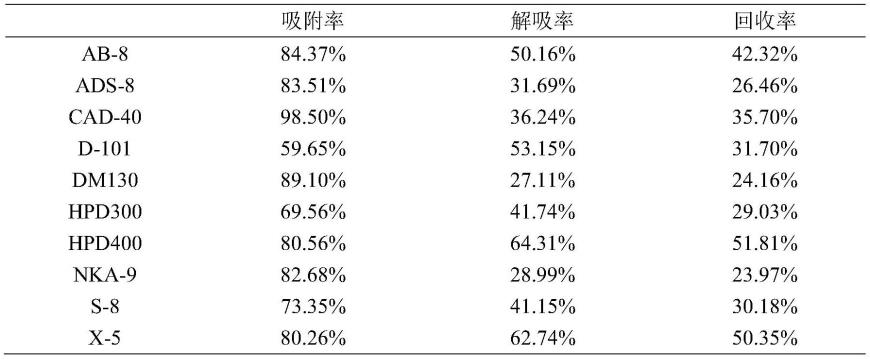
×
250mm,5μm)及alltech alltima c
18
保护柱(4.6mm
×
12.5mm,5μm);流动相为0.3%磷酸水-甲醇-乙腈(57:5:38),流速为1.0ml
·
min-1
,柱温35℃,进样量20μl,检测波长520nm。
49.2.3.3 hplc定量的方法学考察
50.精密度试验:取红花红色素对照品溶液,在1天之内连续进样6次以及连续3天分别进样测定,红花红色素峰面积的rsd为0.41%(日内)和1.43%(日间),表明仪器精密度良好。
51.稳定性试验:精密称取同一批次红色素粗品,用50%丙酮溶解,过0.22μm微孔滤膜,制备成供试品溶液,4℃避光储存,分别于0、2、4、6、8、10、12h进样测定。12h内供试品溶液中红花红色素峰面积的rsd为2.16%,表明供试品溶液于4℃避光环境下12h内稳定。
52.重复性试验:精密称取同一批次红色素粗品6份,分别用50%丙酮溶解,过0.22μm滤膜,制备成供试品溶液,进样测定。6份溶液中红花红色素峰面积的rsd为1.60%。
53.加样回收试验:精密称取同一批次红色素粗品,用50%丙酮溶液溶解,按照0.8:1、1:1、1.2:1的比例加入红色素对照品制备成样品溶液,每组3份,hplc进样测定并计算加样回收率,平均加样回收率为99.31%(rsd=1.20%)。
54.所建立方法经方法学考察,符合含量测定的各项要求。
55.2.4大孔树脂的静态吸附与静态解析
56.将10种型号的大孔树脂用95%乙醇浸泡24h充分溶胀后,用乙醇淋洗通柱至洗出液不浑浊,改用大量水洗直至无醇味,抽滤备用。
57.称取经预处理后的10种湿树脂各2g,置于具塞锥形瓶中,分别加入25ml 0.10g
·
ml-1
的红花红色素溶液(用纯水将2.2制备的粗品红色素溶解成按原药材计浓度为0.10g
·
ml-1
的红色素溶液),室温振荡2h,离心取上清液,定容至25ml后进hplc,根据峰面积计算浓度,计算静态吸附率。然后加入25ml 60%乙醇溶液对树脂进行解吸,室温振荡2h,离心取上清液,定容至25ml,根据峰面积计算浓度,计算静态解吸率。通过比较10种树脂的静态吸附率、解吸率和回收率,选择合适的树脂类型。
58.大孔树脂的静态吸附率、解吸率和回收率按下式计算:
59.吸附率=(c
1-c2)/c1×
100%
60.解吸率=c3/(c
1-c2)
×
100%
61.回收率=c3/c1×
100%
62.式中:c1为树脂吸附前红花红色素溶液的浓度;c2为树脂吸附后红花红色素溶液的浓度;c3为树脂解吸液中红花红色素溶液的浓度。
63.2.5单因素试验
64.2.5.1洗脱液体积分数的考察
65.称取经预处理活化的树脂3g,湿法装柱,加入10ml 0.10g
·
ml-1
的红花红色素溶液,控制上样体积流量为1.0ml
·
min-1
,用5bv的乙醇以1.0ml
·
min-1
的体积流量洗脱,将洗脱乙醇体积分数分别调整为50%、60%、70%、80%、90%,收集洗脱液旋转蒸发后转移至10ml量瓶,60%乙醇定容,进hplc仪测定,根据色谱峰面积计算回收率q,q=s/s0,s为大孔树脂处理后红花红色素的峰面积,s0为未处理前红花红色素溶液的峰面积。
66.2.5.2洗脱液用量的考察
67.将洗脱乙醇体积分别调整为2、3、4、5、6bv,进行上样洗脱,其他按照“2.5.1”项下操作,计算红花红色素的回收率q。
68.2.5.3洗脱体积流量的考察
69.将洗脱体积流量分别调整为0.25、0.5、1.0、1.5、2.0ml
·
min-1
,进行上样洗脱,其他按照“2.5.1”项下操作,计算红花红色素的回收率q。
70.2.5.4上样量与树脂比的考察
71.将上样量与树脂比分别调整为0.1、0.2、0.3、0.4、0.5,进行上样洗脱,其他按照“2.5.1”项下操作,计算红花红色素的回收率q。
72.2.5.5上样体积流量的考察
73.将上样体积流量分别调整为0.25、0.5、1.0、1.5、2.0ml
·
min-1
,进行上样洗脱,其他按照“2.5.1”项下操作,计算红花红色素的回收率q。
74.2.5.6上样液质量浓度的考察
75.将上样液质量浓度分别调整为0.025、0.05、0.10、0.15、0.20g
·
ml-1
进行上样洗脱,其他按照“2.5.1”项下操作,计算红花红色素的回收率q。
76.2.5.7上样液ph的考察
77.将上样液ph调整至6、7、8、9、10,进行上样洗脱,其他按照“2.5.1”项下操作,计算红花红色素的回收率q。
78.2.6部分因子设计试验筛选主要影响因素
79.选用部分因子设计试验,对影响红花红色素回收率的显著性因素进行筛选。选取7个实验因素:洗脱乙醇体积分数(a)、洗脱剂用量(b)、洗脱体积流量(c)、上样量(d)、上样体积流量(e)、上样质量浓度(f)、上样液ph(g)。部分因子试验因素与水平设计见表2,包括16个试验点和4个中心重复点,共计20组试验,每组试验重复3次。通过单因素实验得到的结果结合各个因素之间的情况,确定每个因素高、低2个水平,计算红花红色素的回收率q。运用minitab软件对结果进行方差分析。
80.2.7bbd试验
81.通过部分因子设计试验筛选出的3个主要影响因素为自变量,bbd试验优化红花红色素的大孔树脂纯化工艺。采用design expert 8.0软件对实验数据进行拟合分析,每个因素的低、中、高水平分别以-1、0、1进行编码,共17组试验,每组试验重复3次。
82.2.8遗传神经网络模型的建立与预测
83.以部分因子设计试验筛选的3个主要影响因素为自变量作为遗传神经网络的输入变量,红花红色素回收率q值作为输出变量。根据留一法,将bbd设计中的15组数据作为神经网络模型的训练集,2组数据作为测试集。
84.2.9最优工艺条件的验证性试验
85.以遗传神经网络模型预测得到的最优纯化工艺条件进行操作,测定红花红色素回收率,平行3次。
86.3实验结果
87.3.1树脂型号的筛选
88.表1树脂型号对红花红色素回收率的影响
[0089][0090]
本实验选用了性质不同的10种树脂,从吸附率和解吸率方面考察了不同型号树脂对红花红色素的纯化效果。由表1可知,hpd400对红花红色素的吸附率、解吸率和回收率都较高,故后续实验采用hpd400型大孔树脂对红花红色素纯化工艺进行优化考察。红花红色
素经hpd400大孔树脂的洗脱曲线如图1所示。
[0091]
3.2单因素实验
[0092]
3.2.1洗脱液乙醇体积分数的考察
[0093]
洗脱乙醇体积分数为50%、60%、70%、80%、90%时,所对应的回收率为82.50%、93.98%、91.39%、85.09%、83.21%,回收率最大时对应的乙醇体积分数为60%,故确定洗脱液乙醇体积分数为60%。如图2a所示。
[0094]
3.2.2洗脱液用量的考察
[0095]
洗脱液用量为2、3、4、5、6bv所对应的回收率为61.28%、67.77%、74.27%、68.48%、64.24%,如图2b所示。
[0096]
回收率最大时对应的洗脱液用量为4bv,故确定洗脱液用量为4bv。
[0097]
3.2.3洗脱体积流量的考察
[0098]
洗脱体积流量为0.25、0.5、1.0、1.5、2.0ml
·
min-1
所对应的回收率为67.46%、89.93%、93.48%、91.96%、66.66%如图2c所示。
[0099]
回收率最大时对应的洗脱体积流量为1.0ml
·
min-1
,故确定洗脱体积流量为1.0ml
·
min-1
。
[0100]
3.2.4上样量与树脂比的考察
[0101]
上样量与树脂比为0.1、0.2、0.3、0.4、0.5所对应的回收率为55.69%、57.35%、64.93%、62.57%、60.92%,如图2d所示。
[0102]
回收率最大时对应的上样量与树脂比为0.3,故确定上样量与树脂比为0.3。
[0103]
3.2.5上样体积流量的考察
[0104]
上样体积流量为0.25、0.5、1.0、1.5、2.0ml
·
min-1
所对应的回收率为89.33%、94.41%、91.97%、87.50%、82.77%,如图2e所示。
[0105]
回收率最大时对应的上样体积流量为0.5ml
·
min-1
,故确定上样体积流量为0.5ml
·
min-1
。
[0106]
3.2.6上样液质量浓度的考察
[0107]
上样液质量浓度为0.025、0.05、0.10、0.15、0.20g
·
ml-1
所对应的回收率为86.47%、92.89%、78.90%、64.65%、56.18%,如图2f所示。
[0108]
回收率最大时对应的上样液质量浓度为0.05g
·
ml-1
,故确定上样液质量浓度为0.05g
·
ml-1
。
[0109]
3.2.7上样液ph的考察
[0110]
上样液ph为6、7、8、9、10所对应的回收率为74.64%、80.90%、44.87%、18.68%、16.67%,如图2g所示。
[0111]
回收率最大时对应的上样液ph为7,故确定上样液ph为7。
[0112]
3.3部分因子设计试验筛选主要影响因素
[0113]
表2部分因子设计试验及结果
[0114][0115][0116][0117]
表3部分因子设计试验方差分析
[0118][0119]
运用minitab软件对各因素进行显著性分析,所得的回归方程q=0.43761+0.02618a+0.02516b+0.02096c-0.01610d+0.00771e+0.03266f-0.16450g-0.04620a*b-0.00495a*c-0.0 2406a*d-0.01766a*e-0.02680a*f-0.01113a*g+0.06109b*d-0.00941a*b*d+0.2788ct pt。表3结果显示模型p=0.001,达到极显著性水平,决定系数r2=0.9988,表明99.88%的实验数据的变异性可用此回归模型来解释。各因素对q值影响的显著性顺序为g>f>a>b>c>d>e,其中g、f、a对回收率的影响具有极显著性差异。见图3标准化效应的pareto图(响应为q,α=0.05)
[0120]
3.4 bbd试验设计及结果
[0121]
表4 bbd试验设计及结果(n=3)
[0122][0123]
[0124][0125]
表5响应面二次回归方程方差分析
[0126][0127]
在动态纯化过程中,由bbd所得的非线性方程模型p=4.0
×
10-4
,表明该模型极显著,其校正决定系数r2=0.9608,表明96.08%的实验数据的变异性可用此回归模型来解释,可靠性较高。失拟性检验p《0.0001,具有显著性差异,说明该回归模型的预测值与实际情况有一定差距。各项因素对于回归率的影响为c>a>b。鉴于响应面模型不能很好地进行拟合,故后续尝试采用遗传神经网络模型。
[0128]
3.5遗传神经网络模型的建立与预测
[0129]
将bbd设计中的15组数据作为神经网络模型的训练集,2组数据作为测试集。该遗
传神经网络模型的相关权重如表6所示。图4为实验数据与模型预测数据误差分析,r
train
=0.9846,r
test
=0.9957,表明含有4个隐藏层神经元的遗传神经网络模型与实验数据是基本一致的。
[0130]
利用matlab软件,最终预测得到最佳纯化工艺参数为洗脱乙醇体积分数58.10%,上样液质量浓度0.1265g
·
ml-1
,上样液ph6.00,红花红色素回收率98.92%。
[0131]
表6用于预测红花红色素回收率的4个隐藏层神经元的权重
[0132][0133]
见图4实验数据与模型预测数据误差分析结果
[0134]
3.6最优纯化工艺条件的验证性试验
[0135]
遗传神经网络模型预测得到的最优纯化工艺条件为:洗脱乙醇体积分数58.10%,上样液质量浓度0.1265g
·
ml-1
,上样液ph 6.00,考虑到实际操作的可行性,调整为洗脱乙醇体积分数58%,上样液质量浓度0.125g
·
ml-1
,上样液ph 6.0,按此条件进行操作,测定红花红色素回收率,重复3次,结果如表6所示。通过遗传神经网络模型预测的最佳纯化工艺得红花红色素回收率均值为96.68%,质量分数为91.76%,rsd为0.18%。
[0136]
表7遗传神经网络模型预测最优纯化工艺的验证性试验
[0137][0138]
3.7与x-5大孔树脂纯化方法的比较
[0139]
与姚秀玲等(姚秀玲,吕晓玲,周岩,张津凤.大孔树脂吸附分离红花红色素的研究[j].天津科技大学学报,2009,24(03):39-42)、周岩(周岩.红花红色素的提取纯化以及降血脂的研究[d].天津科技大学,2009)报道的x-5型大孔树脂纯化红花红色素的方法进行比较。
[0140]
姚秀玲等采用的x-5型大孔树脂纯化红花红色素的工艺条件仅根据静态吸附与解吸获得:吸附在室温25℃,色素液吸光度为0.5~1.5,ph 7.0~9.0的条件下;其解吸采用60%乙醇溶液,ph为7.0~9.0的条件。本研究参照此条件操作,得到的红色素回收率为19.83%~35.01%,质量分数为64.12%~83.70%。
[0141]
按周岩采用的x-5型大孔树脂纯化红花红色素的方法操作:上样液吸光度为0.597,稀释10倍,上样流速4.5bv/h,80%乙醇洗脱,洗脱速度2.0bv/h,在此条件下得到红色素回收率为20.67%,质量分数为58.69%。
[0142]
且上述两种方法均存在上样液质量浓度极低的问题,同等上样量情况下,姚秀玲等的方法上样体积为本研究的40倍(色素液吸光度值为1.0时),周岩的方法上样体积为本研究的近700倍,与这两种方法相比,本实验构建的hpd-400型大孔树脂纯化工艺具有明显优势。
[0143]
3.8重结晶
[0144]
取3.6项hpd-400最优纯化工艺条件下得到的洗脱液,hplc法测定红花红色素含量,hpd-400大孔树脂纯化后红花红色素质量分数为91.76%,约为纯化前3倍。
[0145]
洗脱液室温挥去部分乙醇后冷冻干燥,所得红色素粗品用丙酮溶解至过饱和,以纯水:丙酮=4:1的比例加入纯水,于4℃放置,待析出沉淀后离心,取沉淀冻干得红花红色素,质量分数为98.74%。
[0146]
本研究建立的hpd-400型大孔树脂纯化工艺操作简便,目标化合物回收率较高。经重结晶操作后,红花红色素质量分数可达98.74%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1