一种用于无菌凝胶药物的产品包装及其制备工艺的制作方法
1.本技术涉及药物包装的技术领域,具体涉及一种用于无菌凝胶药物的产品包装及其制备工艺。
背景技术:
2.无菌凝胶药物是指能够提供给医生或患者使用,并能满足某种利益和需要的具有特殊功能的有形物质和服务。而为了避免无菌凝胶药物的细菌污染以及防止无菌凝胶药物在使用之前发生感染,需要对无菌凝胶药物进行产品包装加工,以增加无菌凝胶药物的保存时间。
3.无菌凝胶药物的产品包装的种类有很多,大部分的无菌凝胶药物产品包装是以透明塑料薄膜或薄片形成泡罩,用热封合或粘合等方法将产品用医用透析纸封合在泡罩内部。随后在加工过程中需要对无菌凝胶药物的产品包装进行灭菌。目前,环氧乙烷蒸汽灭菌是国内厂商主要使用的灭菌方式,由于医用透析纸能够允许如eo环氧乙烷灭菌或者steam高温蒸汽灭菌因子穿透,同时阻碍细菌进入,能够实现一次性无菌医疗器械生产企业对产品进行包装后灭菌,以及医院消毒供应中心对可反复使用的医疗器械进行包装密封后灭菌存储,强化了医疗器械的安全性。
4.但环氧乙烷不能用以无菌凝胶药物灭菌,同时环氧乙烷灭菌整个灭菌循环时间较长,其原因是灭菌完成后需要较长时间通风以去除环氧乙烷残留,而且环氧乙烷易燃易爆,在储存和灭菌时需要确保不能泄露,故而必须选择安全的灭菌器对环氧乙烷进行储存,灭菌时的安全操作要求较高。
技术实现要素:
5.为了降低无菌凝胶药物的产品包装的灭菌操作难度,同时提升生产效率,本技术提供一种用于无菌凝胶药物的产品包装及其制备工艺。
6.本技术提供的一种用于无菌凝胶药物的产品包装的制备工艺,采用如下的技术方案:一种用于无菌凝胶药物的产品包装的制备工艺,包括:弹簧瓶,所述弹簧瓶用以盛装无菌凝胶药物;盒托,所述盒托用以盛装所述弹簧瓶;透析纸,将所述透析纸热合在盒托的开口面,用以将所述弹簧瓶封闭在所述盒托内,随后将封闭后的盒托、弹簧瓶和透析纸在110-128℃下灭菌10-15min完成灭菌操作形成所述产品包装;其中,透析纸热合在盒托的开口面时的热合温度为170-180℃,热合速度为25-35支/min。
7.本技术将弹簧瓶放置在盒托内,并通过透析纸将弹簧瓶密封在盒托内,同时控制热合温度和热合速度,从而在兼顾生产效率的基础上,使得盒托与透析纸密封良好,产品包装无破损或污物,成品合格率高;同时本技术中的无菌凝胶药物无需采用环氧乙烷灭菌,在
110-128℃下灭菌10-15min便可达到无菌状态,降低了操作难度,强化了无菌凝胶药物的生产和使用的安全性。
8.在一些实施方式中,所述热合温度还可以为171-180℃、172-180℃、173-180℃、174-180℃、175-180℃、176-180℃、177-180℃、178-180℃、179-180℃、170-171℃、170-172℃、170-173℃、170-174℃、170-175℃、170-176℃、170-178℃、170-179℃、171-172℃、171-173℃、171-174℃、171-175℃、171-176℃、171-177℃、171-178℃、171-179℃、172-173℃、172-174℃、172-174℃、172-175℃、172-176℃、172-177℃、172-178℃、172-179℃、173-174℃、173-175℃、173-176℃、173-177℃、173-178℃、173-179℃、174-175℃、174-176℃、174-177℃、174-178℃、174-179℃、175-176℃、175-177℃、175-178℃、175-179℃、176-177℃、176-178℃、176-179℃、177-178℃、177-179℃、178-179℃;所述热合速度还可以为26-35支/min、27-35支/min、28-35支/min、29-35支/min、30-35支/min、31-35支/min、32-35支/min、33-35支/min、34-35支/min、25-26支/min 25-27支/min、25-28支/min、25-29支/min、25-30支/min、25-31支/min、25-32支/min、25-33支/min、25-34支/min、26-27支/min、26-28支/min、26-29支/min、26-30支/min、26-31支/min、26-32支/min、26-33支/min、26-34支/min、27-28支/min、27-29支/min、27-30支/min、27-31支/min、27-32支/min、27-33支/min、27-34支/min、28-29支/min、28-30支/min、28-31支/min、28-32支/min、28-33支/min、28-34支/min、29-30支/min、29-31支/min、29-32支/min、29-33支/min、29-34支/min、30-31支/min、30-32支/min、30-33支/min、30-34支/min、31-32支/min、31-33支/min、31-34支/min、32-33支/min、32-34支/min、33-34支/min。
9.优选的,所述热合温度为173-175℃,热合速度为25-30支/min。
10.通过采用上述技术方案,当热合温度高于180℃时,制造的产品包装在使用时,透析纸与盒托无法撕开,或撕开透析纸后,盒托密封处产生纸毛影响使用。同时温度过高会使得盒托会熔化沾在设备上,影响设备正常生产,而且会造成能耗增加。
11.而当热合温度低于170℃时,会产生透析纸与盒托无法热合,成品率下降。
12.同样的,热合速度高于35支/min时,也存在透析纸与盒托无法热合,成品率下降的问题。而当热合速度低于25支/min时,会使得生产效率下降,能耗增加。
13.在一个具体的实施方式中,所述热合温度还可以为171℃、172℃、173℃、174℃、175℃、176℃、177℃、178℃、179℃;所述热合速度为26支/min、27支/min、28支/min、29支/min、30支/min、31支/min、32支/min、33支/min、34支/min、35支/min。
14.优选的,所述热合温度为175℃,热合速度为30支/min。
15.热合温度为175度、速度为时30支/min,由此生产的产品包装满足纸塑盒密封良好,外表面无破损或污物,成品合格率高。
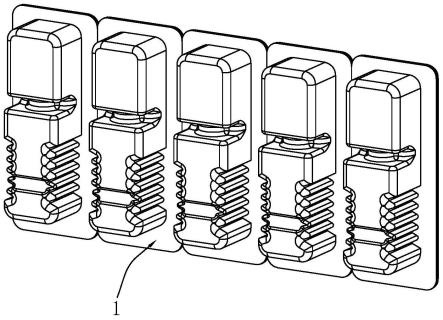
16.优选的,所述盒托为五连托,所述透析纸的尺寸与五连托的开口尺寸相适配。
17.得益于本技术制备工艺的先进性,使得本技术开创新的包装形式,不仅能够兼顾生产效率,同时灭菌效果良好,操作简单,成品合格率高。
18.在一些实施方式中,所述灭菌操作中的灭菌温度可以是110-111℃、110-112℃、110-113℃、110-114℃、110-115℃、110-116℃、110-117℃、110-118℃、110-119℃、110-120℃、110-121℃、110-122℃、110-123℃、110-124℃、110-125℃、110-126℃、110-127℃、111-128℃、112-128℃、113-128℃、114-128℃、115-128℃、116-128℃、117-128℃、118-128℃、
119-128℃、120-128℃、121-128℃、122-128℃、123-128℃、124-128℃、125-128℃、126-128℃、127-128℃、111-112℃、111-113℃、111-114℃、111-115℃、111-116℃、111-117℃、111-118℃、111-119℃、111-120℃、111-121℃、111-122℃、111-123℃、111-124℃、111-125℃、111-126℃、111-127℃、112-113℃、112-114℃、112-115℃、112-116℃、112-117℃、112-118℃、112-119℃、112-120℃、112-121℃、112-122℃、112-123℃、112-124℃、112-125℃、112-126℃、112-127℃、113-114℃、113-115℃、113-116℃、113-117℃、113-118℃、113-119℃、113-120℃、113-121℃、113-122℃、113-123℃、113-124℃、113-125℃、113-126℃、113-127℃、114-115℃、114-116℃、114-117℃、114-118℃、114-119℃、114-120℃、114-121℃、114-122℃、114-123℃、114-124℃、114-125℃、114-126℃、114-127℃、115-116℃、115-117℃、115-118℃、115-119℃、115-120℃、115-121℃、115-122℃、115-123℃、115-124℃、115-125℃、115-126℃、115-127℃、116-117℃、116-118℃、116-119℃、116-120℃、116-121℃、116-122℃、116-123℃、116-124℃、116-125℃、116-126℃、116-127℃、117-118℃、117-119℃、117-120℃、117-121℃、117-122℃、117-123℃、117-124℃、117-125℃、117-126℃、117-127℃、118-119℃、118-120℃、118-121℃、118-122℃、118-123℃、118-124℃、118-125℃、118-126℃、118-127℃、119-120℃、119-121℃、119-122℃、119-123℃、119-124℃、119-125℃、119-126℃、119-127℃、120-121℃、120-122℃、120-123℃、120-124℃、120-125℃、120-126℃、120-127℃、121-122℃、121-123℃、121-124℃、121-125℃、121-126℃、121-127℃、122-123℃、122-124℃、122-125℃、122-126℃、122-127℃、123-124℃、123-125℃、123-126℃、123-127℃、124-125℃、124-126℃、124-127℃、125-126℃、125-127℃、126-127℃;灭菌时间可以是11min、12min、13min、14min。
19.优选的,所述灭菌操作采用118-125℃灭菌12min。
20.通过采用上述技术方案,当灭菌温度高于128℃时,会产生药物成分被破坏,同时能耗增加。而当灭菌温度低于110℃时,灭菌效果达不到。灭菌时间过长,药品成分被破坏,能耗增加,而灭菌时间过短时灭菌效果较差。
21.在一个具体的实施方式中,所述灭菌操作的灭菌温度是111℃、112℃、113℃、114℃、115℃、116℃、117℃、118℃、119℃、120℃、121℃、122℃、123℃、124℃、125℃、126℃、127℃。
22.优选的,所述灭菌操作采用121℃灭菌12min。
23.优选的,所述灭菌操作方式为湿热灭菌。
24.通过采用上述技术方案,湿热灭菌相较于环氧乙烷蒸汽灭菌,该湿热灭菌方法单次灭菌量大,灭菌效率高,灭菌时间短,灭菌效果稳定性好,操作简单,安全性高,节约能源。
25.优选的,所述盒托采用聚丙烯材质制成。
26.通过采用上述技术方案,聚丙烯的熔点温度较高,本技术的制备工艺中,热合和灭菌操作的温度较高,而采用聚丙烯材料,减小了由于聚丙烯材料熔化,对无菌凝胶药物造成破坏的可能性。除此之外,常见的酸、碱等有机溶剂对聚丙烯几乎不起作用,便于无菌凝胶药物的存放。
27.第二方面,本技术提供一种用于无菌凝胶药物的产品包装,采用如下的技术方案:一种用于无菌凝胶药物的产品包装,采用上述制备方法制得,所述产品包装包括弹簧瓶、盒托和透析纸;所述弹簧瓶的周身为塔型弹簧,所述弹簧瓶塔型弹簧的上部为圆柱形的过渡
段,在所述过渡段的上侧所述弹簧瓶的瓶口内径逐渐缩小形成缩口段,并在缩口段的末端热合有封堵头,所述封堵头将所述弹簧瓶的瓶口密封;所述盒托开设有用以容纳所述弹簧瓶的空腔,并在所述空腔内形成有用以适配弹簧瓶周身塔型弹簧的若干凸起,所述弹簧瓶放入所述空腔内时,所述凸起卡设在所述塔型弹簧的间隙处,用以限制弹簧瓶的移动;且所述空腔内还设置有用以承托所述过渡段与缩口段连接处的限位承托半环。
28.本技术制备的产品包装是将盛装有无菌凝胶药物的弹簧瓶封装在盒托和透析纸之间的封包性包装。弹簧瓶的结构设计能够方便医生或者患者倾倒出弹簧瓶中的无菌凝胶药物,同时盒托的空腔凸起设计,也可将弹簧瓶稳定的限制在盒托内,减少弹簧瓶在热合时产生晃动发生偏移的可能性,提升合格率,而且在储存和运输时,凸起配合塔型弹簧以及限位承托半环的结构还可起到固定和减振作用,减少弹簧瓶在运输中因碰撞而产生泄露的可能性。
29.优选的,所述过渡段与缩口段的连接处一体成型有限位环,所述限位环外环的直径大于所述限位承托半环的内环直径。
30.通过采用上述技术方案,限位环抵接在限位承托半环的侧壁上,从而对弹簧瓶实现进一步限位,进一步降低弹簧瓶在盒托内发生横向晃动的可能性,减少弹簧瓶因挤压塔型弹簧瓶身而发生泄漏污染。
31.综上所述,本技术具有以下有益效果:1、本技术将弹簧瓶放置在盒托内,并通过透析纸将弹簧瓶密封在盒托内,同时控制热合温度和热合速度,从而在兼顾生产效率的基础上,使得盒托与透析纸密封良好,产品包装无破损或污物,成品合格率高;同时本技术中的无菌凝胶药物无需采用环氧乙烷灭菌,在110-128℃下灭菌10-15min便可达到无菌状态,降低了操作难度,强化了无菌凝胶药物的生产和使用的安全性。
32.2、本发明工艺流程简单,操作方便,生产周期短,生产效率高,适合工业化生产。
33.3、本技术制备的产品包装是将盛装有无菌凝胶药物的弹簧瓶封装在盒托和透析纸之间的封包性包装。弹簧瓶的结构设计能够方便医生或者患者倾倒出弹簧瓶中的无菌凝胶药物,同时盒托的空腔凸起设计,也可将弹簧瓶稳定的限制在盒托内,减少弹簧瓶在热合时产生晃动发生偏移的可能性,提升合格率,而且在储存和运输时,凸起配合限位承托半环的结构还可起到固定和减振作用,减少弹簧瓶在运输中因碰撞而产生泄露的可能性。
附图说明
34.图1是本技术实施例产品包装的立体结构图;图2是本技术实施例产品包装的另一立体结构图;图3是图2的后视图;图4是图3中隐去透析纸之后显示弹簧瓶与盒托的配合关系图;图5是体现弹簧瓶与盒托的立体结构图。
35.图中,1、盒托;11、凸起;12、限位承托半环;2、透析纸;3、弹簧瓶;31、塔型弹簧;32、过渡段;33、缩口段;34、封堵头;35、限位环。
具体实施方式
36.以下结合附图和实施例对本技术作进一步详细说明。
37.予以特别说明的是:除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的实验试剂,如无特殊说明,均为常规生化试剂;以下实施例中所用的原材料、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得;所述实验试剂用量,如无特殊说明,均为常规实验操作中试剂用量;所述实验方法,如无特殊说明,均为常规方法。
38.本技术所用热合设备为药用自动转盘封口机,型号:jl-28/40-5ac,设备厂家上海久罗机电设备有限公司。
39.灭菌设备为通风式灭菌柜,采用湿热灭菌的方式。
40.参照图1和图2,本技术提供了一种用于无菌凝胶药物的产品包装,包括盒托1,盒托1可根据生产需要设计为两连托、三连托、四连托、五连托,其中盒托1的材质为聚丙烯材质,从而便于适用热合温度和灭菌温度。
41.参照图3和图4,在盒托1的另一侧热合有透析纸2,该透析纸2可以根据盒托1的连托形式定制特符合两连托、三连托、四连托、五连托的开口尺寸,只要透析纸2能够完成两连托、三连托、四连托、五连托的开口封闭即可,多个盒托1也通过透析纸2的热合形成相对应的连托形式。
42.参照图4和图5,盒托1内开设有空腔,在空腔内放置有弹簧瓶3,弹簧瓶3内盛装有无菌凝胶药物。弹簧瓶3整体为塔型结构,且弹簧瓶3的周身为塔型弹簧31,弹簧瓶3塔型弹簧31的上部为圆柱形的过渡段32,在过渡段32的上侧弹簧瓶3的瓶口内径逐渐缩小形成缩口段33,并在缩口段33的末端热合有封堵头34,封堵头34将弹簧瓶3的瓶口密封。盒托1的空腔整体与弹簧瓶3的形状相适配,并在空腔内形成有用以适配弹簧瓶3周身塔型弹簧31的若干凸起11,凸起11的数量根据弹簧瓶3的塔型弹簧31的螺距做适应性设置,以使弹簧瓶3放入空腔内时,凸起11卡设在塔型弹簧31的间隙处,用以限制弹簧瓶3的移动;且空腔内一体成型有用以承托过渡段32与缩口段33连接处的限位承托半环12,过渡段32与缩口段33的连接处一体成型有限位环35,在弹簧瓶3放入空腔时,限位环35位于限位承托半环12与塔型弹簧31之间,限位环35外环的直径大于所述限位承托半环12的内环直径,以使限位环35、塔型弹簧31与凸起11之间的配合,将弹簧瓶3稳定的限制在盒托1内,减少在热合时产生晃动发生偏移的可能性,提升合格率,同时减少弹簧瓶3在运输中因碰撞而产生泄露的可能性。
43.本技术还提供一种用于无菌凝胶药物的产品包装的制备工艺,包括以下步骤:s1、将盛装好无菌凝胶药物的弹簧瓶3放置在盒托1内,随后将透析纸2热合在盒托1的开口处,热合温度为热合温度为170-180℃,热合速度为25-35支/min。
44.s2、随后目测盒托1与透析纸2热封处是否密封良好,外表面是否有破损或者污物。
45.其中,密封性检测方法:甲苯胺蓝染色渗透试验根据astm f1929-2012标准方法采用染色渗透法检测无菌包装封口泄漏性能s2.1实验方法:把已灭菌产品包装在试验开始之前,放置于大气温度23
±
2℃(73.4
±
3.6of)和相对湿度50
±
2%环境中进行存贮24小时。
46.依据astmf1929-2012标准,将足够的染料渗透液注入包装中,覆盖最长的封边,深
度约5mm(0.25英寸)(注入方法:可以使用带有软管的注射器通过切口送入染料渗透剂)使染料渗透液与封边保持接触最少5s最多20s的时间,旋转包装使每道封边都能接触渗透液,如有需要可以补充染色液,确保每道封边都能接触足够量的染色液。通过包装的透明面目力检测密封区,看有无泄漏或者通道出现,也可使用放大镜进行细致的观察。
47.s2.2检验标准在包装透明的一边,用肉眼检测封口区域。即可看见封口区的通道。检查染色液有无透过密封区到达另一侧或染色液有无通过确定的通道进入密封区内部的迹象。
48.s2.3注意事项染色渗透液与包装材料封边的作用时间不应超过20秒。
49.s3、随后将封闭后的盒托1、弹簧瓶3和透析纸2在110-128℃下灭菌10-15min完成灭菌操作形成所述产品包装。
50.以下结合实施例对本技术作进一步详细说明。实施例
51.实施例1一种用于无菌凝胶药物的产品包装的制备工艺,包括以下步骤:s1、盒托1一次设置有有五个形成五连托,将盛装好无菌凝胶药物的弹簧瓶3放置在五连托内,随后将五连托放入jl-28/40-5ac型药用自动转盘封口机工位上,透析纸2对的尺寸可覆盖五连托的开口,设定热合温度为热合温度为170℃,热合速度为25支/min,封口机自动将透析纸2热合在五连托的开口处,热封压力为0.426mpa,热封时间为5.5s,冷却时间为5.5s。
52.s2、随后目测盒托1与透析纸2热封处是否密封良好,外表面是否有破损或者污物。目测检测五连托热封处,纸塑盒密封良好,外表面无破损或污物。
53.其中,密封性检测方法:甲苯胺蓝染色渗透试验根据astm f1929-2012标准方法采用染色渗透法检测无菌包装封口泄漏性能s2.1实验方法:把已灭菌产品包装在试验开始之前,放置于大气温度23
±
2℃(73.4
±
3.6of)和相对湿度50
±
2%环境中进行存贮24小时。
54.依据astmf1929-2012标准,将足够的染料渗透液注入包装中,覆盖最长的封边,深度约5mm(0.25英寸)(注入方法:可以使用带有软管的注射器通过切口送入染料渗透剂)使染料渗透液与封边保持接触最少5s最多20s的时间,旋转包装使每道封边都能接触渗透液,如有需要可以补充染色液,确保每道封边都能接触足够量的染色液。通过包装的透明面目力检测密封区,看有无泄漏或者通道出现,也可使用放大镜进行细致的观察。
55.s2.2检验标准在包装透明的一边,用肉眼检测封口区域。即可看见封口区的通道。检查染色液有无透过密封区到达另一侧或染色液有无通过确定的通道进入密封区内部的迹象。
56.s2.3注意事项染色渗透液与包装材料封边的作用时间不应超过20秒。
57.s3、随后将步骤s2中检查合格的五连托放入通风式灭菌柜在110℃下灭菌15min完成灭菌操作形成所述产品包装。
58.实施例2-16实施例2-16分别提供一种用以无菌凝胶药物的产品包装的制备工艺,与实施例1的不同之处在于,热合和灭菌操作的参数不同,具体如表1所示。
59.表1实施例1-16中热合和灭菌操作的参数对比例对比例1一种用以无菌凝胶药物的产品包装的制备工艺,与实施例1的不同之处在于,热合温度为160℃,热合速度为20支/min。
60.对比例2一种用以无菌凝胶药物的产品包装的制备工艺,与实施例1的不同之处在于,热合温度为185℃,热合速度为40支/min。
61.对比例3一种用以无菌凝胶药物的产品包装的制备工艺,与实施例1的不同之处在于,灭菌温度为100℃,灭菌时间为20min。
62.对比例4一种用以无菌凝胶药物的产品包装的制备工艺,与实施例1的不同之处在于,灭菌温度为135℃,灭菌时间为5min。
63.性能检测试验检测方法渗透测试把已灭菌产品包装在试验开始之前,放置于大气温度23
±
2℃(73.4
±
3.6of)和相对湿度50
±
2%环境中进行存贮24小时。
64.依据astmf1929-2012标准,将足够的染料渗透液注入包装中,覆盖最长的封边,深度约5mm(0.25英寸)(注入方法:可以使用带有软管的注射器通过切口送入染料渗透剂)使染料渗透液与封边保持接触最少5s最多20s的时间,旋转包装使每道封边都能接触渗透液,
如有需要可以补充染色液,确保每道封边都能接触足够量的染色液。通过包装的透明面目力检测密封区,看有无泄漏或者通道出现,也可使用放大镜进行细致的观察。
65.检验标准在包装透明的一边,用肉眼检测封口区域。即可看见封口区的通道。检查染色液有无透过密封区到达另一侧或染色液有无通过确定的通道进入密封区内部的迹象。
66.注意事项染色渗透液与包装材料封边的作用时间不应超过20秒。
67.以此测得实施例1-16和对比例1-4的合格率,合格率=(产品包装总数-渗透产品包装数)/产品包装总数
×
100%。
68.剥离测试测定方法:依据《yy/t 0698.5-2009最终灭菌医疗器械包装材料》进行剥离强度检测。
69.本技术各实施例和对比例1、3-4制备工艺制备产品包装的透析纸在剥离之后均无起毛现象,对比例2的产生了部分起毛现象。
70.无菌凝胶药物的灭菌效果检查分别在上述实施例1-16和对比例1-4中随机取样5瓶无菌凝胶药物,将各实施例和对比例中的五瓶无菌凝胶药物分别接入细菌培养基上,放入恒温培养箱在28-30℃培养5-7d,检查有无细菌或霉菌菌落出现并记录菌落个数。
71.本技术各实施例中经过灭菌操作的产品包装均没有出现菌落,仅有对比例3产生了1个菌落。
72.表2各实施例和各对比例中产品包装各项性能测试结果结合实施例1-16和对比例1-4并结合表2可以看出,本技术各实施例中的产品渗透
合格率高于91%以上,最高的合格率为100%,横向剥离强度大于6.2n/15mm,最高为6.9n/15mm,纵向剥离强度大于6.2n/15mm,最高为7.9n/15mm,且本技术制备的产品包装中的无菌凝胶药物灭菌效果达到行业要求的无菌标准。
73.结合实施例1-11和对比例1-2并结合表2可以看出,本技术的热合温度为170-180℃,热合速度为25-35支/min时,制备的产品包装各项性能皆较佳,其中实施例6中热合温度为175℃,热合速度为30支/min时,兼具生产效率和各项性能,此时产品包装的渗透合格率为99%,横向剥离强度为6.8n/15mm,纵向剥离强度为7.7n/15mm。
74.结合实施例12-16和对比例3-4并结合表2可以看出,灭菌温度为110-128℃,灭菌时间为10-15min时,不仅能够使得无菌凝胶药物达到无菌状态,同时还可对产品包装的物理性能产生一定的影响,虽然影响不大,但是在实施例14中,灭菌温度为121℃,灭菌时间为12min时,产品包装的渗透合格率为100%,横向剥离强度为6.9n/15mm,纵向剥离强度为7.9n/15mm。
75.综上,本技术将弹簧瓶放置在盒托内,并通过透析纸将弹簧瓶密封在盒托内,同时控制热合温度和热合速度,从而在兼顾生产效率的基础上,使得盒托与透析纸密封良好,产品包装无破损或污物,成品合格率高;同时本技术中的无菌凝胶药物无需采用环氧乙烷灭菌,在110-128℃下灭菌10-15min便可达到无菌状态,降低了操作难度,强化了无菌凝胶药物的生产和使用的安全性。
76.可以理解的是,以上实施方式仅仅是为了说明本发明的原理而采用的示例性实施方式,然而本发明并不局限于此。对于本领域内的普通技术人员而言,在不脱离本发明的精神和实质的情况下,可以做出各种变型和改进,这些变型和改进也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1