一种形成微流体凝胶结构的方法和装置与流程
本发明涉及一种能够实现细胞三维培养的方法和装置,该方法和装置能够可控和可靠地实现类器官测定和/或细胞培养的血管化和/或灌注。本发明还涉及研究细胞对该方法和装置产生的刺激物的反应的用途。
背景技术:
1、为了模拟更加贴近生理条件的细胞培养环境,人们开发了许多模型来实现例如临床前细胞模型中的灌注流和共培养,以评估药物的有效性和/或adme安全性。
2、微流体由于其在使用过程中液体或培养基的固有流动性,以及促进和实现复杂的微流体网络的微工程技术的进步,已成为一种体外细胞培养模型的通用平台技术。然而,人们仍然对开发能够模拟或再现人类或动物体内不同器官的细胞环境的模型有着浓厚的兴趣。
3、类器官培养,或者更一般地说,3d细胞培养,可以采用多种方式进行。3d球体可以在所谓的悬滴板(例如,参见wo 2010/031194)或低粘附微孔板中形成。尽管有人声称这些球体能够显著提高标准细胞培养的预测性,但它们并没有被用于大多数的类器官培养。原因在于,类器官通常需要细胞外基质成分,例如基质胶(matrigel)或胶原,而这些成分在悬滴板或低粘附微孔板的球体中并不存在。同时,还开发了3d细胞培养模型,在该3d细胞培养模型中细胞生长嵌入至细胞外基质中。这种方法增强了分化功能的表达,并改善了组织结构(pampaloni et al.(2007).nat rev mol cell biol 8:839-84)。
4、培养类器官的典型平台包括标准培养皿、微孔板,在某些情况下还包括康宁公司的板。在这些情况下,类器官在细胞外基质(ecm)中或在ecm涂覆的孔中培养。正如上面已经提到的,这些类器官缺乏血管,由此类器官生长超过一定尺寸会发生缺氧并在后期可能形成坏死核心,从而限制了类器官的生长。同时,由于内皮细胞向靶组织分泌重要因子,因此可以假设内皮细胞的存在对于向生理相关组织的发育是至关重要的。
5、微流体细胞培养在药物筛选、组织培养、毒性筛选和生物学研究中发挥着日益重要的作用。
6、目前已经有许多微流体系统、设备、方法和制造技术是已知的,包括专利文献(例如wo 2008/079320、wo 2013/151616、wo 2010/086179、wo2012/120101)中公开的那些,或者可商购获得(例如从荷兰莱顿的mimetas公司)的那些(例如:organoplate;www.mimetas.com)。虽然不应从这些申请和文献中解读到本发明中提出的任何权利要求的任何特定限制,但是这些文献为本技术提供了有用的背景材料。
7、在文献a novel dynamic neonatal blood-brain barrier on achip.s.deosarkar,b.prabhakarpandian,b.wang,j.b.sheffield,b.krynska,m.kiani.plos one,2015中,开发了一种产生血管的微流体装置,该微流体装置采用筛状结构将内皮细胞与星形胶质细胞分离,试图产生血脑屏障型结构。在wo 2007/008609a2中,使用类似的筛状结构来形成细胞聚集体,以建立出更好地模拟例如肝脏生理学的组织形态。
8、因此,仍然需要一种方法和装置,可以让ecm支持的生物组织在灌注培养下更接近体内情况。特别令人感兴趣的是一种方法和装置,它可以在相邻的结构中对多种细胞进行图案化,同时最大限度地减少这些结构之间的空间分离和物理阻碍。这项技术也应与现代的读出和处理设备相兼容。
9、本发明的目的是解决上述需求中的一些或全部。
技术实现思路
1、根据本发明的第一方面,本文提供了一种用于形成内腔化凝胶结构的方法,包括:
2、将含有凝胶前体溶液的第一液体引入微流体网络,该微流体网络包括毛细管压力屏障,该毛细管压力屏障位于大体限定了微流体网络的第一区域和第二区域之间的边界的位置;
3、允许第一液体进入微流体网络的第一区域,并让第一液体沿着毛细管压力屏障,从而在微流体网络的第一区域和第二区域之间的边界处形成第一液体的液-气弯液面;
4、通过将第一液体与第二液体接触形成穿过第一液体的内腔,其中第二液体的粘度低于第一液体的粘度;和
5、允许或引起第一液体凝胶化,从而形成包含穿过其中的内腔的凝胶结构。
6、根据本发明的第二方面,本文提供了一种装置,包括:
7、微流体网络,该微流体网络包括:
8、至少两个入口;
9、毛细管压力屏障,该毛细管压力屏障位于限定了微流体网络的第一区域和第二区域之间的边界的位置;和
10、凝胶,该凝胶设置在第一区域中,在所述至少两个入口中的两个入口之间延伸,并被毛细管压力屏障限制在第一区域内。
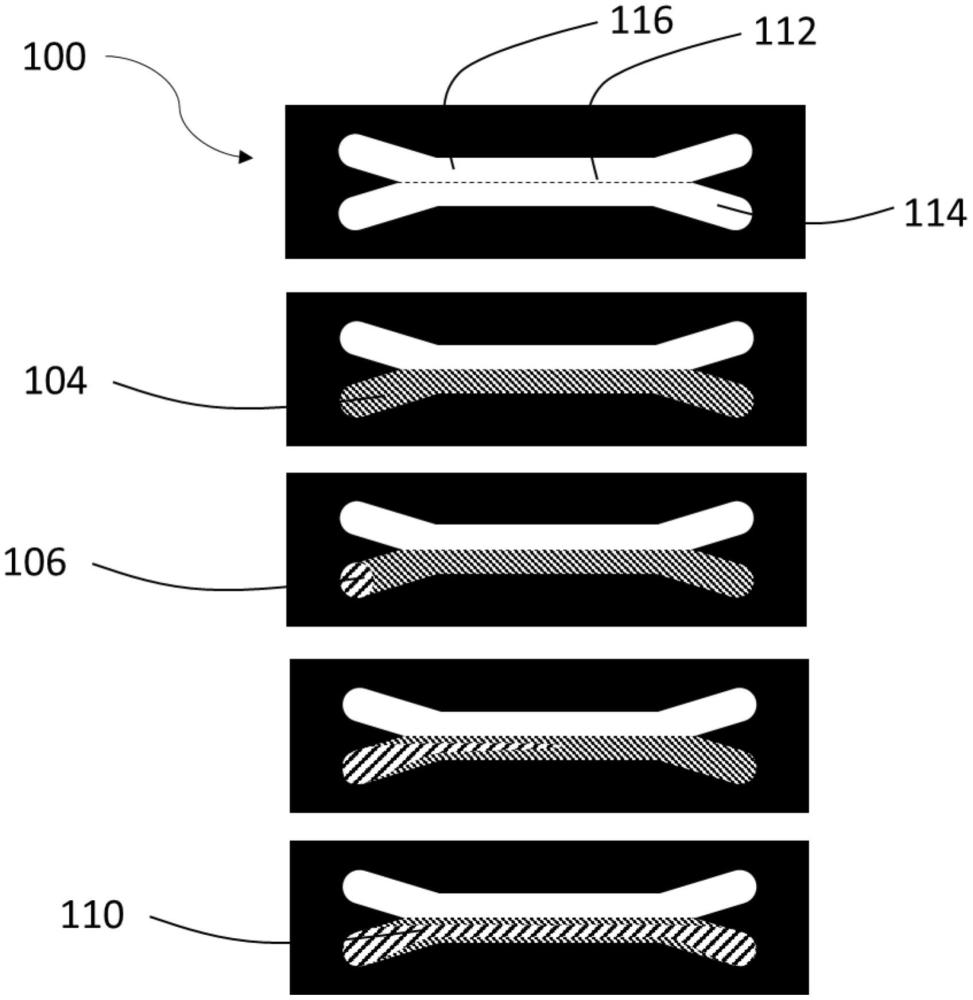
11、其中,该凝胶包含在所述至少两个入口中的两个入口之间穿过的内腔;所述凝胶具有面向内腔的第一表面和面向微流体网络的第二区域的第二表面,并且第一表面和第二表面之间的凝胶厚度为200μm或更小。
12、根据本发明的第三方面,本文提供了一种使用由第一方面的方法形成的内腔化凝胶结构在检测中的用途,例如选自以下一项或多项检测:屏障功能检测、跨上皮电阻(teer)检测、免疫细胞粘附检测、免疫细胞跨移检测、转运体检测、血管舒张或收缩检测。
13、根据本发明的第四方面,提供了一种如第二方面中所定义的装置在检测中的用途,例如从以下一项或多项检测中选择的检测:屏障功能检测、跨上皮电阻(teer)检测、免疫细胞粘附检测、免疫细胞迁移检测、转运体检测、以及血管舒张或收缩检测。
14、其他优选实施例在随后的说明书和从属权利要求中限定。
15、本技术的发明人意外地发现,通过策略性定位毛细管压力屏障并结合粘性指进技术,可以在微流体网络的第一区域形成内腔化凝胶结构,该结构具有面向微流体网络另一个区域的暴露表面。到目前为止,微流体网络中的内腔化凝胶结构要么填充微流体通道并在所有侧面接触通道壁,要么由膜支撑以便允许凝胶内外的扩散。由于粘性指进技术依赖于一种液体在另一种液体中形成腔,所以,出乎意外的是,粘性指进的内腔化没有破坏在毛细管压力屏障处固定的第一液体的表面张力,这本来会导致固定弯液面塌陷。虽然人们预期需要支撑壁来防止内腔化的液体向侧面流出,但本发明展示了一种意想不到的方法,其允许在非常接近开放空间的位置形成内腔,而无需限制壁。
16、本发明的方法和装置可以在具有薄的间质空间的细胞外基质中形成三维构成的组织,从而以一种之前在不使用膜的情况下无法实现的方式来模拟体内情况。这使得能够在生理真实环境中在靠近单层和/或组织特异性细胞的三维培养物的情况下对内皮化内腔进行受控共培养,例如将内皮细胞、周细胞、星形胶质细胞和神经元在一个更真实的配置和基质中共培养,这比现有的微流体血脑屏障模型更真实。
17、释义
18、在整个说明书和权利要求书中使用的与本发明的装置、方法、用途和其他各个方面相关的各种不同的术语。除非另有说明,这些术语具有本发明所属技术领域中的通用含义。其他具体定义的术语应以与本文提供的定义一致的方式解释。虽然在实施本发明时可使用与本文描述的那些方法和材料相似或等同的任何方法和材料,但本文所述的为优选的材料和方法。
19、在本文中,除非另有明确说明,“不定冠词(a,an)”和“定冠词(the)”的单数形式还包括复数指示物。因此,例如,提及“细胞”包括两个/种细胞或更多个/种细胞等的组合。
20、当涉及诸如量,持续时间等可测量值时,本文中使用的术语“约和大约”意在包括特定值的±20%或±10%的变化,更优选地包括特定值的±5%的变化,甚至更优选地包括特定值的±1%的变化,仍更优选地包括特定值的±0.1%的变化,这类变化对于实施本文公开的方法而言是合适的。
21、本文使用的“包括”应解释为包含性的且开放的,而不是排除性的。具体而言,该术语及其变体意在包括具体特征、步骤或组分。这些术语不应被解释为排除其他特征、步骤或组分的存在。
22、本文使用的“示例性”是指“作为实施例、例子或举例说明”,并且不应被解释为排除本文公开的其他配置。
23、本文使用的术语“微流体网络”是指由顶部基板或盖子覆盖的材料层上的或穿过该材料层的一个或多个通道,其长度、宽度或高度中的至少一个维度处于低范围(例如小于5mm或小于2mm)或在亚毫米范围内。应当理解的是,该术语包括线性通道以及分支的通道或在其路径中具有弯曲或拐角的通道。微流体网络通常包括至少一个用于施加一定量液体的入口,但也可以包括多个用于给微流体网络的不同区域施加一定量液体的入口。微流体网络中所封闭的体积通常在微升或亚微升范围内。微流体通道通常包括一个基底(其可为下层材料的上表面)、至少两个侧壁和一个天花板(其可为覆盖微流体通道的上部基板的下表面),根据需要,该微流体通道具有任何入口、出口和/或通风口配置。基底、侧壁和天花板可以分别被称为微流体网络的内表面,也可以共同被称为微流体网络的内表面。在一些例子中,微流体网络可以有一个圆形或半圆形的横截面(其可被视为分别具有一个或两个内表面)。
24、本文使用的术语“毛细管压力屏障”指的是通过毛细管作用力使液体-空气弯液面固定在某个位置的装置的特征。毛细管压力屏障可被认为是将一个具有体积v0的微流体网络分成两个区域或两个子体积v1和v2,不同的液体可以被引入到这两个区域或两个子体积v1和v2中。换句话说,毛细管压力屏障通常限定了微流体网络的第一区域和第二区域之间的边界。应该理解的是,虽然毛细管压力屏障通常限定了微流体网络区域之间的边界,但是在一个区域中所引起的液体固定弯液面可能不会固定在毛细管压力屏障的精确位置处,而是可能在仍然被固定的情况下,伸展或突出到毛细管压力屏障的相邻区域。例如,液体的弯液面可能是凸形的,并被毛细管压力屏障固定,凸形的液体前沿超出了毛细管压力屏障的覆盖区。液体的弯液面也可能是凹形的,液体前沿被毛细管压力屏障固定,并在与毛细管压力屏障相反的微流体网络表面上超出了毛细管压力屏障的覆盖区。
25、本文使用的“线性”毛细管压力屏障不应被解释为直线,而应被解释为具有两端的线,但其可包括一个或多个弯曲或角度。线性毛细管压力屏障通常在其每一端与微流体通道的侧壁相交。
26、本文使用的术语“内皮细胞”是指内皮起源的细胞,或分化至如下状态的细胞,在所述状态中,所述细胞表达识别作为内皮细胞的细胞的标志物。
27、本文使用的术语“上皮细胞”是指上皮起源的细胞,或分化至如下状态的细胞,在所述状态中,所述细胞表达识别作为上皮细胞的细胞的标志物。
28、本文使用的术语“生物组织”是指一组相同、相似或不同类型的功能相互连接的细胞,它们将在本文所述的方法中进行培养和/或检测。细胞可以是细胞聚集体、管状结构或单层的形式。生物组织可以由多种亚型的细胞构成。例如,或者是来自患者的特定组织样品。例如,“生物组织”这一术语源自或包含细胞系、类器官、组织活检、肿瘤组织、切除组织材料和胚胎体的细胞。
29、本文使用的术语“细胞聚集体”是指相对于通常单层生长的表面附着细胞而言的3d细胞簇。3d细胞簇通常更接近体内的情况。相比之下,表面附着细胞更容易受到基板性质的影响,并且可能发生去分化或向其他细胞类型转变。
30、本文使用的术语“类器官”是指组织的微型形式,其在体外形成并表现出内源性三维器官结构。
31、本文使用的术语“共培养”是指在本文所述的装置中培养两种或更多种不同的细胞类型。不同的细胞类型可以在装置的同一区域(例如,第一区域或第二区域)中培养,也可以在不同的区域(例如,一种细胞类型在第一区域,另一种细胞类型在第二区域)中培养。
32、例如,本文所述的装置可以在第一区域中培养内皮细胞,使内皮细胞形成一个具有开放内腔的小管,在第二区域中培养器官特异性(实质性)细胞,两者之间由第一区域的一层薄的凝胶层分隔。在一些实施例中,装置包含至少一个在第一区域中的内衬有内皮细胞的内腔化凝胶结构以及在第二区域中的组织特异性细胞。组织特异性细胞可在第二区域的整个凝胶结构中分布,覆盖第二区域的表面,形成一个与第一区域的凝胶结构(包括内皮细胞覆盖的腔)接触的小管;或者内衬穿过第二区域的凝胶结构的一个内腔。
33、本文使用的术语“内腔化凝胶结构”是指一种生物相容性凝胶,优选为一种生物相关的凝胶,例如细胞外基质,其具有贯穿凝胶的内腔,使其可以形成例如具有顶面和基面的微血管。应该理解的是,“内腔化凝胶结构”和“内腔凝胶结构”可以互换使用,因为这两个术语具有相同的含义。
34、本文使用的术语“内腔化细胞构件”是指具有内腔的生物组织(即由细胞构成),例如具有顶面和基面的微血管。
35、本文使用的术语“移植”是指将组织(例如组织移植体)或细胞聚集体从一个位置转移到另一个位置,例如从存储容器转移到细胞培养装置。
36、本文使用的术语粘度,除非另有说明,是指动态粘度,并按照kane等人的描述进行测定(aip advances 8,125332(2018))。内腔形成与粘度之间的关系与saffman和taylor在1958年提出的saffman-taylor不稳定性(proceedings of the royal society oflondon.series a.mathematical and physical sciences.245(1242):312–329.)所描述的一致,并可被本领域技术人员所理解。微通道尺寸与细胞外基质相关的其他相关性质之间的关系,与bischel等人在文章中描述的一致(journal of laboratory automation 17(2)96–103)。
- 还没有人留言评论。精彩留言会获得点赞!