一种经混凝收获的微藻生物质净化及混凝剂回收的方法与流程
本发明属于微藻养殖领域,尤其是关于微藻收获及资源的回收再利用技术。
背景技术:
微藻养殖中一个重要的环节就是微藻的收获。由于微藻是单细胞生物,通常体积微小,一般细胞直径大小范围仅在几个微米到十几个微米之间,因而其在水体中培养至成熟后,采收的难度和能耗成本均较大,这也是制约微藻产业化应用的一个原因。
微藻混凝收获法应用于微藻细胞的采收具有多方面的好处,首先是操作简便易行,不需任何昂贵的专门设备系统,属于成本低的无耗能过程。关键在于应确保采用的混凝剂对环境不会造成危害,安全无毒,同时具有良好的浓缩微藻细胞的效果。微藻的混凝收获法又包括混凝-沉降法、混凝气浮法、混凝离心法、混凝膜过滤法等。无论是哪一种方法,首先都是利用混凝剂加入到微藻培养池中,使微藻利用藻细胞和絮凝剂之间的各种作用力而达到分离的目的。最初所使用的絮凝剂均为无机絮凝剂,即各种易水解的金属盐和聚合金属盐。它们水解生成带正电荷的产物,通过吸附电中和作用与带负电荷的微藻细胞形成聚集体,再以网捕形式作用于藻细胞,使微藻细胞絮凝沉降(水处理化学,北京:化学工业出版社,2002:29-36.)。
混凝收获法主要用于大规模养藻过程中藻的初步浓缩,使大水体中的藻能够快速形成大絮团以便进行初步的浓缩,例如浓缩至原体积的10%,后期(视藻生物质的具体用途)再利用其他方法将呈絮团的微藻生物质中的混凝剂分离出来,由于被处理的物质体量已经相对于原水体已大幅缩小,因此减小后期处理的难度和成本。
然而在混凝收获过程中,混凝剂的成本占收获成本的40%以上,且混凝收获后混凝剂残留在微藻生物质和培养液中,对微藻食品、饲料以及生物能源的生产具有负面的影响。因此,一种高效地净化微藻生物质以及其中混凝剂的回收方法,不仅可以解决微藻生物质中混凝剂的残留问题,还可以循环再利用混凝剂和降低收获成本,对混凝收获法的广泛性应用是一个重要的技术完善和补充。
目前,已经有一些研究者提出了混凝剂的回收方法。如专利号cn104520452a公开了一种金属浸提和回收的方法,被提取的对象是含有金属氧化物的金属矿石,利用高浓度的酸液来提取金属离子,但并未考虑高浓度酸液对被处理物料的影响,且被处理物中金属例子的浓度较低,还额外需在第二步固液分离中添加有机聚合物絮凝剂以增加金属浓度。cn1709812a公开了利用一种在酸性环境下可生成二氧化氯气体或氯气的含氯盐类化合物,使高分子混凝剂从金属污泥中释放出来,以回收高分子混凝剂。该方法的含氯盐类为氯酸钠,次氯酸钠等盐类,具有氧化性,成本高而且保存困难,产生的二氧化氯气体等虽然被收集并再利用,但是气体收集的操作复杂性,会导致气体发生泄漏等安全性问题。
因此,关于混凝收获法分离得到的微藻生物质中混凝剂的回收技术,有待进一步探讨和研究。
技术实现要素:
本发明的目的之一是,提出一种方法,能够将混凝收获法分离得到的微藻生物质中的混凝剂从微藻生物质中分离出来,使微藻生物质得到净化,不至于影响微藻生物质后期利用和深加工。
本发明的目的之二是,提出一种方法,能够将混凝收获法分离得到的微藻生物质中的混凝剂从微藻生物质中分离出来,使混凝剂能够再生成为新的混凝剂,再次利用到下一批的微藻收获处理中。
本发明的目的之三是,是能够将微藻混凝收获过程中,残留在微藻培养液中过量的混凝剂能够从培养液中分离出来,以便将培养液再次用来养藻。
本发明的再一个目的是,提供一种混凝剂,能够具有更好的微藻混凝效果,有效提高微藻混凝收获效率,减少混凝剂原料用量和收获成本。
为了实现上述目的,本发明采用如下技术方案:
一种经混凝收获的微藻生物质净化及混凝剂回收的方法,包括:
s1洗脱:向混凝收获后的微藻生物质中加入酸性洗脱液,并采用均质化操作使二者形成一混合物;经离心或静置,分别收集清液和微藻生物质;
s2转化:向所述清液中加入强碱,清液中形成难溶性或不溶性氢氧化物;
s3回收:分离所述难溶性或不溶性氢氧化物,用酸液中和获得高浓度的混凝剂,从而实现混凝剂的回收。
根据本发明一个可行的实施例,其中所述的酸性洗脱液为无机强酸,浓度为0.01~2mol/l,酸性洗脱液与微藻生物质的液固比是100~250ml/g,优选为200ml/g。
上述液固比是100~250ml/g,即每1g生物质加入100-250ml的酸性洗脱液。
根据本发明一个可行的实施例,其中所述的酸性洗脱液为盐酸、硫酸、硝酸。
根据本发明一个可行的实施例,所述的混凝剂为铝盐、铁盐或其组合。所述铝盐又包括含不同数量结晶水的硫酸铝、聚合氯化铝(缩写pac)等;铁盐包括三氯化铁、硫酸亚铁、碳酸镁等。
根据本发明一个可行的实施例,其中步骤s1重复至少2次以上,并将每次收集的清液合并到一起,再按照步骤s2处理。
根据本发明一个可行的实施例,混凝收获过程中产生的微藻培养液废液也一并合并到步骤s1收集的清液中,再按照步骤s2处理。
根据本发明一个可行的实施例,其中步骤s2所使用的强碱为naoh或koh。
本发明还提供了一种具有高效混凝效果的混凝剂,其是由上述方案的任一种实施例回收得到的混凝剂。
其中,所述混凝剂包括向分析纯或工业级混凝剂中掺入藻细胞表面聚合物eps。
eps是胞外多聚物(extracelluarpolymericsubstance)的缩写,是胞外产物的一大类别,主要包括一些藻细胞胞外多糖类物质,还有少量的蛋白质。
本发明还提供了一种高效的微藻混凝收获方法,是将由前述任一方案或任一种实施例回收得到的混凝剂,加入到待收获的微藻培养液中。
本发明的技术效果:
(1)本发明用酸性洗脱液将混凝剂从混凝收获法得到的微藻生物质中回收出来,并进行再利用,不仅净化了微藻生物质,减少了混凝剂的存在给其商业应用带来的负面影响,还实现了混凝剂的循环。本发明回收得到的混凝剂可以进行混凝收获→洗脱→浓缩回收→混凝收获多次循环,降低整体工艺成本。
(2)本发明用氢氧化钠对回收得到的混凝剂溶液进行浓缩,提高了回收的混凝剂的实用性。
(3)本发明回收混凝剂的方法还适用于铁盐、聚合氯化铝等混凝剂;并对小球藻、雨生红球藻都适用,具有较广泛的适用性。
(4)本发明对混凝收获法实施过程中加入到微藻培养液中过量的混凝剂进行一定程度的清除和回收,降低培养液废液中混凝剂的含量,为培养液废液的再培养利用提供基础。
(5)按照本发明的混凝剂回收方法,所得到的混凝剂相较于新配制的混凝剂而言,具有显著将微藻凝聚成团的效果,可大幅缩短微藻凝聚时间,提供一种更高效的微藻混凝收获方法。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是本发明方法的工艺流程图。
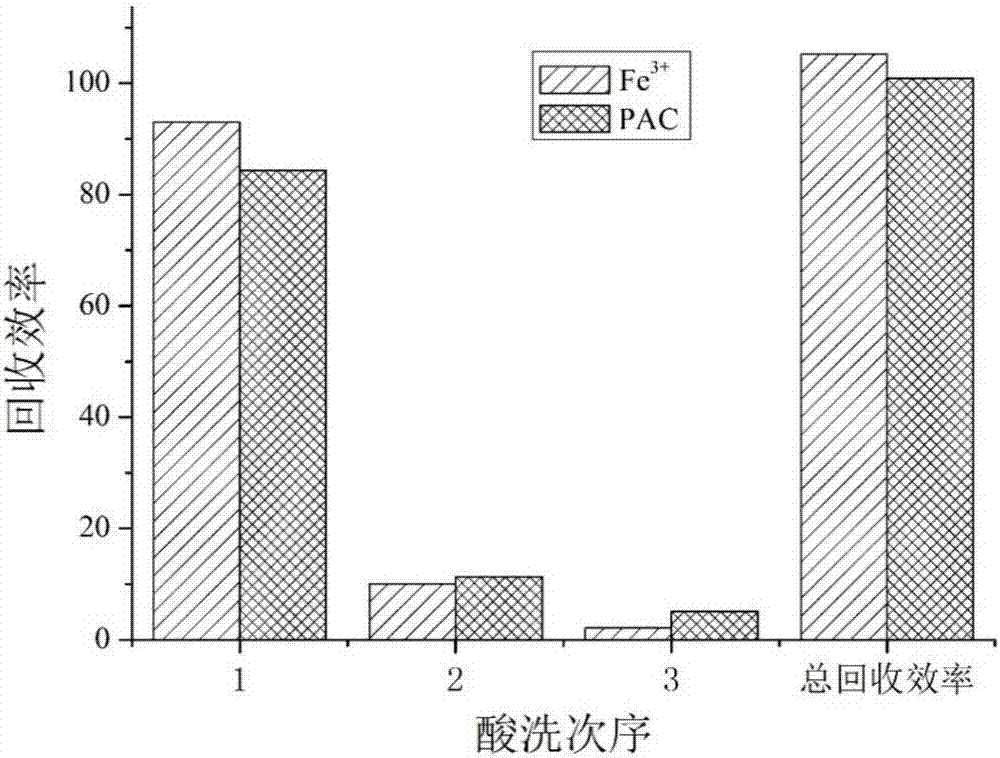
图2表示分别以铁盐和pac为混凝剂收获栅藻后,从栅藻中回收铁盐和pac的回收效率比较图。
图3表示从混凝收获的不同微藻生物质(栅藻、小球藻和雨生红球藻)中回收铝盐混凝剂的回收效率比较图。
图4表示新配制的铝盐溶液与按本发明方法回收的铝盐溶液作为混凝剂收获微藻的收获效率比较图。
图5是新配制的铝盐溶液与按本发明方法回收的铝盐溶液作为混凝剂加入到装有藻液的烧杯中,经历相同时间后的微藻沉降照片。
图6表示从混凝收获的微藻生物质中回收铝盐循环用于微藻收获,其循环次数与收获效率之间的关系图。
图7表示不同浓度的eps(用toc定量)下的al3+的混凝收获效率。
图8表示是以eps+al3+作为混凝剂和以eps单独加入到装有藻液的烧杯中,经历相同时间20min后的微藻沉降照片。
图9表示不同浓度的eps(用toc定量)下的al3+的混凝收获效率。
具体实施方式
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
如图1所示,本发明的一种经混凝收获的微藻生物质净化及混凝剂回收的方法,如图1所示。
微藻培养液中加入混凝剂,经混凝后,微藻聚集成较大絮团,然后通过静置沉淀或离心或过膜,分离出清夜与浓缩的藻液,浓缩的藻液再经过进一步离心或水自然蒸发,得到含有混凝剂的微藻生物质。
接着,向该微藻生物质中加入酸性洗脱液,然后通过静置沉降或离心处理,分离出净化后的微藻生物质和溶解有混凝剂的清夜,分别予以收集。然后,向收集的清夜中加入强碱碱液,会得到在水中难溶或不溶的金属氢氧化物沉淀。最后,收集这些金属氢氧化物沉淀,向其加入酸液中和,可得到回收的混凝剂。这一部分回收的混凝剂,又可再次投入微藻培养液中,用于微藻的混凝收获过程。
其中,所述的酸性洗脱液为盐酸、硫酸或硝酸等无机强酸,浓度为0.01~2mol/l,酸性洗脱液与微藻生物质的液固比是100~250ml/g;即,每1g生物质加入100-250ml的酸性洗脱液。所述混凝剂为含不同数量结晶水的硫酸铝、聚合氯化铝(英文缩写pac)、三氯化铁、硫酸亚铁或碳酸镁。其中,强碱碱液为naoh或koh。
其中,酸性洗脱液洗脱混凝剂的处理,可根据实际情况(如微藻生物质中混凝剂的含量),洗脱2次或2次以上直至微藻生物质中混凝剂含量降低至合理程度,每次洗脱得到的清夜都合并收集到一起,然后,向收集的清夜中加入碱液,会得到在水中难溶或不溶的金属氢氧化物沉淀。收集这些金属氢氧化物沉淀,向其加入酸液中和,可得到回收的混凝剂。此外,可对混凝收获过程中产生的微藻培养液废液也做同样的处理。
以下是本发明的混凝剂回收方法的具体实施例,用以具体说明本发明的方法及其技术效果。
实施例1
参见图2,图2表示分别以铁盐和pac为混凝剂收获栅藻后,从栅藻中回收铁盐和pac的回收效率比较图。
实验条件:分别用铁盐(fecl3)和pac(购自上海国药)来混凝收获栅藻后,用酸性洗脱液洗脱和回收栅藻中的混凝剂并且净化生物质。其中从同一微藻培养池中取同体积的样品,pac投加量为9.8mg/g(每一克藻液中加入9.8mg的pac),调节ph=6.2±0.2;fecl3投加量为40mg/g(每一克藻液中加入40mg的fecl3)。用酸性洗脱液洗脱时,使用hcl=0.1mol/l,液固比=200ml/g。洗脱后,收集的清液,使用naoh=5mol/l用来调节ph调至5~8,得到氢氧化物沉淀。沉降并离心得到含水率很低的回收混凝剂的氢氧化物,向其中加入酸,将氢氧化物完全中和溶解,即得到浓缩的回收的混凝剂氯化铁。
实验结果:如图2所示,在上述的实验条件下,从栅藻中可以分别回收出铁盐和pac,且仅在1次酸洗条件下便可以达到很高的回收效率,回收率均在90%左右。再分别进行第2次、第3次洗脱回收后,总的回收率接近100%。由此可知,本发明的混凝剂回收方法具有较高的回收能力,本方法具有较为广泛的适用性。
实施例2
参见图3,图3表示从混凝收获的不同微藻生物质(栅藻、小球藻和雨生红球藻)中回收铝盐混凝剂的回收效率比较图。
实验条件:对于栅藻(scenedesmusacuminatus)、小球藻(chlorellasorokiniana)、雨生红球藻(haematococcuspluvialis)藻液分别采用混凝收获;即分别投加al3+(硫酸铝)后,调节ph=6.2±0.2;酸洗时,hcl=0.1mol/l,液固比=200ml/g。
洗脱后,收集的清液,使用naoh=5mol/l用来调节ph调至5~8,得到氢氧化物沉淀。沉降并离心得到含水率很低的回收混凝剂的氢氧化物,向其中加入硫酸,将氢氧化物完全中和溶解,即得到浓缩的回收的混凝剂硫酸铝。
实验结果如图3所示。在上述的实验条件下,从栅藻、小球藻和雨生红球藻中都可以回收出铝盐,且仅在1次酸洗条件下洗脱回收便可以达到90%以上的效率。再分别进行第2次、第3次洗脱回收后,总的回收率接近93%。由此可知,本发明的混凝剂回收方法具有较为广泛的适用性。此外,由本实验可证明,本发明的方法适用于不同微藻混凝收获后其生物质中混凝剂的清除或混凝剂的回收,其效率与被收获微藻种类无关。
对于栅藻,在进行酸性洗脱液洗脱之前,微藻生物质中铝(al)元素含量为224mg/g,酸洗之后铝(al)去除率高于99.8%,铝(al)含量降低至0.1mg/g。本发明方法不仅可回收混凝剂,还可以高纯度地净化混凝回收的微藻生物质,以方便微藻生物质的进一步利用。
实施例3
参见图4-5。其中图4表示新配制的铝盐溶液与按本发明方法回收的铝盐溶液作为混凝剂收获微藻的收获效率比较图。
图5所示的照片,是新配制的铝盐溶液与回收的铝盐溶液作为混凝剂加入到含藻液的烧杯中,经历相同时间(15min)后的微藻沉降的照片。
实验条件:以栅藻(scenedesmusacuminatus)、硫酸铝为例,用酸性洗脱液来回收铝盐混凝剂,并研究按照本发明方法回收得到的混凝剂用于微藻收获时,其收获效率是否会与原厂购买(购自上海国药)分析纯的混凝剂的收获效率一致。
取用实施例2的栅藻生物质中回收的硫酸铝混凝剂,其浓度为10g/l;取用购自上海国药的分析纯的硫酸铝混凝剂配制成新鲜的硫酸铝溶液至同浓度10g/l,备用。
混凝沉降收获:栅藻藻液在室温(25℃)下,用bg-11培养基在15l的平板中培养;快速(200r/min)搅拌下分别加入回收的和原厂购买的铝盐混凝剂,接着调节溶液ph=6.2±0.2,然后慢速(30r/min)搅拌15min,接着静置15min后取上清测干重,计算收获效率。
混凝剂回收时,将微藻混凝层进行离心以降低含水率,然后加入盐酸,浓度为0.1mol/l,液固比为200ml/g(每1g混凝微藻生物质中加入200ml的盐酸),旋转搅拌15min后离心,上清含有待回收的混凝剂。再上清中加入碱液,[naoh]=5mol/l,使ph值在5~8,沉降并离心得到含水率很低的回收混凝剂的氢氧化物,向其中加入酸,将氢氧化物完全中和溶解,即得到浓缩的回收的混凝剂。
比较新配制铝盐溶液和回收的铝盐溶液的混凝收获效率,记录和计算随着添加的铝盐溶液的量增多,混凝沉降收获效率,实验结果如图4所示。
由图4可知,回收的铝盐混凝剂在投加量较少时,仅仅20mg/g时(每1g藻液中加入混凝剂的量)便可达到90%的收获效率,而新配制的铝盐溶液,在加入量140mg/g的时候,收获率仅为75%,说明新配制的铝盐溶液需要更高的投加量才能达到比较好的收获效率。
从混凝成团及沉降速度来看,如图5所示的照片。在经过15分钟的沉降后,回收铝盐混凝剂加入的烧杯中出现了非常明显的分层,上清液基本呈透明无色,而新配制铝盐混凝剂加入的烧杯还没有明显分层,上层依然呈现藻液的绿色。
经本实验验证:经回收使用的铝盐混凝剂,其收获效率明显比新配制的铝盐溶液要好很多。造成这一现象的原因,可能是与混凝剂洗脱过程中,调节ph值时,使藻细胞的表面聚合物eps很大程度上与细胞分离,混入到最后回收的铝盐溶液中,起到了助凝剂的作用。
实施例4
参见图6,图6表示从混凝收获的微藻生物质中回收铝盐循环用于微藻收获,其循环次数与收获效率之间的关系图。
按照实施例3的方法,al3+在经过多次循环使用后,其混凝效果相对于使分析纯新配制的铝盐溶液来说,依然很好。由此可见,对混凝剂进行多次循环使用(按图1所示的混凝收获→洗脱→浓缩回收→),还能保持很好的混凝效果。
实施例5
图7表示不同浓度的eps(用toc定量)下的al3+的混凝收获效率。
实验条件:①eps获取。将培养获得的栅藻离心后得到藻泥,按液固比200ml/g的比例加入0.1mol/l的hcl,旋转搅拌15min后离心获得上清(即eps),然后将eps过0.45μm膜后,测toc,其浓度为6.89mg/l。②添加eps进行混凝收获。在快速搅拌下向9个取自同一培养池中的等量藻液样品中加入相同量的al3+(加入量为25mg/g)、不同量的eps和去离子水(为保证样品总体积相同),接着调节ph=6.2±0.2,慢速搅拌10min后静置5min取上清测干重,计算收获效率。
结果如图7所示。随着加入的eps的逐渐增加,混凝收获效率整体也是逐渐提高;在只加入al3+时,收获效率只有67%;而加入eps0.43mg/l时,相同浓度的al3+混凝剂,收获效率可以达到92.83%。可见,只需加入少量的eps便可达到很高的收获效率,说明eps可以当助凝剂来使用,同时验证了实施例3和例4中的实验结果。由此,还可以得到,添加eps后,即便在al3+浓度很低时(仅使用al3+混凝剂的情况下要达相当的混凝效果,其投入量至少达到100mg/g)依然可以达到90%以上的收获效率。因此,可大大节省混凝剂的用量。
在本实验例中,还附带比较了仅使用eps,和混合使用eps与al3+混凝剂作为混凝剂时,对微藻藻液的混凝沉降效果,如图8所示照片,可以直观地比较出来。
如图8所示的照片。向两个装有相同藻液的烧杯中,向右侧烧杯中加入浓度6.89mg/l的eps(加入量0.45mg/l)和al3+(加入量25mg/g),向左侧烧杯中加入等量等浓度eps,搅拌均匀。在经过20分钟的沉降后,右侧烧杯中出现了非常明显的分层,上清液基本呈透明无色;而左侧烧杯还没有明显分层,烧杯中呈现均匀的藻液绿色。由此可见,eps单独使用时,对藻液的混凝效果很不理想。
实施例6
图9表示不同浓度的eps(用toc定量)下的fe3+的混凝收获效率。
实验条件:按照实施例5中的eps获取的方法获得eps,toc定量测得eps的浓度为12.505mg/l,其中含糖量为4.6mg/ll,糖类约占到eps总量的37%左右,在不同的方法中,多糖可能会占到40%。
按照实施例5中的方法添加eps进行混凝收获。在快速搅拌下向5个取自同一培养池中的等量藻液样品中加入相同量的fe3+(加入量为12.38mg/g)、不同量的eps和去离子水(为保证样品总体积相同),接着调节ph=6.5±0.2,慢速搅拌10min后静置5min取上清测干重,计算收获效率。
结果如图9所示。随着加入eps的逐渐增加,混凝收获效率也逐渐提高;在只加入fe3+时,收获效率只有82%;而当再加入eps的量达到0.156mg/l时,相同量的混凝剂fe3+,收获效率为97.23%(图9第3个点)。可见,只需加入少量的eps便可使fe3+混凝剂的收获效率便可以达到95%以上。加和不加eps有显著的差别,且eps的用量很低就可起到作用。本实验例可证明eps可当助凝剂来使用,同时验证了实施例3和例4中的实验结果。将fe3+混凝剂与eps混合使用,不仅可以减少混凝剂的用量,降低收获成本,还可减少混凝收获获得的微藻生物质中混凝剂的含量,简化后续纯化难度。
在微藻生物质里面含有较高含量的无机混凝剂,会对提油产生影响,而即使制作鱼类饵料也会因此而不符合国家相关标准和行业标准,而eps的存在并不会对微藻生物质中化合物成分的提取和饵料的生产加工带来负面影响。因此,对于一些非直接食用的藻粉而言,按照本发明的混凝收获方法,在混凝剂含量本就很低的情况下,甚至可将混凝收获得到的藻泥直接转移到高附加值化合物的提取工艺中,节省藻粉处理成本和生产加工成本。
按照本发明的方法回收混凝收获微藻中的混凝剂,一方面不仅可以对混凝剂进行回收,减少混凝收获的成本;另一方面,还可以获得一种具有高混凝效率的混凝剂和混凝收获方法。
- 还没有人留言评论。精彩留言会获得点赞!