利用异养硝化-好氧反硝化的副球菌菌株处理含氮废水的方法与流程
本发明涉及微生物
技术领域:
,尤其涉及一种利用异养硝化-好氧反硝化的副球菌菌株处理含氮废水的方法。
背景技术:
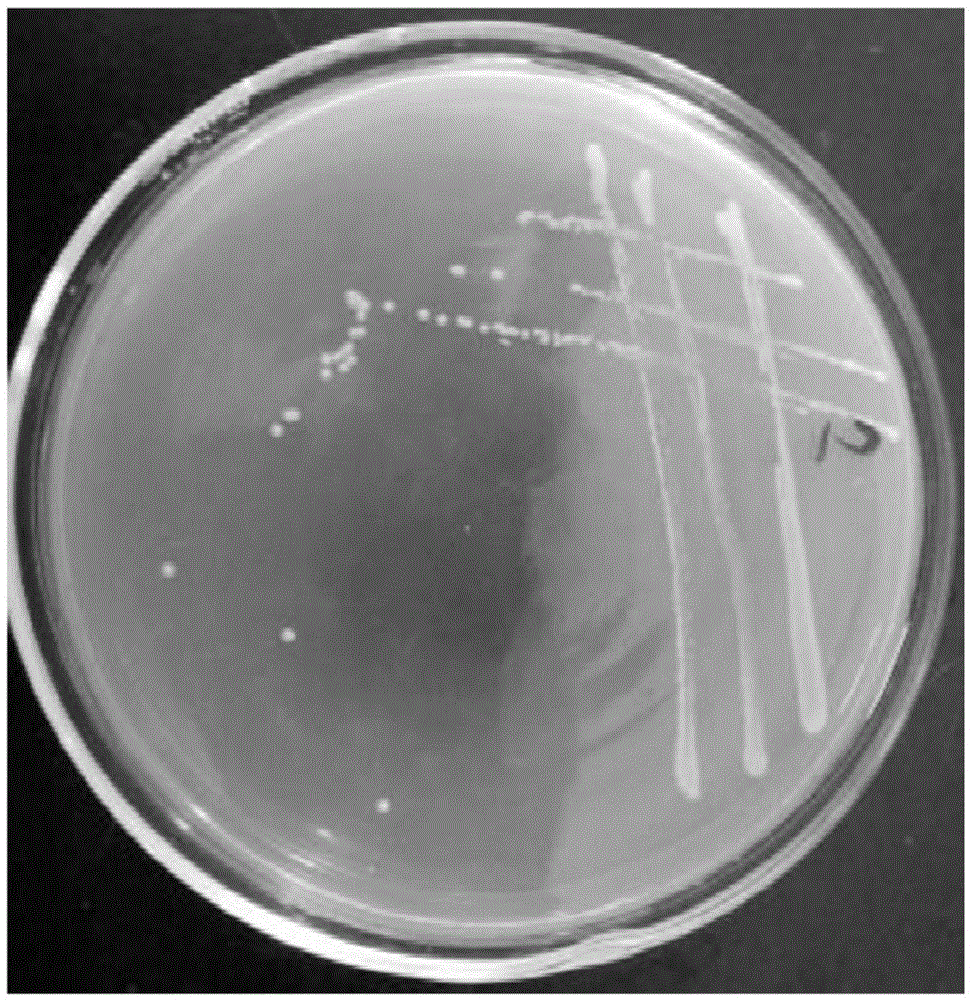
:随着社会的不断发展,人们的生活水平也在不断提高,为了满足人们的需求,养殖业也在不断的壮大,但养殖业的快速发展和高密度的养殖模式,导致严重的环境污染。养殖废水是具有典型的“三高特征”,codcr高达几千至几万mg·l-1,nh4+-n高达800~2200mg·l-1,ss超标数十倍,是高氮、高有机物负荷污染废水。未经处理的养殖废水中富含大量无机氮,包括:硝酸盐、亚硝酸盐及铵盐3种物质,是排入水体中的主要污染源之一。生物脱氮是在不同种类的微生物作用下,将有机氮和无机氮转化为氮气的过程。生物脱氮工艺具有成本低、操作简单、无二次污染和处理效果好等特点,广泛应用于养殖废水处理上。传统的生物脱氮工艺即自养硝化-厌氧反硝化工艺,一般过程包括氨化,硝化和反硝化3个过程,存在基建费用高、水力停留时间长、能耗大、抗冲击能力弱等不足。异养硝化-好氧反硝化菌能利用有机碳作为碳源进行硝化作用,并且能在有氧条件下进行反硝化作用,现已广泛应用于废水处理的新型脱氮工艺过程中。近年来,越来越多的异养硝化-好氧反硝化菌被发现,主要包括泛养硫球菌(thiosphaerapantoropha)、副球菌(pseudomonas)、不动杆菌(acinetobacter)等。这些细菌因具有生长快、活性高、增殖底物广泛、能同时进行异养硝化和好氧反硝化等优势,具有显著的工程应用价值。目前,异养硝化菌在养殖废水中的实际脱氮能力达不到理论值,这可能是由于实际养殖废水的成分更加复杂,如废水有机物过高,抑制了异氧硝化菌中的酶活性,甚至导致菌株死亡,致使其脱氮能力下降。因此,筛选出具有良好脱氮性能且能适应高浓度有机物废水环境的异养硝化-好氧反硝化菌,将其应用于高浓度有机物废水脱氮处理成为研究热点。技术实现要素:本发明要解决的技术问题是克服现有技术的不足,提供一种能在高浓度有机物存在的情况下利用异养硝化-好氧反硝化的副球菌菌株处理含氮废水的方法。为解决上述技术问题,本发明采用以下技术方案:一种利用异养硝化-好氧反硝化的副球菌菌株处理含氮废水的方法,所述含氮废水中含有有机酸钠,所述含氮废水的c/n比值为8~150,所述方法包括以下步骤:将异养硝化-好氧反硝化的副球菌种子液接种于含氮废水中,在温度为25℃~40℃,转速为90rpm~180rpm的条件下振荡反应,完成对含氮废水的处理;所述菌株为副球菌lj2(paracoccusversutuslj2),保藏于广东省微生物菌种保藏中心,保藏时间为2018年3月21日,保藏编号为gdmccno:60338。在其中一个实施例中,所述含氮废水含nh4+、no3-和no2-中的一种或多种。在其中一个实施例中,所述含氮废水为含nh4+废水时,所述含nh4+废水的c/n比值为8~150,所述nh4+的浓度为50mg·l-1~400mg·l-1。在其中一个实施例中,所述含氮废水为含no3-废水时,所述含no3-废水的c/n比值为15~120,所述no3-的浓度为50mg·l-1~300mg·l-1。在其中一个实施例中,所述含氮废水为含no2-废水时,所述含no3-废水的c/n比值为15~120,所述no2-的浓度为50mg·l-1~200mg·l-1。在其中一个实施例中,所述有机酸钠为琥珀酸钠和/或乙酸钠。在其中一个实施例中,所述异养硝化-好氧反硝化的副球菌种子液通过以下方法制得:将副球菌菌株lj2接种到lb培养基中,在温度为25~35℃、转速为100~180rpm下振荡培养至对数期,所得菌悬液离心去除上清液,洗涤后加无菌水,得到假单胞菌种子液。在其中一个实施例中,所述异养硝化-好氧反硝化的副球菌种子液的接种量为3%~15%。在其中一个实施例中,所述lb培养基的成分为:胰蛋白胨10g·l-1,酵母浸膏5g·l-1,nacl10g·l-1,ph7.0。在其中一个实施例中,加无菌水至菌液od600为0.6~0.8。与现有技术相比,本发明的优点在于:本发明利用副球菌lj2经培养后的种子液处理含氮废水,本发明的副球菌lj2(paracoccusversutuslj2),具有极高的耐受高浓度有机物的能力,在高有机负荷条件下也具有极佳的脱氨氮、硝酸盐氮及亚硝酸盐氮的能力;并且在极宽c/n比范围内仍具有稳定的脱氨氮、硝酸盐氮及亚硝酸盐氮的能力。具体地,异养硝化过程中,以琥珀酸钠为碳源,在nh4+-n浓度为50mg·l-1,c/n高达150的废水中,副球菌lj2的nh4+-n去除率能达到95.69%;c/n在8~150的范围内,lj2的nh4+-n去除率均能达到85%以上。好氧反硝化过程中,在no3--n浓度为50mg·l-1,c/n高达120的废水中,副球菌lj2的no3--n的去除率将近100%,且tn去除率达91.25%;c/n在15~120的范围内,lj2的no3--n去除率均将近100%,tn去除率均将近90%。好氧亚硝化过程中,在no2--n浓度为50mg·l-1,c/n高达120的废水中,no2--n的去除率将近100%,且tn去除率将近90%;c/n在15~120的范围内,lj2的no2--n去除率均将近100%,tn去除率均将近90%。并且,该菌株还具有耐受高浓度氨氮、高浓度硝酸盐氮及高浓度亚硝酸盐氮的能力,该菌株耐受最大氨氮浓度为400mg·l-1,耐受最大硝酸盐氮浓度为300mg·l-1,耐受的最佳亚硝酸盐氮浓度为200mg·l-1。综上,本发明利用副球菌lj2对高浓度有机物含氮废水进行生物脱氮处理,具有巨大的应用前景。副球菌lj2(paracoccusversutuslj2),保藏于广东省微生物菌种保藏中心(简称:gdmcc),地址为广州市先烈中路100号大院59号楼5楼,广东省微生物研究所,保藏编号为gdmccno:60338,保藏时间为2018年3月21日。附图说明图1为本发明所采用的副球菌lj2的菌落形态图。图2为本发明所采用的副球菌lj2的透射电镜图。图3为本发明所采用的副球菌lj2的16srdna扩增电泳图。图4为本发明所采用的副球菌lj2的系统进化树。图5为本发明所采用的副球菌lj2的napa基因pcr扩增电泳图。图6为本发明所采用的副球菌lj2的nosz基因pcr扩增电泳图。图7为本发明所采用的副球菌lj2的异养硝化性能变化规律曲线。图8为不同c/n对本发明所采用的副球菌lj2的异养硝化脱氮性能的影响曲线。图9为不同氨氮浓度对本发明所采用的副球菌lj2的异养硝化脱氮性能的影响曲线。图10为不同碳源对本发明所采用的副球菌lj2的异养硝化脱氮性能的影响曲线。图11为不同ph值对本发明所采用的副球菌lj2的异养硝化脱氮性能的影响曲线。图12为不同温度对本发明所采用的副球菌lj2的异养硝化脱氮性能的影响曲线。图13为不同接种量对本发明所采用的副球菌lj2的异养硝化脱氮性能的影响曲线。图14为不同转速对本发明所采用的副球菌lj2的异养硝化脱氮的影响曲线。图15为本发明所采用的副球菌lj2的好氧反硝化性能变化规律曲线。图16为不同c/n对本发明所采用的副球菌lj2的好氧反硝化性能的影响曲线。图17为不同硝酸盐氮浓度对本发明所采用的副球菌lj2的好氧反硝化脱氮性能的影响曲线。图18为本发明所采用的副球菌lj2的好氧亚硝化性能变化规律曲线。图19为不同c/n对本发明所采用的副球菌lj2的好氧亚硝化性能的影响曲线。图20为不同亚硝酸盐氮浓度对本发明所采用的副球菌lj2的好氧亚硝化脱氮性能的影响曲线。具体实施方式以下结合具体优选的实施例对本发明作进一步描述,但并不因此而限制本发明的保护范围。以下实施例所采用的异养硝化-好氧反硝化的副球菌菌株,其保藏于广东省微生物菌种保藏中心(简称:gdmcc),保藏编号为gdmccno:60338。该副球菌gdmccno:60338被命名为副球菌lj2(paracoccusversutuslj2)。1)菌种分离筛选上述本实施例的副球菌lj2主要通过以下方法筛选得到:将从福建省龙岩市龙津污水厂采集的活性污泥100ml活性污泥加入到200ml反硝化富集培养基中,培养基中加入无菌玻璃珠。30℃,150rpm·min-1摇床震荡,连续培养5天,将以上细菌悬液以10%的接种量转接于新鲜的dm培养基中,以这种培养方式重复培养两次,得到富集的细菌悬液。采用10倍稀释法,将0.2ml的富集细菌悬液涂布于dm琼脂培养基中(1.5%的琼脂),于30℃培养。挑选具有明显不同特征的细菌菌落,进行平板划线,获得单菌落。纯化的菌落再重新接种于新鲜的琼脂培养基中。将分离出的菌株培养于kno3为唯一氮源的dm初筛培养基中进行初筛,将能存活于dm初筛培养基的菌株接种到lb斜面培养基中-4℃保存。然后,测定初筛菌株nh4+-n以及no3--n去除率,得到脱氮性能较好的菌株lj2再进行研究。2)菌种鉴定上述本实施例的副球菌lj2菌种鉴定过程及结果如下:2.1)形态学鉴定对微生物形态结构的观察采用肉眼观察法、光学显微镜观察法及投射电子显微镜观察法。菌株lj2在牛肉膏蛋白胨培养基上的菌落形态如图1所示:菌落为乳白色,边缘整齐,圆形微微隆起,表面光滑湿润,不透明。lj-2革兰氏染色鉴定为革兰氏阴性菌。lj2透射电镜图如图2所示:菌体呈短杆状,无荚膜,无芽孢,无鞭毛,lj2横直径约为0.49μm,长度约为1.07μm。2.2)生理生化鉴定细菌详细分类的典型做法是以生理生化试验的结果为基础的,本实验中菌株的生理生化特性参照文献及《伯杰明细菌鉴定手册》进行实验。测定菌株lj2进行生理生化特性,结果见表3:lj2的糖发酵实验均为阴性,不产酸不产气;接触酶与氧化酶实验均为阳性,初步判断lj2与副球菌(paracoccusversutus)的生理生化特性相符:表3菌株lj2生理生化实验特性实验名称实验结果实验名称实验结果氧化酶+v.p-接触酶+油脂水解+葡萄糖氧化发酵-乙酸氧化-乳糖氧化发酵-石蕊牛奶产酸尿素水解-吲哚实验+淀粉水解-氨基酸脱羧酶-甲基红-硝酸盐还原-注:表中“+”代表阳性,有此项反应;“-”代表阴性,无此项反应。在糖发酵实验中,“o+”表示产酸产气;“+”表示产酸不产气;“-”表示不产酸不产气。2.3)分子生物学鉴定本实验中菌株dna按ezup柱式细菌基因组dna提取试剂盒的操作步骤提取细菌基因组dna。2.3.1)16srrna基因的扩增和测序细菌中包括有三种核糖体rna,分别为5srrna、16srrna、23srrna。16srrna基因的相对分子量适中,序列分析的重现性极高,16srrna基因是细菌的系统分类研究中最常用的方法之一。现在普遍采用16srrna基因作为序列分析对象鉴定细菌的种属。本实验中采用通用引物27f和1492r对菌株的16srrna进行pcr扩增,纯化后进行测序。16srrna基因的pcr反应体系见表4。表416srrna基因的pcr反应体系10×pcrbuffer2.5μldntp0.5μlf0.5μlr0.5μltaq酶0.25μlddh2o20.75μltotal25μl16srrna基因pcr扩增结果如图3,片段长度1400bp左右,条带扩增位置正确。测序分析结果如图4所示:菌株lj-2与副球菌(paracoccusvereutus)的相似度为99%,因此判定lj2为一株副球菌(paracoccusversutus),该菌株命名为paracoccusversutuslj2。2.3.2)功能基因鉴定好氧反硝化过程中,有氧条件下,周质硝酸还原酶基因(nap基因)会优先表达,no3--n无需通过细胞膜就可以到达周质硝酸还原酶所在的活性区域,周质硝酸还原酶能够直接将no3--n还原生成no2--n;氧化亚氮还原酶(nosz)能够将no2--n还原生成n2,在细菌的反硝化过程中也起着关键作用。所以为了进一步验证菌株的好氧反硝化功能,本实验对菌株周质硝酸还原酶基因(napa,片段长度为800bp~900bp)和氧化亚氮还原酶基因(nosz,片段长度约为300bp)进行pcr扩增,pcr所利用的引物对分别为nap1/nap2(nap1:5’-tctggaccatgg-gcttcaacca-3’,nap2:5’-acgacgaccggccagcgcag-3’)和nosz-f/nosz-r(nosz-f:5’-cgytgttcmtcgacagccag-3’,nosz-r:5’-cgsaccttsttgccstygcg-3’)。16srrna、napa基因、nosz基因的pcr反应程序见表4。表416srrna、napa基因、nosz基因的pcr反应程序lj2菌株基因扩增片段电泳结果如图5所示:得到片段大小为700bp~1000bp左右的特异条带,大小与预测片段大小相符,因此可初步判断,该菌含有napa基因,这表明菌株lj2具有将no3--n转化为no2--n的功能。利用引物nos1/nos2对lj2菌株基因进行扩增,扩增片段电泳结果如图6所示:得到片段大小为250bp~500bp左右的特异条带,大小与预测大小相符。因此也可判断,该菌含有nosz基因,这表明了菌株lj2具有将no2--n转化为n2的功能。本实施例的副球菌lj2具有良好的异养硝化-好氧反硝化性能,而且具有耐高碳氮比的性能,可用于高c/n废水中的氨氮、硝酸盐氮及亚硝酸盐氮的脱氮处理。应用时,先将副球菌lj2制成副球菌lj2种子液,再进行废水脱氮处理,该副球菌lj2种子液采用以下方式制得:将菌株接入lb液体培养基中,于30℃的恒温摇床中培养48小时,再将lb培养基中的的菌液倒入离心管中,4000rpm离心10min,收集菌体,菌体用无菌水清洗三遍,最后用无菌水调节od600至0.6~0.8的菌悬液,制成种子液。上述用到的培养基配方如下:反硝化富集培养基(dm)(g·l-1):na2hpo4·7h2o7.9,kh2po41.5,nh4cl0.3,mgso4·7h2o0.1,(ch2coona)2·6h2o4.7,kno30.3,微量元素溶液2ml·l-1。dm初筛培养基(g·l-1):na2hpo4·7h2o7.91,kh2po41.5,mgso4·7h2o0.1,(ch2coona)2·6h2o4.7,kno30.3,微量元素溶液2ml·l-1微量元素溶液(g·l-1):edta50,znso42.2,cacl25.5,mncl2·4h2o5.1,feso4·7h2o5.0,(nh4)6mo7o24·4h2o1.1,cuso4·5h2o1.6,coci2·6h2o1.6。异养硝化培养基(g·l-1):(nh4)2so40.24,(ch2coona)2·6h2o2.25,维氏盐溶液50ml·l-1。好氧反硝化培养基(g·l-1):kno30.36,(ch2coona)2·6h2o2.25,维氏盐溶液50ml·l-1。好氧亚硝化培养基(g·l-1):nano20.25,(ch2coona)2·6h2o2.25,维氏盐溶液50ml·l-1。维氏盐溶液(g·l-1):k2hpo45.0,mgso4·7h2o2.5,nacl2.5,mnso4·4h2o0.05,feso4·7h2o0.05。lb液体培养基(g·l-1):胰蛋白胨10,酵母浸膏5,nacl10,ph值为7.0。注:所有液体培养基均在121℃条件下灭菌20min后备用,固体培养基在以上液体培养基中添加1.5~2%琼脂。实施例中用到的实验仪器如表1所示:表1实验仪器设备名称型号生产厂家生化培养箱shp-250型上海森信实验仪器有限公司紫外分光光度计uv-1800上海美谱达仪器有限公司清洁工作台sw-cj-1f苏州安泰空气技术有限公司立式自动高压灭菌锅hve-50厦门柏嘉生物科技有限公司空气培养摇床sph-100bshipingoscillator超微量分光光度计multiskan-go赛默飞世尔科技(中国)有限公司梯度pcr仪multiskan-go赛默飞世尔科技(中国)有限公司大容量高速冷冻离心机st16r赛默飞世尔科技(中国)有限公司双目显微镜ba210麦克奥迪实业集团有限公司实施例中的水质检测分析项目及方法如表2所示:表2水质检测分析的项目及方法实施例1:一种利用上述异养硝化-好氧反硝化的副球菌菌株lj2种子液处理氨氮废水的方法,包括以下步骤:将菌株的种子液以3%接入异养硝化培养基中,150rpm,30℃摇床培养,培养48小时,每隔6小时测定一次培养基nh4+-n、no3--n、no2--n和cod含量及ph值和od600,并绘制以上指标的曲线变化图。菌株lj2以nh4+-n为唯一氮源,培养48h的生长情况及异养硝化脱氮性能变化规律如图7所示:0~12h,生长曲线变化较大,为lj2指数生长期;12h后,生长曲线趋于平缓,lj2进入生长稳定期;42h,生长曲线达到顶峰,od600最大值0.28;48h,od600呈下降趋势,lj2进入生长衰亡期。ph值是随培养时间呈逐渐递增趋势,从7.05提高到8.50,这说明菌株lj2在生长过程中产碱。菌株lj2在0~6h,nh4+-n开始降解,no2--n开始积累;12h,nh4+-n去除率达到100%,no2--n积累量约为2.25mg·l-1;24h,no2--n积累量达到2.87mg·l-1;36h,no2--n完全去除;42h,cod去除率达到最大90.42%;整个异养硝化过程中,均无no3--n的积累。传统硝化反应的概念指出通过细菌的硝化作用nh4+-n应该转变为no3--n或no2--n。本实验中,no3--n无积累以及no2--n少量积累后又被去除,可说明lj2能够同时发生硝化和反硝化反应,硝化过程中产生的中间产物可作为反硝化过程的底物加以利用。综上所述,菌株lj2可利用nh4+-n生长并具有脱氮性能,氮去除率可达到100%,说明lj2具有优异的异养硝化能力。实施例2:本实施例固定氮源硫酸铵的含量,以琥珀酸钠为碳源,通过调整碳源的含量来改变碳氮比。c/n设定为8、10、15、20、25、30、35、40、50、60、100和150,每组实验分别设置3个重复,异养硝化培养基其他成分与培养条件不变,150rpm,30℃摇床培养,培养24h后,测定不同培养基中的od600、nh4+-n和tn含量。c/n对lj2异养硝化性能的影响如图8所示:c/n在8~150的范围内,lj2的nh4+-n去除率均能达到85%以上。其中c/n为35时,lj2的od600最大达到0.953,nh4+-n去除率为92.83%,tn去除率为80.87%。c/n增加到40时,od600下降到0.843,nh4+-n去除率下降为91.03%,tn去除率也随之下降为78.35%,这说明随着c/n升高,lj2的脱氮能力下降。但c/n再提高至60时,od600再次升高为0.904,nh4+-n去除率可达到92.76%,tn去除率达到85.16%。在c/n为100、150时,od600分别降低到0.796、0.744,nh4+-n去除率为96.43%、95.69%,tn去除率为78.26%、67.30%,综上所述,lj2生长和脱氮适应的c/n范围较宽。异养硝化-好氧反硝化菌通常是以有机物作为碳源和能源,但一般来说,过高的c/n会抑制菌株的生长和硝化反应。一般异养硝化-好氧反硝化菌脱氮的最适c/n为5-8,较少达到20以上。,而菌株lj2适应的c/n范围更大,当nh4+-n浓度为50mg·l-1,c/n=150时,nh4+-n去除率仍可达到95.69%,这说明大量的碳源仍能使lj2生长以及保持良好的脱氮性能,这说明lj2在高有机负荷下也具有较强的nh4+-n去除能力,所以lj2能够更好的应用于高有机负荷废水的处理中。实施例3:nh4+-n作为氨氮氧化细菌生长过程中的唯一氮源,基质中的nh4+-n的浓度对异养硝化细菌的生长至关重要。nh4+-n浓度过低,不能满足菌株生长的需要,浓度过高,又会导致对细胞的生长产生毒害作用,同时会通过底物抑制硝化反应中关键酶的活性,从而影响异养硝化细菌的硝化活性。本实施例研究了不同的底物浓度对菌株异养硝化性能的影响。基于改良异养硝化培养基,固定c/n为60,将培养基初始的氮浓度分别设置为50mg·l-1、100mg·l-1、200mg·l-1、300mg·l-1、400mg·l-1。按最佳接种量接入不同氮浓度培养基中,每组设置3个重复,置于150rpm,30℃,培养7天,每天测定od600,nh4+-n和tn含量。不同nh4+-n浓度对lj2异养硝化脱氮性能的影响结果如图9所示:经过7天培养,当初始nh4+-n浓度为50mg·l-1时,nh4+-n去除率达到100%,od600为1.011;当初始nh4+-n浓度为100mg·l-1时,nh4+-n去除率也达到了100%,菌体生长良好,od600为1.065;但nh4+-n浓度高于100mg·l-1后,随着初始nh4+-n浓度的提高,菌株lj2的nh4+-n去除率随之下降,当初始nh4+-n浓度为200mg·l-1时,nh4+-n的降解能力下降为93.76%,但菌体生长情况最优,od600值达到1.2;当初始nh4+-n浓度为300mg·l-1时,lj2的od600值仅为0.384,但nh4+-n去除率无明显下降;当初始nh4+-n浓度为400mg·l-1时,od600值降低至0.246,nh4+-n去除率降低至11.02%。这说明随着nh4+-n浓度的提高,菌株lj2生长和脱氮性能受到抑制。lj2在不同nh4+-n浓度培养7天之后,均无no3--n和no2--n的积累,说明lj2具有较好的反硝化性能。颜薇芝等分离的不动杆菌acinetobacter.spyn3,随着初始nh4+-n浓度的提高,nh4+-n的去除能力越低,初始nh4+-n浓度为200mg·l-1时,nh4+-n去除率仅为2%;恶臭假单胞菌pseudomonasputidaly1在初始nh4+-n浓度为50mg·l-1,nh4+-n去除率最高达到64%,随着nh4+-n浓度的升高,nh4+-n去除率逐渐下降;一株耐受高浓度氨氮的贪铜菌cupriavidussp.s1在初始nh4+-n浓度高达200mg·l-1时,nh4+-n去除率为94.98%。与上述菌株nh4+-n浓度耐受性相比,lj2可耐受nh4+-n浓度达400mg·l-1,且初始nh4+-n浓度300mg·l-1时,仍nh4+-n去除率仍可达90%以上,说明lj2具有较好的氨氮耐受能力。据报道,某些种属的异养硝化-好氧反硝化菌能耐受更高浓度的nh4+-n,但其nh4+-n去除率较低,且所能耐受有机物浓度低于lj2。例如:具有耐受高nh4+-n能力的acinetobactersp.y1当c/n=14,nh4+-n浓度为1600mg·l-1时,nh4+-n去除率仅为21.3%;不动杆菌acinetobactersq2在c/n=12,nh4+-n浓度为1400mg·l-1时,od600值可达2.635,nh4+-n去除率仅为38.6%。上述的这两株耐受高nh4+-n浓度的菌株均需要较低c/n条件下,即有机物浓度相对较低情况下,表现较低的nh4+-n去除率。与其相比,lj2耐受的c/n高达60~150,是y1和sq2的四十倍左右。因此,lj2在高负荷有机物的条件下,仍具有良好的nh4+-n耐受能力和脱氮效果,其在高浓度有机物含氮废水处理中具有潜在的应用价值。实施例4:(1)lj2异养硝化性能影响因素(1.1)碳源对菌株异养硝化性能的影响根据微生物对不同碳源的利用情况,可将微生物分为两大类,自养型微生物和异养型微生物。异养型是指微生物以环境中的有机物作为碳素营养的一种异养类型。异养硝化细菌的氨氮去除能力受碳源种类的影响。因此本实验研究了菌株对不同碳源的利用情况。本实验选用琥珀酸钠、乙酸钠、柠檬酸钠、乙醇、葡萄糖、蔗糖等碳源作为实验组,碳酸氢钠与无碳作为对照组,考察所选碳源对菌株异养硝化性能的影响。对异养硝化培养基中的碳源进行等摩尔替换,其他成分不变,配制多种培养基。将种子液按3%的接种量分别接种于装有100ml不同碳源培养基的250ml锥形瓶内(每一种碳源做3个重复)。接种后的培养基置于150rpm、30℃的摇床中培养24小时后,测定不同培养基中的od600、nh4+-n和tn含量。碳源对lj2异养硝化性能的影响如图10所示:菌株lj2在无碳源培养基中,nh4+-n去除率为0,生物量不增加,这说明lj2的生长需要碳源;添加所选择的不同碳源的培养基中,菌株lj2均能生长,但lj2对不同碳源的利用情况不同,以碳酸氢钠为碳源时,lj2的od600值为0.229,nh4+-n的去除率为40.28%,tn去除率为30.34%,这说明lj2可利用无机碳源生长,但脱氮性能较弱。以琥珀酸钠为碳源的培养基时,lj2的od600值最大为0.34,lj2对nh4+-n和tn的去除率最大,分别达到98.50%和75.82%。因此,琥珀酸钠为lj2异养硝化脱氮过程中的最佳碳源。(1.2)ph对菌株异养硝化性能的影响溶液的酸碱性是菌体生长的重要因素之一。酸碱性通过菌体中酶的作用,而对菌体的生长性能及硝化性能产生影响。微生物可在一个较宽的ph范围内进行生长,但都有一个最适合的ph。因此,本实验研究了培养基中不同初始ph值对菌株的生长性能及氨氮降解能力的影响。通过加入低浓度氢氧化钠或盐酸溶液,将培养基的初始ph值依次调整为6.5、7、7.5、8、8.5、9,每组实验分别设置3个重复,150rpm,30℃摇床培养,24小时后测定菌株的od600、nh4+-n和tn含量。ph对lj2的异养硝化性能影响如图11所示:不同ph值对lj2的nh4+-n去除能力影响不大,但对tn的去除能力有较大影响。ph值6.5时,lj2的od600为0.867,nh4+-n去除率为94.77%,tn去除率只有74.84%,这可能是由于培养基中的nh4+-n可能被转化为no2--n或者是no3--n;ph值为7~8的范围内,lj2的od600值分别为0.869、0.863、0.85,nh4+-n去除率分别为95.16%、92.24%、93.99%,tn去除率分别为92.02%、93.27%、90.60%。在ph值大于8之后,lj2的tn去除率明显下降。因此,结合lj2的生长情况、nh4+-n去除率和tn去除率,培养基初始ph值7~8合适,7.5最佳。(1.3)温度对菌株异养硝化性能的影响温度是微生物重要的生存因子适宜的温度会使微生物的生长和代谢速率达到最大值。生物体内的酶在适宜温度条件下,活性最强,菌内的酶活越强,生长性能和氨氮降解能力也越强。本实验研究了不同培养温度条件对菌株的生长性能及氨氮降解能力的影响。将种子液以3%的接种量接种于最佳碳源,硫酸铵为氮源,最佳碳氮比,培养基最佳初始ph值的改良异养硝化培养基中。接种后的培养基分别置于25℃、30℃、35℃、40℃,每组实验分别设置3个重复,150rpm的摇床中培养24小时后,测定菌株的od600、nh4+-n和tn含量。不同温度对lj2异养硝化脱氮性能的影响如图12所示:培养温度25℃时,lj2的od600为0.628,nh4+-n去除率为99.51%,tn去除率为73.76%;温度30℃时,lj2的od600为0.875,nh4+-n去除率可达95.15%,tn去除率可达92.05%;温度高于30℃,tn去除率明显下降。综上所述,lj2的生长和脱氮的最佳温度为30℃。(1.4)接种量对菌株异养硝化性能的影响接种量不足达不到脱氨氮的作用,适量的接种量对提高脱氮效果及实际应用有重要作用。而且在一定范围内,适当的增加菌株的接种量,可以缩短甚至能消除菌株生长的延滞期。因此,本实验研究了菌株接种量对于菌株的生长性能及氨氮降解能力的影响。分别按接种量3%、5%、7%、10%、15%接种于改良的异养硝化培养基中。培养条件为150rpm、30℃,每组实验分别设置3个重复,培养24小时后,测定od600、nh4+-n和tn含量。接种量对lj2异养硝化性能的影响如图13所示:接种量为3%、5%、7%、10%、15%时,lj2的od600值分别为0.795、0.837、0.837、0.865、0.878,ph值分别为8.49、8.49、8.47、8.47、8.47,nh4+-n去除率分别98%、98%、96%、96%,tn去除率分别为65%、64%、55%、61%、61%。以上结果表明:不同接种量对lj2的异养硝化脱氮能力的影响不显著,即脱氮性能并没有随着接种量的提高而升高。接种量过大会使菌株过快的消耗培养基中的营养物质,使得生长周期变短,且从经济方面考虑,接种量高投入的成本也高。因此,lj2异养硝化接种量可选择3%。(1.5)溶解氧对菌株异养硝化性能的影响不同的溶解氧浓度会对微生物的硝化作用产生显著的影响,甚至可控制硝化代谢产物。研究表明,转速的变化可以表征培养液中溶解氧的变化,因此可以通过调节摇床转速来控制培养基中的溶解氧浓度。本实验考察了转速对菌株生长性能及氨氮降解能力的影响。按最佳接种量接种于改良的异养硝化培养基中。培养条件分别为0rpm、90rpm、150rpm、180rpm,30℃,每组实验分别设置3个重复,培养24小时后,测定od600、nh4+-n和tn含量。随着转速的增加溶解氧(do)会增大,能够促进好氧菌株的生长。转速对lj2异养硝化脱氮性能的影响结果如图14所示:在转速为0时,即静止培养,nh4+-n和tn去除率分别为40.26%和32.23%,说明培养基中的通气量不足,溶解氧不足,抑制了菌株的生长和脱氮性能;转速为90rpm~150rpm内,随转速的增加,菌株lj2的od600、nh4+-n和tn去除率逐渐升高,其中150rpm时,nh4+-n去除率达到100%,tn去除率达97.59%;当转速继续升高至180rpm时,菌株lj2的od600和tn去除率分别下降为0.854和95.14%。因此,lj2异养硝化脱氮的转速选择150rpm。说明随着转速提高,do增大,能够促进lj2的生长和脱氮性能,转速提高到一定程度,过量的do反而会抑制lj2的生长和脱氮性能。实施例5:一种利用上述异养硝化-好氧反硝化的副球菌菌株lj2种子液处理硝酸盐氮废水的方法,包括以下步骤:将菌株lj2的种子液以3%接入好氧反硝化培养基中,150rpm,30℃摇床培养,培养48小时,每隔6小时测定一次培养基nh4+-n、no3--n、no2--n和cod含量及ph值和od600,并绘制以上指标的曲线变化图。菌株lj2以no3--n为唯一氮源,培养48h的生长情况及好氧反硝化脱氮性能变化规律如图15所示:0~12h,生长曲线变化幅度较大,lj2进入生长指数期;12h,生长曲线趋于平缓,lj2进入生长稳定期;30h,od600达到最大0.329;36h,od600呈下降趋势,lj2进入生长衰亡期。ph值是随培养时间呈逐渐递增趋势,从7.38提高到8.49,这说明菌株lj2在生长过程中产碱。0~6h,no3--n开始去除,无nh4+-n的积累,有0.02mg·l-1的no2--n积累;18h,cod去除率最大达到83.04%;24h,no3--n去除率最大为93.20%;30h,nh4+-n积累量2.82mg·l-1;48h,no3--n的去除率下降至78.40%,nh4+-n的积累量为0.77mg·l-1,no2--n的积累量为0.08mg·l-1。以上结果表明:菌株lj2可利用no3--n生长及脱氮,lj2进入生长衰亡期时,no3--n去除率也随之下降,lj2的好氧反硝化脱氮能力与菌株的生长密切相关。综上所述,菌株lj2可利用no3--n生长并具有脱氮性能,氮去除率可达到93.20%,说明lj2具有优异的好氧反硝化能力。实施例6:采用好氧反硝化培养基,no3--n浓度均固定为50mg·l-1,调整碳浓度,使得c/n分别为8、15、30、60、120。将菌株种子液按3%接种量接入到不同c/n培养基中,置于150rpm,30℃摇床培养,24小时后测定od600,no3--n、no2--n和tn含量。c/n也是影响反硝化脱氮的重要因素之一。c/n过低,会导致碳源不足,影响菌株的生长;当c/n过高时,过量的碳源不会被微生物利用,而且过高的c/n会抑制菌株的生长和硝化反应。c/n对lj2好氧反硝化脱氮性能的影响结果如图16所示:在c/n为60时,lj2的od600值最大为0.818;当c/n为15、30、60时,no3--n及tn去除率均达到100%;当c/n升高到120时,tn去除率下降到91.25%。因此,c/n为60时,lj2生长情况和好氧反硝化脱氮性能最佳,这与lj-2的异养硝化最佳c/n一致。一般好氧反硝化菌脱氮的最适c/n为5-8,较少达到20以上。与大部分好氧反硝化菌相比,菌株lj2具有耐受较高c/n的能力,可为处理高c/n有机污染的提供新的菌种资源。实施例7:采用好氧反硝化培养基,c/n固定,将培养基初始no3--n调至50mg·l-1、100mg·l-1、150mg·l-1、200mg·l-1、250mg·l-1、300mg·l-1。将菌株种子液按3%接种量接入到不同氮浓度培养基中,置于150rpm,30℃摇床培养,培养24小时后,测定od600,no3--n、no2--n和tn含量。不同no3--n浓度对lj2好氧反硝化脱氮性能的影响结果如图17所示:当no3--n浓度100mg·l-1时,lj2的od600为1.083,no3--n及tn去除率最高,分别为99.76%和81.07%;随着no3--n浓度的升高,no3--n及tn去除率降低;在no3--n浓度为200mg·l-1时,no3--n去除率为70.84%;在no3--n浓度提高至300mg·l-1时,no3--n去除率为7.83%,lj2仍具有脱氮能力。宋宇杰分离的一株能适应高浓度no3--n的不动杆菌acinetobactersp.y1,当初始no3--n浓度为50mg·l-1,no3--n去除率为100%;当no3--n浓度为100mg·l-1,no3--n去除率为84.4%;当no3--n浓度为200mg·l-1,no3--n去除率为65.3%。与y1相比,lj2在初始no3--n为200mg·l-1时,no3--n去除率更高,lj2比y1更加适应高浓度no3--n。有研究表明,某些好氧反硝化菌对no3-n的耐受高于lj2,但其能耐受的c/n范围远远小于lj2,例如:假单胞菌pseudomonasstutzeristrainad-2在硝态氮浓度为100~1000mg·l-1的范围内,no3--n去除率可达99%,且无no2--n的积累,但ad-2所能耐受的c/n仅为7,远小于lj2的c/n60。综上所述,在高浓度有机物的条件下,lj2具有良好的no3--n耐受能力和脱氮效果,优于目前报道的好氧反硝化菌株。实施例8:将菌株lj2的种子液以3%接入好氧亚硝化培养基中,150rpm,30℃摇床培养,培养48小时,每隔6小时测定一次培养基nh4+-n、no3--n、no2--n和cod含量及ph值和od600,并绘制以上指标的曲线变化图。菌株lj2以no2--n为唯一氮源,培养48h的生长情况及好氧亚硝化脱氮性能变化规律如图18所示:0~12h,od600值大幅上升,lj2进入指数生长期;12h,od600值最大达到0.275;18~36h,生长曲线趋于平缓,od600值无大幅度变化,lj2进入生长稳定期;42~48h,od600值下降,lj2进入生长衰亡期。ph值随培养时间呈逐渐递增趋势,从7.92提高到8.78,这说明菌株lj2在生长过程中产碱。0~6h,no2--n开始去除,no3--n积累量为0.28mg·l-1,无nh4+-n积累;12h,no3--n和nh4+-n均无积累,cod去除率最高为78.40%;24h,no3--n积累量0.28mg·l-1,nh4+-n积累量1.79mg·l-1;30h,no2--n去除率最高达到64.81%,nh4+-n的积累量最大达到4.10mg·l-1;36h,no2--n去除率下降为62.33%;42~48h,积累的no3--n和nh4+-n完全去除。综上所述,菌株lj2可利用no2--n生长并具有脱氮性能,氮去除率可达到64.81%,说明lj2具有好氧亚硝化能力。实施例9:采用好氧亚硝化培养基,no2--n浓度均固定为50mg·l-1,调整碳浓度,使得c/n分别为8、15、30、60、120。将菌株种子液按3%接种量接入到不同c/n培养基中,置于150rpm,30℃摇床培养,24小时后测定od600,no3--n、no2--n和tn含量。c/n也是影响反硝化脱氮的重要因素之一。c/n过低,会导致碳源不足,影响菌株的生长;当c/n过高时,过量的碳源不会被微生物利用,而且过高的c/n会抑制菌株的生长和硝化反应。c/n对好氧亚硝化脱氮性能的影响结果如图19所示:当c/n从15增加到30时,no2--n去除率从100%降低到95.08%,tn去除率从93.38%升高到100%;而c/n为60时,no2--n为99.87%,tn去除率为98.54%;当c/n升高到120时,tn去除率降低到88.91%。因此,c/n为60时,lj-2的好氧亚硝化性能最佳,这与lj2的异养硝化和好氧反硝化最优c/n一致。一般好氧反硝化菌脱氮的最适c/n为5-8,较少达到20以上。与大部分好氧反硝化菌相比,菌株lj2具有耐受较高c/n的能力,可为处理高c/n有机污染的提供新的菌种资源。实施例10:采用好氧亚硝化培养基,c/n固定,将培养基no2--n浓度调至50mg·l-1、100mg·l-1、150mg·l-1、200mg·l-1、250mg·l-1、300mg·l-1。将菌株种子液按3%接种量接入到不同氮浓度培养基中,置于150rpm,30℃摇床培养,培养24小时后,测定od600,no2--n、no3--n和tn含量。不同no2--n浓度对lj2好氧亚硝化脱氮性能的影响如图20所示:no2--n浓度50mg·l-1时,od600为0.796,no2--n及tn去除率最高,分别为100%与76.04%;随着no2--n浓度的提高,no2--n及tn去除率降低,当no2--n浓度提高到100mg·l-1时,no2--n去除率为68.93%;no2--n浓度为200mg·l-1时,lj2仍能生长,no2--n去除率仍有9.06%,芽孢杆菌bacilluscoagulansyx-6当初始no2--n浓度为20mg·l-1时,no2--n去除率接近100%,当no2--n浓度提高到100mg·l-1,no2--n去除率仅为20%。因此,lj2比yx-6耐受更高浓度的no2--n。据报道,当亚硝态氮浓度为50mg·l-1、100mg·l-1、200mg·l-1时,acinetobactersp.y1均能够生长,且no2--n的去除率均可达到60%以上,但y1所能耐受的c/n为14,远低于lj2的最佳c/n60。因此,高浓度有机物的条件下,lj2具有良好的no2--n耐受能力和脱氮效果,优于目前报道的大部分好氧反硝化菌株。以上所述,仅是本申请的较佳实施例,并非对本申请做任何形式的限制,虽然本申请以较佳实施例揭示如上,然而并非用以限制本申请,任何熟悉本专业的技术人员,在不脱离本申请技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1