一种锶污染土壤的修复方法
1.本技术涉及生态修复领域,具体为一种锶污染土壤的修复方法。
背景技术:
2.大气层核试验的散落物可造成土壤的放射性污染。在放射性散落物中,
90
sr的半衰期较长,易被土壤吸附,滞留时间较长。锶会污染食物和水体,通过食物链能够非常轻易地经消化吸收进入人体,或类似以灰尘的形式,通过呼吸道被人吸入。放射性物质进入土壤后,会污染附近的水源和周边的整个环境,其影响可达数十年之久。
3.为此,本技术提供一种锶污染土壤的修复方法,用于锶污染土壤的修复。
技术实现要素:
4.本技术的发明目的在于,提供一种锶污染土壤的修复方法。本技术筛选出具有较好锶污染土壤修复能力的微生物组合,并将筛选得到的微生物组合与筛选得到的植物进行联合修复;在植物
‑
微生物联合修复研究时,对在接种微生物前后取植物根部土壤测定在微生物添加前后土壤的理化性质的变化和土壤中微生物群落的变化进行了分析。进一步,本技术通过宏基因组测序分析牧草根际土壤中微生物群落的前后变化,建立了相应的评测标准,为含锶等重金属土壤的修复提升了指导依据。
5.为了实现上述目的,本技术采用如下技术方案:
6.一种锶污染土壤的修复方法,将微生物复合菌剂用于锶污染土壤的修复;
7.所述微生物复合菌剂由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=2:1.8
‑
2.2:0:0.8
‑
1.2组成,或由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=2:0:0.8
‑
1.2:1.8
‑
2.2组成,或由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:0.8
‑
1.2:0:2组成,或由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:2:0.8
‑
1.2:0组成。
8.所述微生物复合菌剂由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=2:2:0:1组成,或由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=2:0:1:2组成,或由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:1:0:2组成,或由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:2:1:0组成。
9.所述微生物复合菌剂由耐辐射奇球菌、蜡样芽孢杆菌按质量比20:10组成,或由耐辐射奇球菌、柠檬酸杆菌按质量比10:20组成,或由枯草芽孢杆菌、耐辐射奇球菌、柠檬酸杆菌按质量比20:20:10组成。
10.在牧草生长过程中,将微生物复合菌剂接种至牧草根部,通过微生物复合菌剂与牧草联合作用,实现对锶污染土壤的修复。
11.包括如下步骤:
12.(1)将牧草种子在待修复的含锶污染土壤中进行播种,并生长至幼苗期;
13.(2)将微生物复合菌剂接种到植物根层;通过微生物复合菌剂与牧草的联合作用,
实现对含锶污染土壤的修复。
14.优选地,所述牧草为苏丹草、高丹草中的一种或两种;
15.所述微生物复合菌剂由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=2:2:0:1组成,或由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:1:0:2组成。
16.所述牧草为狼尾草;所述微生物复合菌剂由枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:2:1:0组成。
17.牧草
‑
微生物修复含锶污染土壤的评价方法,包括如下步骤:通过测定修复含锶土壤前后的ph值变化、土壤呼吸变化、植物根际土壤微生物代谢活性的变化、植物根际土壤微生物利用不同碳源的变化、植物根际土壤微生物群落多样性的变化、宏基因组测序,确定牧草
‑
微生物联合修复的效果,并筛选出牧草
‑
微生物修复的最佳方案。
18.本技术先找出了能够促进植物对锶、铯具有超富集作用的微生物组合,和植物
‑
微生物联合修复的共生组合,通过合适的微生物组合来提高草本植物对重金属的富集能力,探究微生物在修复土壤重金属污染中起到的作用和机理,以解决重金属sr对土壤以及生态环境造成的危害。
19.本技术的方案中,一方面,微生物能够直接诱导产生铁载体、植物生长激素(iaa)、acc脱氨酶等物质、改善植物营养、促进植物生长,提高重金属离子的生物可利用性,增加植物富集量。另一方面,微生物能间接的通过诱导植物抗性系统,增加抗氧化酶活性,降低重金属的毒性。微生物还可以通过自身的分泌物质来调节土壤ph,改变土壤中核素的存在形态,提高植物对其的富集能力。
20.植物
‑
微生物联合修复技术是利用植物在土壤中构成的一个特异的根际系统,直接或间接地吸收和降解土壤中污染物质。植物
‑
微生物联合修复技术具有原位、高效、不造成二次污染等优势,在治理重金属污染土壤方面展现出了广阔的应用前景。
21.土壤微生物在长久的环境下形成一个稳定的群落系统,当环境遭到破坏时,微生物群落也会受到影响产生变化,为适应新的环境而逐渐形成新的稳定体系。植物
‑
微生物联合修复体系中需要向植物根际注射微生物组合菌液,新注射的菌液对本土根系微生物来说属于外来菌种,因此植物根系微生物群落会产生变化,并在不断变化后逐渐趋于新的稳定,形成新的微生物群落体系。
22.土壤微生物驱动着土壤中的物质循环和养分转化。在土壤学的研究中,长期将土壤作为一个黑箱系统来对待,对其中的生物组成及其参与的生化过程知之甚少。土壤中绝大部分微生物目前尚难以分离培养,因此基于传统的培养方法对于认识土壤微生物群落组成和功能有其局限性。宏基因组学直接从环境样品中提取全部微生物的dna,或通过测序探究环境中微生物的群落结构和功能(序列驱动),或构建宏基因组文库,筛选新的基因或生物活性物质(功能驱动),克服了传统培养方法的缺陷,极大地丰富了对土壤微生物多样性及其功能的认知。为此,本技术通过宏基因组测序分析牧草根际土壤中微生物群落的前后变化,建议相应的评测标准,为含锶等重金属土壤的修复提升了指导依据。
附图说明
23.本发明将通过例子并参照附图的方式说明,其中:
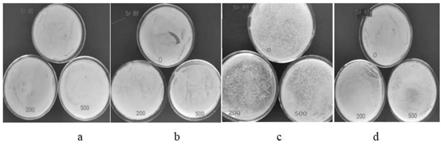
24.图1为微生物对不同浓度sr耐受性固体平板初筛图。
25.图2为枯草芽孢杆菌在sr胁迫下的生长曲线图。
26.图3为蜡样芽孢杆菌在sr胁迫下的生长曲线图。
27.图4为柠檬酸杆菌在sr胁迫下的生长曲线图。
28.图5为耐辐射奇球菌在sr胁迫下的生长曲线图。
29.图6为枯草芽孢杆菌在sr胁迫下的去除效应图。
30.图7为蜡样芽孢杆菌在sr胁迫下的去除效应图。
31.图8为柠檬酸杆菌在sr胁迫下的去除效应图。
32.图9为耐辐射奇球菌在sr胁迫下的去除效应图。
33.图10为微生物组合在sr胁迫下的生长曲线。
34.图11为微生物组合在sr胁迫下的去除效应。
35.图12为微生物分泌iaa标准曲线。
36.图13为微生物分泌acc脱氨酶标准曲线。
37.图14为sr胁迫下微生物铁载体能力测定。
38.图15为五点接种法示意图。
39.图16为牧草根际微生物群落相对丰度图。
40.图17为β多样性分析图。
41.图18为牧草生长三个时期根系微生物群落功能比较图。
具体实施方式
42.本说明书中公开的所有特征,或公开的所有方法或过程中的步骤,除了互相排斥的特征和/或步骤以外,均可以以任何方式组合。
43.实施例1
44.1.材料方法
45.1.1供试菌株
46.发明人基于前期研究,初步选定微生物的种类有以下五种:枯草芽孢杆菌(bacillus subtilis)、蜡样芽孢杆菌(bacillus cereus.frankland)、耐辐射奇球菌(deinococcusradiodurans,dr)、柠檬酸杆菌(citrobacter werkman and gillen)、荧光假单胞菌(pseudomonas fluorescens)。目前,针对单一微生物对核素的耐受性和去除率筛选研究较多,但是对微生物组合的核素耐受性和去除率以及微生物组合促进植物富集土壤中核素的研究较少。然而,单一生物修复难以良好的解决问题,仍存在诸多弊端,包括周期长,应用不便利等问题。
47.1.2锶耐受性微生物的固体平板初筛
48.分别设置sr浓度为0、200、500mg l
‑1三个梯度的tgy固体培养基,将初筛获得的微生物在30℃下震荡培养,用紫外分光光度计(analytikjena 200plus)测定od
600
为0.8时,取40μl涂布在固体平板上。将对照组和实验组一起在相同条件下培养24h后观察微生物生长情况,与对照组进行比较选出对核素具有耐受性的微生物。
49.1.3锶、铯耐受性微生物的液体复筛
50.将固体平板筛选得到的微生物在含有不同重金属浓度的液体培养基中进行培养,
并在相同时间间隔时测定细菌生长的od值和培养基中重金属的含量,以此来评估微生物对重金属的耐受性和去除液体中重金属的能力。
51.1.3.1锶耐受性微生物液体复筛的生长曲线
52.分别设置sr浓度梯度为0、20、50、100、200、500mg l
‑1的液体培养基,每个样品设置三组平行,在250ml的三角瓶中加入134ml的对应空白培养基,然后加入15ml在600nm条件下测od值为0.8的菌液,混合均匀。在30℃120r min
‑1的恒温震动培养箱中培养,每24h取2ml培养液在600nm处测od值,直到微生物停止生长,菌液od值保持不变或下降为止。取6ml菌液在3000r min
‑1的离心机中离心10min,取上清液消解,通过原子吸收光谱仪测定上清液中核素的浓度。
53.1.3.2锶耐受性微生物液体复筛的去除率
54.在每次测定细菌od值的同时,取6ml菌液离心取5ml上清液加入消解罐中,加入2.5ml高氯酸和5ml硝酸在180℃中消解、过滤、定容在25ml的容量瓶中。将消解液用原子吸收光谱(perkin elmer aa700)测定sr浓度,计算微生物对液体培养基中的核素去除率。
55.1.4微生物组合对锶耐受性和去除率的筛选
56.通过比较不同组合之间耐受性与核素去除率的大小,选出耐受性强且去除能力高的组合,测定这些组合分泌可以提高牧草富集核素的物质的能力。
57.通过sr耐受性和去除能力筛选,选用枯草芽孢杆菌、耐辐射奇球菌、蜡样芽孢杆菌、柠檬酸杆菌作为耐sr的后期研究菌种。在sr浓度为100mg l
‑1的条件下,采用四因素三平行正交实验研究,最终得到微生物组合菌群的生长曲线和去除率。
58.表1耐sr微生物组合筛选正交实验表
[0059][0060]
表1中,筛选sr时,菌株1~4分别为枯草芽孢杆菌、耐辐射奇球菌、蜡样芽孢杆菌、柠檬酸杆菌;试验号a~i为9种不同微生物组合。
[0061]
根据微生物对不同核素的耐受情况结合对核素的去除能力选择四组最优的微生物组合,进行后期微生物
‑
植物联合修复研究。
[0062]
1.5微生物组合分泌促生指标的能力
[0063]
通过不同方法测定微生物组合分泌iaa、acc脱氨酶和铁载体的能力。
[0064]
1.5.1微生物组合产iaa的能力分析
[0065]
采用iaa来绘制标准曲线,配制两组iaa溶液,浓度依次为2.5,5.0,7.5,10.0,12.5,15.0,17.5mg l
‑1和25,50,75,100,125,150,175mg l
‑1,分别取上述iaa 4ml,在第一组中加入pc比色液4ml,第二组中加入s2比色液4ml,在黑暗中静置0.5h,取出立即用分光光度计测od
530
值,以加了比色液的蒸馏水调0,重复三次,获得数据,绘制标准曲线。
[0066]
1.5.2微生物组合产acc脱氨酶的能力分析
[0067]
采用茚三酮比色法acc测定脱氨酶活力。标准曲线的绘制:取0、50、100、200、300、400和500ug ml
‑1的acc溶液各5ml于25ml的比色管中,各加入1ml的0.5%茚三酮试剂,加上塞充分摇匀。将其置于90℃下水浴20
‑
25min,冷却至室温,用721型分光光度计测定od
530
光密度值。以标准液的光密度值和浓度制备标准曲线。
[0068]
1.5.3微生物组合产铁载体能力分析
[0069]
在100ml蒸馏水中溶解0.3640g十六烷基三甲基溴化铵,获得10mmol l
‑1的溶液,100ml蒸馏水中溶解0.0164g氯化铁,获得1mmol l
‑1溶液(可加少量稀hci),先用乙醇溶解0.1210g cas,后用去离子水定容至100ml,最终配置出cas检测液。
[0070]
将优势微生物组合加入到mkb培养基中,28℃,150r min
‑1培养48h;使用离心机3500rmin
‑1离心15min,取上层清液用于检测,使上清液与3ml cas检测液充分混匀后静置1h,待反应完成后采用722型分光光度计来测定630nm波长处的吸光值(a),用双蒸水与对照调零;同时取3ml cas检测液和3ml未接种的mkb液体培养基上层清液充分混匀,采用相同方法测定吸光值即为参比值(ar)。
[0071]
以a与ar的比值作为定量的指标,用来比较各种微生物分泌出铁载体的多少。a与ar的比值越小,则说明铁载体的分泌量越多。
[0072]
2.结果与分析
[0073]
2.1锶耐受性微生物筛选
[0074]
将枯草芽孢杆菌、耐辐射奇球菌、蜡样芽孢杆菌和柠檬酸杆菌在含有sr的培养基中培养,分别进行固体平板初筛、液体复筛和去除率检测,最终检测筛选四种微生物的耐受性和去除率。
[0075]
2.1.1锶耐受性微生物的固体平板初筛
[0076]
将备选菌株涂布在含有0、200、500mg l
‑1的tgy琼脂培养基上,在30℃的条件下培养24h观察微生物生长情况,以此来判断微生物对sr的耐受性。
[0077]
四种微生物固体平板初筛后得到的耐受性生长情况如图1所示(图1为微生物对不同浓度sr耐受性固体平板初筛图;图1中,a对应蜡样芽孢杆菌,b对应耐辐射奇球菌,c对应柠檬酸杆菌,d对应枯草芽孢杆菌),四种菌株对sr的耐受性都很强,枯草芽孢杆菌、蜡样芽孢杆菌和耐辐射奇球菌三种细菌在平板上的菌落数较多,表明其对sr的耐受性很强,其中柠檬酸杆菌对sr的耐受性相对较差。
[0078]
2.1.2锶耐受性微生物的液体复筛
[0079]
将四种微生物分别接种在含有sr浓度为0、20、50、100、200、500mg l
‑1的液体培养基中培养,每隔24h用分光光度计测定一次600nm处的吸光值,研究sr浓度对微生物生长造成的影响;并且取6ml菌液离心取上清液进行消解处理,将消解液在火焰原子吸收分光光度计(anton paar multiwave pro)中测定培养基中剩余的sr浓度,获得结果如图2、图3、图4、图5所示。
[0080]
由图可知,枯草芽孢杆菌、蜡样芽孢杆菌和耐辐射奇球菌在不同sr浓度的培养基中生长72h时达到最高值,而柠檬酸杆菌则在96h时od
600
达到最高。
[0081]
锶离子浓度为100mg l
‑1时,在24h前,菌的生长受限,48h后,菌开始对数生长,在72h时,达到平稳期。即,相对于菌株在其他锶离子浓度,在100mg l
‑1时,菌株的对数生长期
被推后。枯草芽孢杆菌在其他的锶离子浓度培养时,48h之前,菌的od值会随时间的增加而增加。此外,锶浓度低于100mg l
‑1时,相比于对照组,锶离子对该菌生长有明显的促进作用。在锶浓度高于200mg l
‑1时,相比于对照组,锶离子对该菌生长有明显的抑制作用。
[0082]
蜡样芽孢杆菌在锶离子浓度100mg l
‑1时,在培养48h之前,菌株处于延迟进入对数生长期状态,48h后,菌株进入对数生长期,72h时,菌株达到稳定期,此时od值最大,达2.55。同理,该菌在50mg l
‑1时同样处于延迟进入对数生长期状态,在72h后进入稳定期。此外,锶浓度低于200mg l
‑1时,相比于对照组,锶离子对该菌生长有促进作用。锶浓度在500mg l
‑1时,在24h已经进入对数生长期,48h之后进入丧亡期。此外,菌株在500mg l
‑1时相比对照组,锶离子对该菌生长有明显的抑制作用。
[0083]
柠檬酸杆菌在96h之前,菌数在锶离子浓度梯度下都随时间的增加而增加,在96h之后菌的od值呈现下降趋势。此外,相比于其他三个菌种生长曲线,柠檬酸杆菌的进入稳定期的时间较长,生长较慢,且od值较低,最大只有1.8。即柠檬酸杆菌对锶耐受性比较差。
[0084]
耐辐射奇球菌在72h之前,菌数在锶离子浓度梯度下大都会随时间的增加而增加,在72h时od值达到最高。此后,所有浓度都出现下降趋势。锶离子浓度大于200mg l
‑1时,相比于对照组,锶离子对该菌生长有抑制作用。锶浓度在500mg l
‑1时,相比于对照组,锶离子对该菌生长有特别明显的抑制作用。
[0085]
图6、图7、图8、图9依次为枯草芽孢杆菌、蜡样芽孢杆菌、柠檬酸杆菌、耐辐射奇球菌在sr胁迫下的去除效应图。
[0086]
枯草芽孢杆菌在不同锶离子浓度的tgy液体培养基中培养,其去除率随锶离子浓度的增加而降低。在锶离子浓度为20mg l
‑1时,其对锶离子的去除率在48h后达最大,最大值为94.45%,之后其去除率基本稳定在最大值。菌株在50mg l
‑1时去除率跟20mg l
‑1的趋势相似,在48h时去除率达到88%。当sr浓度达到200mg l
‑1时,菌株对sr的去除率明显下降。
[0087]
蜡样芽孢杆菌在不同锶离子浓度的tgy液体培养基中培养,其去除率随锶离子浓度的增加而降低。蜡样芽孢杆菌在锶离子浓度100mg l
‑1培养时,其对锶离子的去除率在48h后达最大,最大值维持在60.66%,之后其去除率基本稳定在最大值。同理,该菌株在锶离子浓度200mg l
‑1时,去除效果与100mg l
‑1时类似,在48h后去除率达最大值,之后稳定在43.23%。该菌在锶离子浓度500mg l
‑1时,其去除率在48h后达最大,只有15.13%,之后去除率呈现下降趋势,原因可能是锶离子浓度过高,抑制菌群的生长代谢,导致菌株大量死亡,锶离子重新释放出来,其去除率呈现下降趋势。
[0088]
柠檬酸杆菌在不同锶离子浓度的tgy液体培养基中培养,其去除率随锶离子浓度的增加而降低。其在锶离子浓度20mg l
‑1时,其对锶离子的去除率在96h后达最大,最大值维持在87%,之后其去除率基本稳定在最大值。同理,该菌株在锶离子浓度200mg l
‑1时,其去除率在72h时达最大,仅为8.2%。此后其去除率达稳定在最大值。当锶离子浓度超过200mg l
‑1时,菌株去除率较低,说明锶离子过高,毒性过大,会抑制菌株的生长代谢。此外,锶离子浓度低于100mg l
‑1时其去除率明显偏高,说明菌株在低浓度的锶离子溶液中,耐受性较好。
[0089]
耐辐射奇球菌在不同锶离子浓度的tgy液体培养基中培养,其去除率随锶离子浓度的增加而降低。其在锶离子浓度100mg l
‑1时,其对锶离子的去除率在72h后达最大,最大值维持在65%,之后其去除率基本稳定在最大值。该菌株在锶离子浓度20mg l
‑1和200mg l
‑1时,其去除率随着时间持续增加,在96h时达到最大,去除率最大值分别为85%、52%。此
外,该菌在锶离子浓度500mg l
‑1时,其去除率在48h达最大,之后一直下降,原因可能是锶离子浓度过高,抑制菌群的生长代谢,导致菌株大量死亡,锶离子重新释放出来。
[0090]
2.2锶耐受性微生物组合的构建
[0091]
将四种微生物组合带入表1微生物正交试验表,形成九种不同微生物组合。根据微生物生长曲线和去除能力的探究,最终选择微生物正交实验sr浓度为100mg l
‑1。将微生物组合按照比例接种到培养基中进行培养,24h时开始测定其生长曲线和培养基中核素含量,每隔12h测一次。
[0092]
图10给出了微生物组合在sr胁迫下的生长曲线。由图10可知,在24
‑
36h之间,所有组合的菌浓度均在提升,在36h时,菌浓度达到峰值,其中h组合的浓度最大为2.55,超过36h时,菌浓度开始呈下降趋势。36h时od
600
值最大的组合分别为h、f、g、e,分别是2.55、2.35、2.30、2.27。
[0093]
图11给出了微生物组合在sr胁迫下的去除效应。微生物组合菌群在100mg l
‑1锶离子浓度的tgy液体培养基中培养,除了c微生物组合的对锶离子去除率较低,其他的微生物组合均有较好去除效果。其中h微生物组合在培养36h时对锶离子的去除率达到最大值,为65%,此后其去除率稳定在最大值。e微生物组合在24h,其去除率达最大,最大为65%,之后一直维持在最大值。说明其对该锶离子浓度的短时间去除效果较好。其他的微生物组合也大致如此,最大去除率一般36h后达最大,去除率在64%左右。
[0094]
由图10和图11可知,微生物组合菌群在100mg l
‑1锶离子浓度下培养,在e、f、g、h微生物组合中,其生长情况和对锶的去除率都较好。所以,选择e、f、g、h微生物组合为后续研究。
[0095]
2.3微生物组合分泌iaa、acc脱氨酶和铁载体的能力
[0096]
2.3.1微生物组合分泌iaa能力
[0097]
根据1.5.1方法,以吲哚乙酸(iaa)标准液的浓度为横坐标(x),od
540
为纵坐标(y)绘制标准曲线,分别得到低浓度范围回归方程为:y=0.0104x
‑
0.0070,r2=0.9995;高浓度范围回归方程为y=0.0205x
‑
0.5516,r2=0.9993。
[0098]
图12给出了微生物分泌iaa标准曲线;图12中,a为低浓度iaa标准曲线,b为高浓度标准曲线。
[0099]
分别将筛选得到对sr具有较强耐受性的e、f、g、h组合添加进培养基中培养,分别用两种比色液进行反应,将测得的od值带入图12iaa标曲中,测得吸光值的区间在s2的范围内,故选用s2标曲。结果表明,4个微生物组合菌群都具有分泌iaa能力,其中组合g和h中iaa含量最高,分别为62.79mg l
‑1和61.25mg l
‑1,故g和h微生物组合为分泌iaa的优势菌株组合。
[0100]
表2 sr胁迫下微生物组合产iaa能力/mg l
‑1[0101][0102]
2.3.2微生物组合分泌acc脱氨酶的能力
[0103]
根据1.5.2中的方法,检测微生物产acc脱氨酶的能力,绘制出acc标准曲线图,其回归方程为y=0.0011x+0.0297,r2=0.9993。将筛选得到的耐锶和耐铯微生物组合用相同方法测出吸光值,代入到标曲中计算acc的分泌量。
[0104]
图13给出了微生物分泌acc脱氨酶标准曲线。根据图13的acc标准曲线可以计算出e的acc浓度检测值较大,为497.73mg l
‑1,说明微生物组合e分泌acc脱氨酶能力较差。相比于h组合,g、f微生物组合培养基中剩余acc含量较高,分别为328.24mg l
‑1和320.18mg l
‑1,则说明其分泌acc脱氨酶含量较少。微生物组合h分泌acc脱氨酶能力最好,不仅有acc脱氨酶,而且其酶活力能维持在比较高的水平。综合分析,h、g、f能较好的产生acc脱氨酶,从而较好的控制acc含量,达到提高植物促生作用。
[0105]
表3 sr胁迫下微生物组合产acc脱氨酶能力
[0106][0107]
2.3.3微生物组合分泌铁载体的能力
[0108]
由于检测液吸光值(ar)数值较大,其a/ar值越小,菌株产铁载体能力越强。
[0109]
图14给出了sr胁迫下微生物铁载体能力测定。如图14所见,h、g、e的a/ar值相对较低,分别为1.01、1.21和1.22;而f组合产铁载体的能力相对较弱。本次微生物组合分泌铁载体的能力研究发现,耐受性越强产铁载体越多,体现出较强的铁载体分泌能力,更能满足微生物对重金属的运输能力。
[0110]
3.总体分析
[0111]
3.1微生物对核素的耐受性及去除能力
[0112]
本发明研究发现,枯草芽孢杆菌是所选菌种几种菌种中去除核素能力最强的菌株。其在含有20mg l
‑1的sr培养基中培养48h时,对溶液中的sr的去除率可以达到94.45%,在sr浓度为20mg l
‑1时去除率也可达到88%。除此之外,其它细菌对核素也表现出不低的去除能力。
[0113]
3.2微生物组合对核素的去除能力
[0114]
微生物组合在sr胁迫下生长36h时,菌浓度达到最高,其中h组合生长最好,od
600
达到2.5左右;耐sr微生物组合对sr的去除能力从24h开始趋于稳定。
[0115]
3.3微生物组合分泌iaa、acc脱氨酶和铁载体的能力
[0116]
本发明筛选所得到的微生物组合产iaa的能力均在50mgl
‑1以上,明显高于现有技术。
[0117]
3.4小结
[0118]
(1)本技术通过微生物组合耐受性和去除能力的筛选,分别选出针对sr的优势组合为:e(枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=2:2:0:1)、f(枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=2:0:1:2)、g(枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:1:0:2)、h(枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:2:1:0)。
[0119]
(2)由表2内容可知,h和e微生物组合分泌iaa的能力最强。由微生物产acc脱氨酶能力研究可知,h、g、e微生物组合培养基中剩余的acc含量较少,则说明其分泌acc脱氨酶能力较好。并且,微生物组合h分泌acc脱氨酶能力最好,不仅有acc脱氨酶,而且其酶活力能维持在比较高的水平。
[0120]
4.微生物
‑
牧草联合修复锶污染土壤
[0121]
4.1材料与方法
[0122]
4.1.1牧草和微生物组合
[0123]
发明人通过考察不同牧草对sr的耐受性和富集能力,筛选出三种具有强耐受性和高富集能力的牧草:苏丹草(sorghum sudanense(piper)stapf.)、高丹草(sorghum hybrid sudangrass)、杂交狼尾草(pennisetum americanum
×
pennisetum purpureum cv.)。
[0124]
耐sr的微生物组合为e(枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=2:2:0:1)、f(枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=2:0:1:2)、g(枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:1:0:2)、h(枯草芽孢杆菌:耐辐射奇球菌:蜡样芽孢杆菌:柠檬酸杆菌=0:2:1:0)。
[0125]
将耐sr的三种牧草分别与筛选得到的四种微生物组合进行组合,在牧草生长过程中,将微生物菌液接种至植物根部,研究微生物组合对牧草生物量及富集能力的影响。
[0126]
4.1.2材料制备
[0127]
4.1.1.1锶污染土壤制备
[0128]
通过计算配置含sr浓度为50、200、500mg kg
‑1的土壤。拌置方法:通过计算称取一定量的srcl2,将固体在去离子水中溶解后,与农田土壤一起均匀搅拌,静置1个月,在静置期间需要每隔十天对土壤加水进行二次混合。在静置期结束待土壤自然风干后装入花盆中,每盆装1kg土壤。
[0129]
4.1.1.2微生物组合的培养
[0130]
分别取枯草芽孢杆菌、蜡样芽孢杆菌、耐辐射奇球菌、柠檬酸杆菌和荧光假单胞菌在tgy培养基中进行培养,待细菌od
600
达到1.0时,按照比例将菌液进行混合摇匀,分别得到e、f、g、h组合,如表4所示。
[0131]
表4 sr修复优势微生物组合表
[0132][0133]
4.1.2牧草播种及生长管理
[0134]
选取籽粒饱满的种子在5%次氯酸钠溶剂中浸泡8min,去离子水反复清洗,后用温水浸泡24h。将泡后的种子均匀播种在花盆中,控制种子发芽所需要的湿度和温度,观察发芽情况。待种子发芽后,选择长势较好的草苗定株25株,拔掉长势差及过于密集的苗,每天用日光灯照射12h,定期给每盆牧草浇等量的水,保持牧草生长最适的条件。
[0135]
4.1.3接种微生物
[0136]
待牧草植株生长至幼苗期(待植物生长的平均株高3cm)时,将筛选的微生物组合用注射器注射到植物根层,采用五点接种法,分孔均匀注射菌液,注射深度5cm,每5天注射
一次,每次20ml,共计注射4次,总量80ml菌液。其中,五点接种法示意图如图15所示。
[0137]
4.1.4样品的收获及处理
[0138]
待牧草生长至地上部不再增高为止,在抽穗前收获牧草,用手轻轻捏碎植物根部土壤,将植物连同地下部完整取出,用水洗干净根部泥土,将地上部地下部分离,分别在105℃烘箱中进行杀青处理,结束后用研钵将样品碾碎成粉,称取0.3g在微波消解仪(anton paar multiwave pro)中进行消解。消解样通过火焰原子吸收分光光度计(perkin elmer aa700),测定sr含量。
[0139]
通过公式计算所测数据的各个指标,各指标的计算公式如下:
[0140]
植株核素含量(nuclide contents,nc,mg/kg)=(地上干重
×
地上核素含量+地下干重
×
地下核素含量)/(地上干重+地下干重);
[0141]
富集量(bioconcentration quantity,bcq,mg/pot)=每盆植株干重
×
植株核素含量;
[0142]
富集系数(bioconcentration factor,bcf)=植株核素含量/实际土壤核素含量;
[0143]
转移系数(transport coefficients,tf)=植株地上核素富集量/植株地下核素富集量。
[0144]
4.2结果分析
[0145]
4.2.1耐sr植物
‑
微生物组合的构建
[0146]
对sr具有高耐受性的微生物
‑
植物组合,结果如表5所示。
[0147]
通过对微生物组合促进sr数据的分析得知,在添加了微生物组合后,明显提升了杂交狼尾草和苏丹草对锶的富集能力。在不同的浓度条件下,随着锶浓度的升高,三种植物各微生物组合处理下的的锶富集量均随着锶胁迫浓度的上升而上升,在200mg kg
‑1的锶浓度条件下苏丹草
‑
g组合和高丹草
‑
e组合单盆积累量最高,分别为4.19mg
·
pot
‑1和4.00mg
·
pot
‑1;而在500mg/kg的浓度条件下,对于苏丹草而言,其e、g两种组合相较于其他两种组合更优,分别达到了11.56mg
·
pot
‑1和10.75mg
·
pot
‑1;同样,高丹草在该浓度条件下,e、g组合的单盆积累量也优于其他两种组合,分别达到了16.35mg
·
pot
‑1和16.52mg
·
pot
‑1。富集系数方面,在200mg/kg的锶浓度条件下,苏丹草
‑
g的富集系数最高,达到了6.09;而在500mg/kg的锶浓度条件下,苏丹草
‑
e的富集系数也较高,为5.88。因此选择四组富集sr效果最优牧草
‑
微生物组合为:苏丹草
‑
e、苏丹草
‑
g、高丹草
‑
e、高丹草
‑
g。
[0148]
表5各植物
‑
微生物组合sr富集参数
[0149]
[0150]
[0151][0152]
注:ck为对应浓度无微生物的对照。gsc:地上植株锶含量(mg kg
‑1);usc:地下植株锶含量(mg kg
‑1);sc:植株锶含量(mg kg
‑1);bcq:单盆积累量(mg pot
‑1);bcf:富集系数;tf:转移系数。
[0153]
4.3总结
[0154]
本实施例中,添加了微生物组合的实验组地上部和地下部干重明显高于未添加微生物的ck组,因此表明微生物组合作用于植物根部后可以显著提高牧草的干重。本技术中,狼尾草在相同浓度下的转移系数和富集系数分别为2.047
±
0.298和5.817
±
0.469,添加h组合后3.272
±
0.291和6.071
±
0.188,在未添加微生物组合前狼尾草的转移系数比油菜低,但添加微生物后转移系数和富集系数都获得了提高。
[0155]
5.牧草
‑
微生物联合修复对土壤性质(功能、结构)的影响
[0156]
针对添加微生物前和添加微生物后进行两次取样,对土壤ph、土壤呼吸进行检测,前后对比研究外源微生物对土壤基础性质的影响。
[0157]
本技术中测得的土壤呼吸主要为土壤中微生物呼吸,通过筛网过滤了土壤中的根系呼吸和土壤动物呼吸带来的影响。在本技术中,向根际土壤中添加微生物组合,改变了原始土壤中的群落结构,新添加的微生物组合和原始微生物群落一起形成新的稳定群落结构,分别在添加微生物群落前后检测土壤呼吸,分析添加微生物后对土壤呼吸的影响。
[0158]
5.1材料与方法
[0159]
5.1.1处理,取土
[0160]
5.1.1土壤ph
[0161]
分别在50mgkg
‑1、200mgkg
‑1和500mgkg
‑1的sr浓度中播种苏丹草,设置0浓度对照,每个组合设置3个重复。待牧草生长至地上部10cm时,分别取每个浓度的牧草根系土壤记为ck1。接种e、g微生物组合,设置不接种的空白对照组记为ck2,每隔5天接种一次,共接种4次,
4次接种结束后分别取不同sr浓度的土壤待后续土壤ph和土壤呼吸的测定。
[0162]
称取通过2mm孔径筛的风干土样10g(精确至0.01g)于50ml高型烧杯中,加除去co2的水25ml(土液比为1:2.5),用搅拌器搅拌1min,使土粒充分分散,放置30min后进行测定;将电机插入土样悬液中(注意玻璃电极球泡下部位位于土液界面处,甘汞电极插入上部清液),轻轻转动烧杯以除去电极的水膜,促进快速平衡,静置片刻,按下读数开关,待读数稳定时记下ph值。放开读数开关,取出电极,用水清洗,并用滤纸条吸干水分后即可进行第二个样品的测定。每测5~6个样品后需用标准溶液检查定位。
[0163]
5.1.2土壤呼吸
[0164]
称取相当于干土重20g的新鲜土样,置于150ml烧杯或铝盒中(也可用容重圈采取原状土)。准确吸取2mol l
‑1naoh 10ml于另一150ml烧杯,将两只烧杯同时放入无干燥剂的干燥器中,加盖密闭,放置1
‑
2天,取出盛naoh的烧杯,洗入250ml容量瓶中,稀释至刻度。吸取稀释液25ml,加酚酞1滴,用标准0.05mol l
‑1hcl滴定至无色,再加甲基橙1滴,继续用0.05mol l
‑1hcl滴定至溶液由橙黄色变为桔红色,记录后者所用hcl的毫升数(或用溴酚兰代替甲基橙,滴定颜色由兰变黄)。再在另一干燥器中,只放naoh,不放土壤,用同法测定,作为空白。
[0165]
250ml溶液中co2的重量(w1克):
[0166]
w1=(v1‑
v2)
×
c
×
(44/2
×
1000)
×
(250/25)=(v1‑
v2)
×
11mg(公式4
‑
1)
[0167]
式中:v1‑
供试溶液用甲基橙作指示剂时所用hcl毫升数的2倍;
[0168]
v2‑
空白试验溶液用甲基橙作指示剂时所用hcl毫升数的2倍;
[0169]
c
‑
hcl的摩尔浓度(mol l
‑
1);(44/2
×
1000)为co2的毫摩尔质量;
[0170]
(250/25)
‑
分取倍数。
[0171]
再换算为土壤呼吸强度(co
2 mg g
‑1干土h
‑1):
[0172]
co
2 mg g
‑1干土h
‑1=w1×
1000
×
1/20
×
1/24
[0173]
20
‑
试验所用土壤的克数;24
‑
试验所经历的时间(24h)。
[0174]
5.1.3biolog方法研究微生物组合对富集植物根际微生物群落的影响研究
[0175]
称取10g新鲜土壤样品,加入90ml无菌生理盐水,在振荡培养箱中以200rmin
‑1的速度振荡30min,静置5min,吸取5ml上清液加入45ml无菌生理盐水中,依次稀释2次。取稀释液置于无菌v型槽,使用八道移液枪将其接种于eco板的96孔中,每孔150μl。接种好的eco板放到铺有六层纱布的白瓷盘中,为防止eco板中菌悬液的挥发,纱布需要保持一定的湿度。将eco板放至30℃
±
1℃恒温培养箱中,每间隔24h用biolog自动读数仪在590nm(颜色+浊度)、750nm(浊度)波长下读取吸光值。
[0176]
(1)微生物代谢活性分析:采用od
590
‑
od
750
的值表示微生物代谢活性,该处理后的数据作为原始数据。微生物代谢强度采用孔的平均颜色变化率(average well color development,awcd)来描述,awcd值越大,表明土壤微生物的代谢功能越强,其计算公式为:
[0177][0178]
式中:ci为每个碳源孔的两波段光密度差值;r为对照孔的光密度值;31为本技术中培养基碳源种类数。
[0179]
(2)多样性指数分析:采用shannon多样性指数、simpson指数、mcintosh指数来描
述微生物群落多样性。由于采用不同培养时间的数据计算会产生不同的结果,本技术采用培养72h的数据来计算微生物群落的多样性指数。
[0180]
(3)碳源动力学特征分析:eco板中31种碳源可分为六大类,对不同碳源随时间变化的awcd值进行分析作图,考察锶污染对土壤微生物利用不同碳源动力学特征的影响。
[0181]
5.2结果分析
[0182]
5.2.1土壤ph
[0183]
通过对不同时期采取的土样进行ph的测定,得到土壤ph变化表如表6所示。
[0184]
表6添加微生物组合前后土壤ph变化表
[0185][0186]
表6中,ck1为接种微生物前土壤ph值,ck2为接种微生物后土壤的ph值,e和g为接种的两个微生物组合。
[0187]
四个实验组的ph均随着土壤中的sr浓度的增加而逐渐降低,ck1组合在0浓度时的ph值最高,最高为7.41。除500mg kg
‑1的ck1和ck2为酸性土壤外,其余土壤均为中性土壤。ck1和ck2相比,除0浓度外其余ck2与ck1没有明显差异。ck2在0浓度时呈现出弱酸性,其余三组在该浓度下均表现为弱碱性。添加e组合后,各浓度下的土壤ph均得到了提高;添加g组合后ph也发生了增加,但总体增加强度没有e组合强。
[0188]
5.2.2土壤呼吸
[0189]
根据步骤,通过测定添加微生物组合前后土壤产生co2,消耗naoh的量,代入公式计算得出土壤呼吸的强度如下表。
[0190]
表7添加微生物前后土壤呼吸表(mg kg
‑1h
‑1)
[0191][0192]
表7中,ck1为接种微生物前土壤ph值,ck2为接种微生物后土壤的ph值,e和g为两个微生物组合。
[0193]
如表7所示,在添加微生物组合后,0浓度的根际土壤呼吸强度较没有添加微生物的组合明显增大,其中e组合在50mg kg
‑1时的土壤呼吸强度最大为3.64,ck2和g组合随着sr浓度逐渐增大,在500mg kg
‑1时达到最大值。向未添加核素的土壤中接种微生物组合,微生物组合对土壤呼吸的影响具有很明显的正向促进作用,但是在向含有重金属的土壤中接种微生物组合后,土壤呼吸反倒受到一定的抑制作用,其抑制能力随着核素浓度的增大而增加。其中e组合在50mg kg
‑1时促进效果最佳,而g组合则在3个浓度中均受到抑制作用,其中在500mg kg
‑1时相对表现出一定的促进作用。
[0194]
5.2.3biolog分析土壤微生物群落变化
[0195]
5.2.3.1微生物组合对植物根际土壤微生物代谢活性的影响
[0196]
加入微生物组合前后,根际土壤微生物的代谢活性发生了明显的变化。在中低浓
度下(<500mgkg
‑1),两种微生物组合均促进了根际土壤微生物的代谢活性,在添加微生物组合e的样品中,awcd值始终高于其他处理,这表明微生物组合e促进根际土壤微生物代谢活性的效果最好。当sr浓度低于500mgkg
‑1时,微生物组合g对根际土壤微生物代谢也存在显著的促进作用,但在500mgkg
‑1时,组合g的添加抑制了根际土壤微生物的代谢活性,且较早地进入了平台期。表明在高浓度的sr处理下,微生物组合g可能会分泌某些抑制根际土壤微生物代谢的物质。
[0197]
5.2.3.2微生物组合对植物根际土壤微生物利用不同碳源的影响
[0198]
添加微生物组合之后,根际土壤微生物对不同碳源的利用能力又发生了明显的变化。在中低浓度下(<500mg kg
‑1),微生物组合e能够极大地促进根际土壤微生物对各类碳源的利用能力,而微生物组合g仅在sr浓度为50mg kg
‑1时才对微生物碳源利用能力具有明显的促进效果。在sr浓度为200mg kg
‑1时,微生物组合e对六大类碳源都有极大的促进作用。在高浓度下(500mg kg
‑1),微生物组合g对促进根际土壤微生物碳源利用的效果有所降低,微生物对胺类和酚酸的利用能力甚至低于未添加微生物组合的处理。
[0199]
5.2.3.4微生物组合对植物根际土壤微生物群落多样性的影响
[0200]
本技术研究表明,用sr处理土壤之后,植物根际土壤微生物的三个多样性指数均显著升高,但不同的sr处理浓度并未对微生物群落多样性造成显著性差异。
[0201]
表8添加微生物组合前根际土壤微生物群落多样性指数
[0202][0203]
表8中,ck表示未添加微生物组合;e表示微生物组合e;g表示微生物组合g。同列不同小写字母表示不同处理组在0.05水平差异显著。
[0204]
在添加微生物组合之后,在同一sr处理浓度下根际土壤微生物群落发生了较大变化。其中微生物组合e的多样性指数均高于同浓度下的其他处理,表明微生物组合e可以有效地提高根际土壤微生物群落多样性。微生物组合g对根际土壤微生物群落多样性也有一定的作用,但仅局限于较低浓度的sr处理(50mgkg
‑1),同时提升效果相对于微生物组合e而言较低。
[0205]
表9添加微生物组合后根际土壤微生物群落多样性指数
[0206][0207]
表9中,ck表示未添加微生物组合;e表示微生物组合e;g表示微生物组合g。同列不同小写字母表示在对应浓度下不同处理组在0.05水平差异显著。
[0208]
6.宏基因组分析土壤微生物群落的变化
[0209]
以不同时期牧草根际为样本,对土壤中的微生物群落进行宏基因组分析,发现在人工添加外援微生物组后对牧草根际的影响,和牧草在生长过程中对根际微生物群落之间的变化差异。
[0210]
6.1材料与方法
[0211]
6.1.1土壤样品的采集
[0212]
由于苏丹草
‑
e组合促进牧草富集sr效果最优,因此选择苏丹草
‑
e
‑
sr组合进行宏基因组测序研究微生物组合对牧草根际微生物群落的影响。本技术中用到的所有工具均采用无菌处理。分别取第一次接种e组合前的牧草根际土壤样品ck1、接种四次e组合后的牧草根际土壤样品e和同时期未接种微生物组合的牧草根际土壤样品ck2。
[0213]
将牧草与土壤完整的从花盆中去除,用手轻轻捏松土壤,除去周围的大块土壤,将牧草根系附近的土壤抖落至无菌报纸上,用镊子去除土壤样品中多余的根和其它杂质,将根际土壤集中收集至无菌采样管中,超低温冰箱
‑
70℃冷冻保存。
[0214]
6.1.2宏基因组测序
[0215]
6.1.2.1主要设备
[0216]
表10宏基因组测序主要仪器及设备
[0217][0218]
6.1.2.2样品提取与检测
[0219]
(1)ctab法提取环境微生物dna操作步骤
[0220]
1)吸取1000ul ctab裂解液至2.0ml ep管里,加入溶菌酶,将适量的样品加入裂解液中,65度水浴,期间颠倒混匀数次,以使样品充分裂解。
[0221]
2)离心取上清,加酚(ph8.0):氯仿:异戊醇(25:24:1),颠倒混匀,12000rpm离心10min。
[0222]
3)取上清,加氯仿:异戊醇(24:1),颠倒混匀,12000rpm离心10min。
[0223]
4)吸取上清至1.5ml离心管里,加入异丙醇,上下摇晃,
‑
20度沉淀。
[0224]
5)12000rpm离心10分钟,倒出液体,注意不要倒出沉淀。用1ml 75%乙醇洗涤2次,剩余的少量液体可再次离心收集,然后用枪头吸出。
[0225]
6)超净工作台吹干或者室温晾干(dna 样品不要过于干燥,否则很难溶解)
[0226]
7)加入ddh2o溶解dna 样品,必要时可于55
‑
60℃下孵育10min助溶。
[0227]
8)加rnase a 1ul消化rna,37℃放置15min。
[0228]
(2)ctab法提取环境微生物dna样品的检测
[0229]
提取dna,之后进行2种方法的检测:
[0230]
(1)琼脂糖凝胶电泳(age)分析dna的纯度和完整性;
[0231]
(2)qubit对dna浓度进行精确定量。
[0232]
6.1.2.3文库构建与库检
[0233]
检测合格的dna 样品用covaris超声波破碎仪随机打断成长度约为350bp的片段,经末端修复、加a尾、加测序接头、纯化、pcr扩增等步骤完成整个文库制备。使用neb ultra
tm dna library prep kit for illumina(neb,usa)构建文库。(具体参考protocol for use with nebnext ultra dna library prep kit)
[0234]
文库构建完成后,先使用qubit2.0进行初步定量,稀释文库至2ng/ul,随后使用agilent 2100对文库的insert size进行检测,使用q
‑
pcr方法对文库的有效浓度进行准确定量(文库有效浓度>3nm),以保证文库质量。
[0235]
6.1.2.4上机测序
[0236]
库检合格后,把不同文库按照有效浓度及目标下机数据量的需求pooling后进行illumina pe150测序。
[0237]
6.2结果分析
[0238]
6.2.1牧草根际微生物群落门水平上的差异
[0239]
三种不同时期收获的牧草根系土壤经过宏基因组分析门水平的差异,在三个时期土壤样本中丰度最高的10个门,分别为放线菌门(actinobacteria)、变形菌门(proteobacteria)、厚壁菌门(firmicutes)、子囊菌门(ascomycota)、广古菌门(euryarchaeota)、拟杆菌门(bacteroidetes)、绿弯菌门(chloroflexi)、芽单胞菌门(gemmatimonadetes)、奇古菌门(thaumarchaeota)、螺旋体菌门(candidatus_saccharibacteria)。其中,放线菌门和变形菌门均为三个时期的优势优势菌种。通过图5
‑
1发现,在牧草幼苗期时,sr浓度对放线菌门造成明显的胁迫作用,放线菌门的量随着sr浓度的增高而降低;而变形菌门却正好相反,变形菌门的量随着sr浓度升高而增加。等牧草从幼苗期生长到成苗期后,牧草根际环境中放线菌门的数量明显增多,变形菌门数量减少,浓度对两种菌数量的影响较小。添加微生物组合e与未添加微生物组合的成苗比较,牧草根系环境中厚壁菌门的数量明显增多。
[0240]
图16给出了牧草根际微生物群落相对丰度图;其中,c:牧草幼苗期t:未接种微生物组合的牧草成苗期e:接种微生物组合e的牧草成苗期。
[0241]
6.2.2三个时期牧草根际土壤微生物群落的差异
[0242]
对宏基因组测得的数据进行β多样性分析得到图17,观察图可以发现,在不同sr浓度环境下生长的牧草根际土壤微生物群落之间的差异较小。在牧草幼苗期时,sr对根系土壤中微生物群落的差异影响显著,而不同浓度之间的差异不显著。随着牧草的成熟,对于未添加微生物组合的0浓度牧草土壤根系微生物群落之前的差异性较小,但是在sr环境下生长的牧草其幼苗期和成熟期的差异显著。
[0243]
6.2.3牧草生长三个时期根系微生物群落功能比较
[0244]
通过图18发现,对于0浓度下生长的幼苗期牧草,其根系土壤微生物的功能较强,但是随着幼苗的生长至成熟后,牧草根系土壤微生物功能减弱,随着接种微生物组合e后,牧草根系土壤微生物的功能又开始增强。幼苗期时根系土壤中的微生物耐受性和抗病能力相对较弱,随着重金属浓度的升高,微生物表现出的耐受性和抗病能力逐渐增强,在200mg kg
‑
1时达到最强。随着牧草成熟,在sr的环境下生长的牧草根系土壤中的耐受性和抗病基因大幅度减少,添加微生物组合e后,牧草根系土壤微生物中耐受性和抗病性的基因再次增加,因此表明添加微生物组合e后,可以明显提高牧草的抗病性和对逆境的耐受性。但是对于外源性物质的生物降解和代谢功能相关的基因在牧草生长过程中和添加微生物组合e后并没有获得提高,反而表现出逐渐减少的趋势。
[0245]
发明人将筛选得到的微生物菌株进行正交组合,得到不同的微生物组合,对组合进行耐受性和去除率的检测,最终选择出优势组合,对筛选出的优势组合进行产吲哚乙酸(iaa)、产acc脱氨酶和产铁载体能力测定,进而获得能有效分泌植物生长有益物质的微生物组合,考察其在后续微生物
‑
牧草组合中提高富集能力的作用。同时,发明人进行微生物
‑
牧草联合修复,并提供种植牧草及微生物前后土壤性质变化(包括ph、土壤呼吸、biolog
‑
eco分析),及宏基因组测序,建议一套微生物
‑
牧草评价标准,为牧草
‑
微生物联合修复提供了理论依据。
[0246]
本发明并不局限于前述的具体实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1