一种实际水体紫外高级氧化工艺中有机污染物降解速率的预测方法
1.本发明涉及一种实际水体紫外高级氧化工艺中有机污染物降解速率的预测方法,属于环保水处理技术领域。
背景技术:
2.水体中的抗生素、内分泌干扰物等微量污染物因其溶解度高、稳定性强、对人体有害而受到广泛关注。高级氧化工艺(aops)由于能产生具有强反应活性的自由基而成为一种有效降解有机污染物的技术。在过去的几十年中,基于紫外(uv)的高级氧化工艺(uv
‑
aops)在去除水中微量污染物方面有着广泛的应用。根据氧化剂的不同,基于紫外的高级氧化工艺分为紫外/过氧化氢高级氧化工艺(uv/h2o2)、紫外/氯高级氧化工艺(uv/cl2)和紫外/过硫酸盐高级氧化工艺(uv/s2o
82
‑
)等。
3.在uv
‑
aops效能评估中,污染物降解速率的确定对于合适的工艺、光源、操作条件的选择都有重要意义。传统评估方法需要在现场采集水样并运送到专业的实验室中,这种方法存在以下问题:(1)uv
‑
aops工艺效能影响因素众多,如光源、污染物、氧化剂、水基质等的种类,使得实验室评估的工作量巨大;(2)需要操作一些专业实验仪器,如能准确测量光辐照剂量的准直光束仪(qcba)、液相色谱质谱联用仪(hplc
‑
ms)等;(3)成本高,时间长。因此开发一种不依赖于先进分析仪器和qcba的方法来获得实际水处理过程中污染物的降解速率具有重要意义。
4.在实验条件受到限制的条件下,利用模型预测污染物的降解速率被证明是一种行之有效的方法。目前,稳态假设模型已经成功地模拟了aops对微污染物的降解,结合光化学模型计算出uv
‑
aops中自由基的稳态浓度([rr]
ss
),再利用目标污染物与自由基的二级反应速率常数(k
rr,mp
)即可预测目标污染物降解速率(k
′
p,mp
)。k
rr,mp
数据可从文献中查询获得;可利用竞争动力学法实验测得以及建立定量构效关系(qsar)模型预测获得。
[0005]
实际水体中的有机质、无机离子等会与目标污染物竞争自由基,因而对uv
‑
aops效能产生重要影响。不同水体的竞争能力不同,对k
′
p,mp
的影响也不同,单纯的模型模拟不能将水背景基质的影响考虑进去,因此采用一个综合参数表征水背景基质竞争自由基的能力,并能够现场简单测定以耦合入模型中预测k
′
p,mp
,具有重要意义。
技术实现要素:
[0006]
本发明的目的是提供一种实际水体紫外高级氧化工艺中有机污染物降解速率的预测方法,使用本发明提供的方法时,利用便携式仪器在现场通过简单实验测量获得实际水体的自由基反应容量,利用qsar模型获得目标污染物与自由基的二级反应速率常数(k
rr,mp
),并将这两个参数输入到模型中即可获得目标污染物在实际水体中的降解速率。
[0007]
本发明提供的一种实际水体uv
‑
aops中有机污染物降解速率的预测方法,包括如下步骤:
[0008]
(1)利用水基质替代物质模拟背景水体成分,将探针分别加入到至少三种不同浓度水基质替代物质的水溶液中,得到模拟水体初始体系;利用uv
‑
aops对所述模拟水体初始体系进行降解并测定降解过程中探针的浓度,计算探针的降解速率,得到不同浓度水基质替代物质的水溶液中探针的降解速率;
[0009]
以所述不同浓度的水基质替代物质的水溶液的自由基反应容量为横坐标,以所述不同浓度的水基质替代物质的水溶液的探针的降解速率的倒数为纵坐标,制作标准曲线;
[0010]
(2)将所述探针加入到实际水样中,得到实际水体初始体系;在与步骤(1)相同的条件下,利用所述uv
‑
aops现场对所述实际水样初始体系进行降解并测定降解过程中探针的浓度,计算探针的降解速率,得到实际水体的探针的降解速率;
[0011]
根据所述实际水体的探针的降解速率和步骤(1)获得的标准曲线,得到实际水体背景基质的自由基反应容量;
[0012]
(3)根据步骤(2)获得的所述实际水体背景基质的自由基反应容量,结合目标污染物与自由基的二级反应速率常数,即可预测所述实际水体uv
‑
aops中有机污染物降解速率。
[0013]
根据本发明的实施方案,步骤(1)和步骤(2)中所述uv
‑
aops可为uv/h2o2工艺、uv/cl2工艺和uv/s2o
82
‑
工艺中的任一种;
[0014]
所述不同浓度的水基质替代物质的水溶液的自由基反应容量可为下述a1)
‑
a3)中的任一种:
[0015]
a1)所述uv
‑
aops工艺为uv/h2o2工艺时,以所述水基质替代物质与ho
·
的二级反应速率常数与所述水基质替代物质的浓度的乘积为ho
·
反应容量,计算所述不同浓度水基质替代物质的水溶液的ho
·
反应容量;
[0016]
a2)所述uv
‑
aops工艺为uv/cl2工艺时,加入硝基苯做ho
·
掩蔽剂,以所述水基质替代物质与cl
·
的二级反应速率常数与所述水基质替代物质的浓度的乘积为cl
·
反应容量,计算所述不同浓度水基质替代物质的水溶液的cl
·
反应容量;
[0017]
a3)所述uv
‑
aops工艺为uv/s2o
82
‑
工艺时,加入硝基苯做ho
·
掩蔽剂,以所述水基质替代物质与so4·
‑
的二级反应速率常数与所述水基质替代物质的浓度的乘积为so4·
‑
反应容量,计算所述不同浓度水基质替代物质的水溶液的so4·
‑
反应容量。
[0018]
根据本发明的实施方案,步骤(1)和步骤(2)中优选利用细管流紫外反应器(mfps)进行所述降解;
[0019]
步骤(1)和步骤(2)中优选利用分光光度计测定所述探针的浓度;
[0020]
作为实例,以细管流紫外反应器(mfps)和串联的分光光度计进行降解和测量。
[0021]
根据本发明的实施方案,步骤(1)中所述水基质替代物质可为异丙醇(ipa)、对氯苯甲酸(p
‑
cba)和苯甲酸(ba)中的任一种;
[0022]
步骤(1)和步骤(2)中所述探针可为亚甲基蓝。
[0023]
进一步地,所述紫外高级氧化工艺为uv/h2o2工艺;作为实例,以ipa为水基质替代物质,所述不同浓度水基质替代物质的水溶液的浓度为0~320μm;以p
‑
cba为水基质替代物质,所述不同浓度水基质替代物质的水溶液的浓度为0~20μm;
[0024]
所述紫外高级氧化工艺为uv/cl2工艺;作为实例,以ba为水基质替代物质,所述不同浓度水基质替代物质的水溶液的浓度为0~80μm;
[0025]
所述紫外高级氧化工艺为uv/s2o
82
‑
工艺;作为实例,以ba为水基质替代物质,所述
不同浓度水基质替代物质的水溶液的浓度为0~40μm。
[0026]
更进一步地,作为实例,所述uv/h2o2工艺的条件如下:h2o2的投加浓度为25mg l
‑1;探针的投加浓度为5mg l
‑1;降解温度为25℃。
[0027]
作为实例,所述uv/cl2工艺的条件如下:cl2的投加浓度为5mg l
‑1;探针的投加浓度为5μmol l
‑1;降解温度为25℃;硝基苯的投加浓度为0.5mm;
[0028]
作为实例,所述uv/s2o
82
‑
工艺的条件如下:s2o
82
‑
的投加浓度为200mg l
‑1;探针的投加浓度为5μmol l
‑1;降解温度为25℃;硝基苯的投加浓度为0.5mm。
[0029]
本发明中,步骤(1)和步骤(2)中所述探针的降解速率通过如下步骤获得:以降解时间t为横坐标,以ln(c
t
/c0)为纵坐标,其中c
t
表示时刻t的探针浓度,c0表示初始时刻探针浓度,制作ln(c
t
/c0)与t的关系曲线,所述关系曲线的斜率即为所述降解速率k
′
p,mb
。
[0030]
本发明中,所述水基质替代物质与ho
·
的二级反应速率常数、所述水基质替代物质与cl
·
的二级反应速率常数和所述水基质替代物质与so4·
‑
的二级反应速率常数均可从文献中获得。
[0031]
本发明中,步骤(2)中的各操作条件与步骤(1)相同,包括但不限于:uv
‑
aops具体工艺的选择、探针的投加浓度、uv
‑
aops工艺的条件如氧化剂的投加浓度、降解温度和降解过程中探针浓度的测定方法等。
[0032]
本发明中,所述有机污染物可为磺胺二甲基嘧啶(smn)、卡马西平(cbz)和咖啡因(caf)中的至少一种。
[0033]
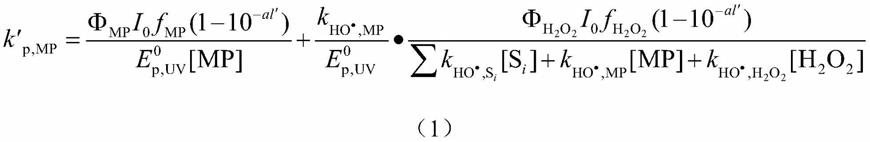
根据本发明的实施方案,步骤(3)中可利用光化学模型、自由基稳态假设模型和qsar模型实现所述预测。具体地,根据公式和步骤(2)获得的自由基反应容量,即可计算得到实际水体紫外高级氧化工艺中有机污染物降解速率;所述公式由光化学模型和自由基稳态假设模型获得;所述公式中的目标污染物与自由基的二级反应速率常数k
rr,mp
(如)由qsar模型获得。
[0034]
作为实例,所述公式为下述b1)
‑
b3)中的任一种:
[0035]
b1)所述uv
‑
aops工艺为uv/h2o2工艺时,公式如下:
[0036][0037]
其中,φ
mp
表示目标污染物光解的量子产率,单位为mol einstein
‑1;i
o
表示入射的紫外光子通量率,单位为einstein l
‑1s
‑1;f
mp
表示目标污染物的光子吸收系数,无单位;a表示光子吸收系数,单位为cm
‑1;l’表示有效光程,单位为cm;e
0p,uv
表示光辐照强度,单位为einstein m
‑2s
‑1;[mp]表示目标污染物初始浓度,单位为mol l
‑1;[h2o2]表示氧化剂h2o2的初始浓度,单位为mol l
‑1;表示uv/h2o2工艺中ho
·
的量子产率,单位为mol einstein
‑1;表示h2o2的光子吸收系数,无单位;表示ho
·
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示ho
·
与h2o2的二级反应速率常数,单位为l mol
‑1s
‑1;[s
i
]表示水体中第i个背景物质的浓度,单位为mol l
‑1;表示ho
·
与s
i
的二级反应速率
常数,单位为l mol
‑1s
‑1;即为步骤(2)测得的实际水体ho
·
反应容量,单位为s
‑1;
[0038]
b2)所述uv
‑
aops工艺为uv/cl2工艺时,公式如下:
[0039][0040]
其中,φ
hocl
表示uv/cl2工艺中hocl的量子产率,单位为mol einstein
‑1;表示uv/cl2工艺中ocl
‑
的量子产率,单位为mol einstein
‑1;f
hocl
表示hocl的光子吸收系数,无单位;表示ocl
‑
的光子吸收系数,无单位;表示ho
·
与hocl的二级反应速率常数,单位为l mol
‑1s
‑1;表示ho
·
与ocl
‑
的二级反应速率常数,单位为l mol
‑1s
‑1;表示cl
·
与目标污染物的二级反应速率常数,单位为lmol
‑1s
‑1;表示cl
·
与hocl的二级反应速率常数,单位为l mol
‑1s
‑1;表示cl
·
与ocl
‑
的二级反应速率常数,单位为l mol
‑1s
‑1;[hocl]表示hocl的初始浓度,单位为mol l
‑1;[ocl
‑
]表示ocl
‑
的初始浓度,单位为mol l
‑1;表示cl
·
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤(2)测得的实际水体cl
·
反应容量,单位为s
‑1;φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]、[s
i
]、]、表示的含义同公式(1);
[0041]
b3)所述uv
‑
aops工艺为uv/s2o
82
‑
工艺时,公式如下:
[0042][0043]
其中,表示uv/s2o
82
‑
工艺中s2o
82
‑
的量子产率,单位为mol einstein
‑1;表示s2o
82
‑
的光子吸收系数,无单位;表示so4·
‑
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示so4·
‑
与s2o
82
‑
的二级反应速率常数,单位为l mol
‑1s
‑1;表示so4·
‑
与氢氧根离子的二级反应速率常数,单位为l mol
‑1s
‑1;表示so4·
‑
与水的二级反应速率常数,单位为l mol
‑1s
‑1;[s2o
82
‑
]表示过二硫酸盐
的初始浓度,单位为mol l
‑1;[oh
‑
]表示氢氧根离子的初始浓度,单位为mol l
‑1;[h2o]表示水的浓度,单位为mol l
‑1;表示so4·
‑
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示ho
·
与s2o
82
‑
的二级反应速率常数,单位为l mol
‑1s
‑1;表示so4·
‑
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤(2)测得的实际水体so4·
‑
反应容量,单位为s
‑1;φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]、[s
i
]、表示的含义同公式(1)。
[0044]
本发明具有如下有益效果:
[0045]
本发明利用便携式仪器现场测定实际水体的自由基反应容量,并与模型模拟结合,更加准确地预测了uv
‑
aops过程中目标污染物在实际水体中的降解速率,解决了水样运输困难、现场缺乏先进仪器等问题,对实际水处理工程中去除污染物的初步评价具有重要意义。
附图说明
[0046]
为了更清楚地说明本技术实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0047]
图1为本发明实施例提供的测量背景水体自由基反应容量的方法原理示意图。
[0048]
图2为本发明实施例提供的预测实际水体uv
‑
aops处理中有机污染物的降解速率的方法示意图。
[0049]
图3为本发明实施例1提供的ho
·
反应容量标准曲线(a)和测得的七种水体的ho
·
反应容量(b)。
[0050]
图4为本发明实施例1提供的七种实际水体中uv/h2o2工艺处理中目标有机污染物降解速率的预测及实验验证。
[0051]
图5为本发明实施例2提供的cl
·
反应容量标准曲线(a)和测得的八种水体的cl
·
反应容量(b)。
[0052]
图6为本发明实施例2提供的八种实际水体中uv/cl2工艺处理中目标有机污染物降解速率的预测及实验验证。
[0053]
图7为本发明实施例3提供的so4·
‑
反应容量标准曲线(a)和测得的八种水体的so4·
‑
反应容量(b)。
[0054]
图8为本发明实施例3提供的七种实际水体中uv/s2o
82
‑
工艺处理中目标有机污染物降解速率的预测及实验验证。
具体实施方式
[0055]
图1为本发明实施例提供的测量背景水体自由基反应容量的方法原理示意图。图2为本发明实施例提供的预测实际水体uv
‑
aops处理中有机污染物的降解速率的方法示意图。如图所示,本发明实际水体uv
‑
aops中有机污染物降解速率的预测方法包括如下步骤:
[0056]
(1)利用水基质替代物质模拟背景水体成分,将探针分别加入到至少三种不同浓
度水基质替代物质的水溶液中,得到模拟水体初始体系;利用uv
‑
aops对所述模拟水体初始体系进行降解并测定降解过程中探针的浓度,计算探针的降解速率,得到不同浓度水基质替代物质的水溶液的探针的降解速率;
[0057]
以所述不同浓度的水基质替代物质的水溶液的自由基反应容量为横坐标,以所述不同浓度的水基质替代物质的水溶液的探针的降解速率的倒数为纵坐标,制作标准曲线;
[0058]
(2)将所述探针加入到实际水样中,得到实际水体初始体系;在与步骤(1)相同的条件下,利用所述的uv
‑
aops现场对所述实际水样初始体系进行降解并测定降解过程中探针的浓度,计算探针的降解速率,得到实际水体的探针的降解速率;
[0059]
根据所述实际水体的探针的降解速率和步骤(1)获得的标准曲线,得到实际水体背景基质的自由基反应容量;
[0060]
(3)根据步骤(2)获得的所述实际水体背景基质的自由基反应容量,结合目标污染物与自由基的二级反应速率常数,即可预测所述实际水体中uv
‑
aops处理中有机污染物的降解速率。
[0061]
在本发明的具体实施例中,所述uv
‑
aops为uv/h2o2工艺、uv/cl2工艺和uv/s2o
82
‑
工艺中的任一种;
[0062]
所述不同浓度的水基质替代物质的水溶液的自由基反应容量为下述a1)
‑
a3)中的任一种:
[0063]
a1)所述uv
‑
aops工艺为uv/h2o2工艺时,以所述水基质替代物质与ho
·
的二级反应速率常数与所述水基质替代物质的浓度的乘积为ho
·
反应容量,计算所述不同浓度水基质替代物质的水溶液的ho
·
反应容量;
[0064]
a2)所述uv
‑
aops工艺为uv/cl2工艺时,加入硝基苯做ho
·
掩蔽剂,以所述水基质替代物质与cl
·
的二级反应速率常数与所述水基质替代物质的浓度的乘积为cl
·
反应容量,计算所述不同浓度水基质替代物质的水溶液的cl
·
反应容量;
[0065]
a3)所述uv
‑
aops工艺为uv/s2o
82
‑
工艺时,加入硝基苯做ho
·
掩蔽剂,以所述水基质替代物质与so4·
‑
的二级反应速率常数与所述水基质替代物质的浓度的乘积为so4·
‑
反应容量,计算所述不同浓度水基质替代物质的水溶液的so4·
‑
反应容量;
[0066]
在本发明的一个实施例中,uv
‑
aops工艺为uv/h2o2工艺,以ipa为水基质替代物质,水基质替代物质与ho
·
的二级反应速率常数(buxton,g.v.,greenstock,c.l.,helman,w.p.,ross,a.b.,1988.critical review of rate constants for reactions of hydrated electrons,hydrogen atoms and hydroxyl radicals(
·
oh/
·
o
‑
)in aqueous solution.j.phys.chem.17(2),513
‑
886.);以p
‑
cba为水基质替代物质时,水基质替代物质与ho
·
的二级反应速率常数(buxton,g.v.,greenstock,c.l.,helman,w.p.,ross,a.b.,1988.critical review of rate constants for reactions of hydrated electrons,hydrogen atoms and hydroxyl radicals(
·
oh/
·
o
‑
)in aqueous solution.j.phys.chem.17(2),513
‑
886.)。
[0067]
在本发明的另一个实施例中,uv
‑
aops工艺为uv/cl2工艺,以ba为水基质替代物质,水基质替代物质与cl
·
的二级反应速率常数(fang,
j.y.,fu,y.,shang,c.,2014.the roles of reactive species in micropollutant degradation in the uv/free chlorine system.environ.sci.technol.48(3),1859
‑
1868.)。
[0068]
在本发明的再一个实施例中,uv
‑
aops工艺为uv/s2o
82
‑
工艺,以ba为水基质替代物质,水基质替代物质与so4·
‑
的二级反应速率常数(xie,p.c.,ma,j.,liu,w.,zou,j.,yue,s.y.,li,x.c.,wiesner,m.r.,fang,j.y.,2015.removal of 2
‑
mib and geosmin using uv/persulfate:contributions of hydroxyl and sulfate radicals.water res.69,223
‑
233.)。
[0069]
根据公式和步骤(2)获得的自由基反应容量,即可计算得到实际水体uv
‑
aops中有机污染物降解速率;
[0070]
所述公式由光化学模型和自由基稳态假设模型获得;所述公式中的目标污染物与自由基的二级反应速率常数k
rr,mp
(如)由qsar模型获得。所述qsar模型可参照sudhakaran,s.,amy,g.l.,2013.qsar models for oxidation of organic micropollutants in water based on ozone and hydroxyl radical rate constants and their chemical classification.water res.47(3),1111
‑
1122.和jin,x.h.,peldszus,s.,huck,p.m.,2015.predicting the reaction rate constants of micropollutants with hydroxyl radicals in water using qspr modeling.chemosphere 138,1
‑
9.中公开的方法获得,具体步骤如下:建立有机物描述符与k
rr,mp
之间的线性方程,由所得的多元线性回归方程和目标污染物的描述符即可预测目标污染物与自由基的二级反应速率常数。
[0071]
在本发明的具体实施例中,所述公式为下述b1)
‑
b3)中的任一种:
[0072]
b1)所述uv
‑
aops工艺为uv/h2o2工艺时,公式如下:
[0073][0074]
其中,φ
mp
表示目标污染物光解的量子产率,单位为mol einstein
‑1;i
o
表示入射的紫外光子通量率,单位为einstein l
‑1s
‑1;f
mp
表示目标污染物的光子吸收系数,无单位;a表示光子吸收系数,单位为cm
‑1;l’表示有效光程,单位为cm;e
0p,uv
表示光辐照强度,单位为einstein m
‑2s
‑1;[mp]表示目标污染物初始浓度,单位为mol l
‑1;[h2o2]表示氧化剂h2o2的初始浓度,单位为mol l
‑1;表示uv/h2o2工艺中ho
·
的量子产率,单位为mol einstein
‑1;表示h2o2的光子吸收系数,无单位;表示ho
·
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示ho
·
与h2o2的二级反应速率常数,单位为l mol
‑1s
‑1;[s
i
]表示水体中第i个背景物质的浓度,单位为mol l
‑1;表示ho
·
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤2测得的实际水体ho
·
反应容量,单位为s
‑1。
[0075]
b2)所述uv
‑
aops工艺为uv/cl2工艺时,公式如下:
mol
‑1s
‑1;表示ho
·
与s2o
82
‑
的二级反应速率常数,单位为l mol
‑1s
‑1;表示so4·
‑
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤2测得的实际水体so4·
‑
反应容量,单位为s
‑1;φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]、[s
i
]、表示的含义同公式(1)。
[0081]
在本发明的一个实施例中,所述有机物污染物降解速率根据光化学模型、自由基稳态假设模型和qsar模型通过如下过程预测得到;
[0082]
污染物降解速率(k
′
p,mp
,m
2 einstein
‑1)由直接的光降解速率(k
′
d,mp
,m
2 einstein
‑1)和间接的自由基氧化速率组成(k
′
i,mp
,m
2 einstein
‑1),如公式(10)所示。
[0083]
k
′
p,mp
=k
′
d,mp
+k
′
i,mp
ꢀꢀꢀꢀꢀ
(10)
[0084]
光化学模型如下:
[0085]
k
′
d,mp
由下式计算:
[0086][0087]
公式(11)中,φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]表示的含义同公式(1)。
[0088]
在uv/h2o2过程中,ho
·
形成速率(mol l
‑1s
‑1)如下式所示:
[0089][0090]
公式(12)中,i
o
、a、l'、表示的含义同公式(1)。
[0091]
自由基稳态假设模型如下:
[0092]
假设uv/h2o2中高反应活性的自由基一旦生成便很快被消耗,消耗速率远大于生成速率。在这个假设下,自由基浓度的变化可以忽略不计,即自由基达到伪稳态浓度,即k
′
i,mp
符合伪一级动力学方程:
[0093][0094]
公式(13)中,[ho
·
]
ss
表示稳态ho
·
浓度,单位为mol l
‑1;e
0p,uv
、表示的含义同公式(1)。
[0095]
[ho
·
]
ss
可由下式表达:
[0096][0097]
公式(14)中,表示的含义同公式(12);[mp]、[h2o2]、[s
i
]、表示的含义同公式(1)。
[0098]
qsar模型如下:
[0099]
qsar模型可以建立有机物描述符与k
rr,mp
之间的线性方程,由所得的多元线性回归方程和目标污染物的描述符即可预测目标污染物与自由基的二级反应速率常数。首先通过chembio3d ultra 12.0软件利用mm2方法优化分子构型,然后利用gaussian 09w软件通过密度泛函理论(b3lyp泛函和6
‑
31+g(d,p)基组)进行分子构型再优化以获得最稳定的构型,
同时计算得到分子的量子化学描述符。最后利用spss软件进行相关性分析、主成分分析和多元线性回归,建立分子描述符与k
rr,mp
的线性关系。结果为:其中表示ho
·
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;#c表示分子中的碳原子个数,无单位;e
homo
表示最高占据分子轨道能量,单位为ev;#acid表示分子中羧酸官能团的数目,无单位;#o:c表示分子中氧碳原子数之比,无单位。
[0100]
综上所述,如图2所示,利用光化学模型计算获得k
′
d,mp
和利用qsar模型获得利用图1所示便携式测量方法获得实际水体的ho
·
反应容量即结合k
′
d,mp
、和代入自由基稳态模型中获得uv/h2o2过程的稳态自由基浓度[ho
·
]
ss
,即可预测目标污染物的降解速率。最终公式如下:
[0101][0102]
其中,φ
mp
表示目标污染物光解的量子产率,单位为mol einstein
‑1;i
o
表示入射的紫外光子通量率,单位为einstein l
‑1s
‑1;f
mp
表示目标污染物的光子吸收系数,无单位(计算方法见li,m.k.,li,w.t.,wen,d.,bolton,j.r.,blatchley iii,e.r.,qiang,z.m.,2019.micropollutant degradation by the uv/h2o
2 process:kinetic comparison among various radiation sources.environ.sci.technol.53(9),5241
–
5248.);a表示光子吸收系数,单位为cm
‑1;l’表示有效光程,单位为cm;e
0p,uv
表示光辐照强度,单位为einstein m
‑2s
‑1,本实验测得为3.98
×
10
‑4einstein m
‑2s
‑1(测试方法见li,m.k.,qiang,z.m.,hou,p.,bolton,j.r.,qu,j.h.,li,p.,wang,c.,2016.vuv/uv/chlorine as an enhanced advanced oxidation process for organic pollutant removal from water:assessment with a novel mini
‑
fluidic vuv/uv photoreaction system(mvps).environ.sci.technol.50(11),5849
‑
5856.);[mp]表示目标污染物初始浓度,单位为mol l
‑1;[h2o2]表示氧化剂h2o2的初始浓度,单位为mol l
‑1;表示uv/h2o2工艺中ho
·
的量子产率,单位为mol einstein
‑1;表示h2o2的光子吸收系数,无单位;表示ho
·
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示ho
·
与h2o2的二级反应速率常数,为2.7
×
107l mol
‑1s
‑1(grebel,j.e.,pignatello,j.j.,mitch,w.a.,2010.effect of halide ions and carbonates on organic contaminant degradation by hydroxyl radical
‑
based advanced oxidation processes in saline waters.environ.sci.technol.44(17),6822
‑
6828.);[s
i
]表示水体中第i个背景物质的浓度,单位为mol l
‑1;表示ho
·
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤(2)测得的实际水体ho
·
反应容量,单位为s
‑1。
[0103]
在本发明的另一个实施例中,所述有机物污染物降解速率根据光化学模型、自由基稳态假设模型和qsar模型通过如下过程预测得到;
[0104]
k
′
p,mp
=k
′
d,mp
+k
′
i,mp
ꢀꢀꢀꢀꢀꢀꢀꢀ
(20)(同公式10)
[0105]
光化学模型如下:
[0106]
k
′
d,mp
由下式计算:
[0107][0108]
公式(21)中,φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]表示的含义同公式(1)。
[0109]
在uv/cl2过程中,ho
·
形成速率(mol l
‑1s
‑1)如下式所示:
[0110][0111]
公式(22)中,i
o
、a、l'、表示的含义同公式(1)。
[0112]
cl
·
形成速率(mol l
‑1s
‑1)如下式所示
[0113][0114]
公式(23)中,φ
hocl
、f
hocl
、i
o
、a、l’表示的含义同公式(2)。
[0115]
自由基稳态假设模型如下:
[0116]
假设uv/cl2中高反应活性的自由基一旦生成便很快被消耗,消耗速率远大于生成速率。在这个假设下,自由基浓度的变化可以忽略不计,即自由基达到伪稳态浓度,即k
′
i,mp
符合伪一级动力学方程:
[0117][0118]
公式(24)中,[ho
·
]
ss
表示稳态ho
·
浓度,单位为mol l
‑1;[cl
·
]
ss
表示稳态cl
·
浓度,单位为mol l
‑1;e
0p,uv
、表示的含义同公式(2)。
[0119]
[ho
·
]
ss
可由下式表达:
[0120][0121]
公式(25)中,表示的含义同公式(22);[hocl]、[ocl
‑
]、[mp]、[s
i
]、表示的含义同公式(2)。
[0122]
[cl
·
]
ss
可由下式表达:
[0123][0124]
公式(26)中,表示的含义同公式(23);[hocl]、[ocl
‑
]、[mp]、[s
i
]表示的含义同公式(2)。
[0125]
qsar模型如下:
[0126]
qsar模型建立过程同上所述,结果为:qsar模型建立过程同上所述,结果为:其中表示cl
·
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;#nonhatoms表示
分子中的非氢原子个数,无单位;ea表示电子亲和能,单位为ev;#h:c表示分子中氢碳原子数之比,无单位;#acid表示分子中羧酸官能团的数目,无单位。
[0127]
综上所述,如图2所示,利用光化学模型计算获得k
′
d,mp
、和利用qsar模型获得利用图1所示便携式测量方法获得实际水体的ho
·
反应容量即和cl
·
反应容量即结合k
′
d,mp
、和代入自由基稳态模型中获得uv/cl2过程的稳态自由基浓度[ho
·
]
ss
和[cl
·
]
ss
即可预测目标污染物的降解速率。最终公式如下:
[0128][0129]
其中,φ
hocl
表示uv/cl2工艺中hocl的量子产率,单位为mol einstein
‑1;表示uv/cl2工艺中ocl
‑
的量子产率,单位为mol einstein
‑1;f
hocl
表示hocl的光子吸收系数,无单位;表示ocl
‑
的光子吸收系数,无单位;表示ho
·
与hocl的二级反应速率常数,为2.0
×
109l mol
‑1s
‑1;表示ho
·
与ocl
‑
的二级反应速率常数,为8.8
×
109l mol
‑1s
‑1;表示cl
·
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示cl
·
与hocl的二级反应速率常数,为3.0
×
109l mol
‑1s
‑1;表示cl
·
与ocl
‑
的二级反应速率常数,为8.2
×
109l mol
‑1s
‑1(均参考fang,j.y.,fu,y.,shang,c.,2014.the roles of reactive species in micropollutant degradation in the uv/free chlorine system.environ.sci.technol.48(3),1859
‑
1868.);[hocl]表示hocl的初始浓度,单位为mol l
‑1;[ocl
‑
]表示ocl
‑
的初始浓度,单位为mol l
‑1;表示cl
·
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤(2)测得的实际水体cl
·
反应容量,单位为s
‑1;φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]、[s
i
]、表示的含义同公式(1)。
[0130]
在本发明的再一个实施例中,所述有机物污染物降解速率根据光化学模型、自由基稳态假设模型和qsar模型通过如下过程预测得到;
[0131]
k
′
p,mp
=k
′
d,mp
+k
′
i,mp
ꢀꢀꢀꢀꢀꢀ
(30)(同公式10)
[0132]
光化学模型如下:
[0133]
k
′
d,mp
由下式计算:
[0134][0135]
公式(31)中,φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]表示的含义同公式(1)。
[0136]
在uv/s2o
82
‑
过程中,so4·
‑
形成速率(mol l
‑1s
‑1)如下式所示
[0137][0138]
公式(32)中,i
o
、a、l’表示的含义同公式(3)。
[0139]
ho
·
形成速率(mol l
‑1s
‑1)如下式所示:
[0140][0141]
公式(33)中,[so4·
‑
]
ss
表示uv/s2o
82
‑
过程中so4·
‑
稳态浓度,单位为mol l
‑1;[oh
‑
]、[h2o]表示的含义同公式(3)。
[0142]
自由基稳态假设模型如下:
[0143]
假设uv/s2o
82
‑
中高反应活性的自由基一旦生成便很快被消耗,消耗速率远大于生成速率。在这个假设下,自由基浓度的变化可以忽略不计,即自由基达到伪稳态浓度,即k
′
i,mp
符合伪一级动力学方程:
[0144][0145]
公式(34)中,[ho
·
]
ss
表示稳态ho
·
浓度,单位为mol l
‑1;[so4·
‑
]
ss
表示稳态so4·
‑
浓度,单位为mol l
‑1;e
0p,uv
、表示的含义同公式(3)。
[0146]
[so4·
‑
]
ss
可由下式表达:
[0147][0148]
公式(35)中,表示的含义同公式(32);表示的含义同公式(32);[s2o
82
‑
]、[oh
‑
]、[h2o]、[s
i
]表示的含义同公式(3)。
[0149]
[ho
·
]
ss
可由下式表达:
[0150][0151]
公式(36)中,表示的含义同公式(33);[mp]、[s2o
82
‑
]、[s
i
]、表示的含义同公式(1)。
[0152]
qsar模型如下:
[0153]
qsar模型建立过程同上所述,结果为:qsar模型建立过程同上所述,结果为:其中表示so4·
‑
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;#o:c表示分子中氧碳原子数之比,无单位;hlg表示最低占据分子轨道能量与最高占据分子轨道能量的差值,单位为ev。
[0154]
综上所述,如图2所示,利用光化学模型计算获得k
′
d,mp
、和利用qsar模型获得利用图1所示便携式测量方法获得实际水体的ho
·
反应容量即∑
和so4·
‑
反应容量即结合k
′
d,mp
、和代入自由基稳态模型中获得uv/s2o
82
‑
过程的稳态自由基浓度[ho
·
]
ss
和[so4·
‑
]
ss
即可预测目标污染物的降解速率。最终公式如下:
[0155][0156]
其中,表示uv/s2o
82
‑
工艺中s2o
82
‑
的量子产率,单位为mol einstein
‑1;表示s2o
82
‑
的光子吸收系数,无单位(计算方法见xie,p.c.,ma,j.,liu,w.,zou,j.,yue,s.y.,li,x.c.,wiesner,m.r.,fang,j.y.,2015.removal of 2
‑
mib and geosmin using uv/persulfate:contributions of hydroxyl and sulfate radicals.water res.69,223
‑
233.);表示so4·
‑
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示so4·
‑
与s2o
82
‑
的二级反应速率常数,为5.5
×
105l mol
‑1s
‑1;表示so4·
‑
与氢氧根离子的二级反应速率常数,为6.5
×
107l mol
‑1s
‑1;表示so4·
‑
与水的二级反应速率常数,为8.3l mol
‑1s
‑1;[s2o
82
‑
]表示过二硫酸盐的初始浓度,单位为mol l
‑1;[oh
‑
]表示氢氧根离子的初始浓度,单位为mol l
‑1;[h2o]表示水的浓度,单位为mol l
‑1;表示so4·
‑
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示ho
·
与s2o
82
‑
的二级反应速率常数,为1.4
×
107l mol
‑1s
‑1(均参考xie,p.c.,ma,j.,liu,w.,zou,j.,yue,s.y.,li,x.c.,wiesner,m.r.,fang,j.y.,2015.removal of 2
‑
mib and geosmin using uv/persulfate:contributions of hydroxyl and sulfate radicals.water res.69,223
‑
233.);表示so4·
‑
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤(2)测得的实际水体so4·
‑
反应容量,单位为s
‑1;φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]、[s
i
]、表示的含义同公式(1)。
[0157]
通过本发明方法可实现在现场简单测量水体自由基反应容量,不需要水样远距离运输,不需要qcba和先进仪器的支持;且减少了冗杂的实验手段,通过模拟获得了污染物的降解速率。
[0158]
下面以异丙醇(ipa)、对氯苯甲酸(p
‑
cba)或苯甲酸(ba)为水基质替代物质,亚甲基蓝(mb)为探针,以细管流紫外反应器(mfps)和串联的分光光度计进行便携式测量以确定实际水体的自由基反应容量,分别以uv/h2o2工艺、uv/cl2工艺和uv/s2o
82
‑
工艺为具体实施例对本发明进行详细说明。
[0159]
下述实施例中,细管流紫外反应器(mfps)的仪器参数如下:光源为冷阴极低压汞灯,可同时发出185nm vuv和254nm uv的紫外光束,在平行于低压汞灯的等距离处安装有含
钛的石英玻璃直管,能透射254nm uv,紫外光强度为3.98
×
10
‑4einstein m
‑2s
‑1。利用分光光度计测定探针浓度的具体步骤如下:水样由蠕动泵经由软管输送至uv管中接受辐照,利用串联的紫外可见分光光度计,在664nm处测定mb的吸光度变化。li,m.k.,qiang,z.m.,hou,p.,bolton,j.r.,qu,j.h.,li,p.,wang,c.,2016.vuv/uv/chlorine as an enhanced advanced oxidation process for organic pollutant removal from water:assessment with a novel mini
‑
fluidic vuv/uv photoreaction system(mvps).environ.sci.technol.50(11),5849
‑
5856.中记载有该细管流紫外反应器。
[0160]
实施例1、测量不同实际水体的自由基反应容量以及实际水体uv/h2o2工艺处理中有机污染物降解速率预测及实验验证
[0161]
(1)利用水基质替代物质ipa或p
‑
cba模拟背景水体成分,将探针mb分别加入到[ipa]0=0,10,20,40,60,80,160,320μm或[p
‑
cba]0=0,5.0,10,15,20μm的不同浓度的水基质替代物质的水溶液中,探针[mb]0=5mg l
‑1,得到模拟水体初始体系;利用uv/h2o2(mfps作光反应器,[h2o2]0=25mg l
‑1,紫外光强度为3.98
×
10
‑4einstein m
‑2s
‑1,水循环温度为25℃)工艺对模拟水体初始体系进行降解,用分光光度计测量降解过程中mb在不同浓度水基质替代物质溶液中的浓度,其降解符合伪一级动力学,做ln(c
t
/c0)
‑
t图可得到降解速率k
′
p,mb
(曲线斜率即为k
′
p,mb
),得到不同浓度水基质替代物质的水溶液的探针的降解速率;
[0162]
以水基质替代物质与ho
·
的二级反应速率常数与相应水基质替代物质的浓度的乘积为ho
·
反应容量计算不同浓度水基质替代物质的水溶液的自由基反应容量;
[0163]
以不同浓度的水基质替代物质的水溶液的ho
·
反应容量为横坐标,以不同浓度的水基质替代物质的水溶液的探针的降解速率的倒数为纵坐标,制作标准曲线,实验结果如图3(a)所示。
[0164]
(2)将探针加入到实际水样中,共测量七种水体的ho
·
反应容量,分别为milli
‑
q超纯水(up);用up制备的人工配水1(sw1,doc=1.0mg l
‑1)和人工配水2(sw2,doc=5.0mg l
‑1);江苏盐城饮用水处理厂:原水(rw1)和砂滤池出水(sf);江苏常州农村地区小规模供水设备:原水(rw2)和硫酸铁絮凝+超滤出水(pfs/uf),得到不同水样的实际水体初始体系;
[0165]
在与步骤(1)相同的条件下,利用uv/h2o2工艺现场对实际水样初始体系进行降解并测定降解过程中探针mb的浓度,计算探针mb的降解速率,得到mb在在七种水体中的降解速率k
′
p,mb
;
[0166]
根据七种水体的探针的降解速率和标准曲线,得到七种水体背景基质的ho
·
反应容量,测量结果如图3(b)所示。ho
·
反应容量值越高,说明水体背景具有越高的ho
·
竞争能力,对目标污染物的降解速率影响越大。
[0167]
(3)利用光化学模型、自由基稳态假设模型和qsar模型,根据公式(1)和七种实际水体背景基质的ho
·
反应容量,得到七种实际水体中uv/h2o2工艺处理中模型污染物磺胺二甲基嘧啶smn([smn]0=0.10mg l
‑1)在uv/h2o2([h2o2]0=5,15,25mg l
‑1)工艺中的降解速率。
[0168]
[0169][0170]
其中,φ
smn
表示smn光解的量子产率,单位为mol einstein
‑1;i
o
表示入射的紫外光子通量率,单位为einstein l
‑1s
‑1;f
mp
表示目标污染物的光子吸收系数,无单位;a表示光子吸收系数,单位为cm
‑1;l’表示有效光程,单位为cm;e
0p,uv
表示光辐照强度,单位为einstein m
‑2s
‑1;[smn]表示目标污染物初始浓度,单位为mol l
‑1;[h2o2]表示氧化剂h2o2的初始浓度,单位为mol l
‑1;表示uv/h2o2工艺中ho
·
的量子产率,单位为mol einstein
‑1;表示h2o2的光子吸收系数,无单位;k
ho
·
,smn
表示ho
·
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示ho
·
与h2o2的二级反应速率常数,单位为l mol
‑1s
‑1;[s
i
]表示水体中第i个背景物质的浓度,单位为mol l
‑1;表示ho
·
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤2测得的实际水体ho
·
反应容量,单位为s
‑1。
[0171]
本实施例中,公式(1)中,各数值如下:φ
smn
=0.005mol einstein
‑1;i
o
=8.66
×
10
‑5einstein l
‑1s
‑1;l’=0.46cm;e
0p,uv
=3.98
×
10
‑4einstein m
‑2s
‑1;[smn]=3.59
×
10
‑7mol l
‑1;[h2o2]=1.5,4.4,7.4
×
10
‑4mol l
‑1;;
[0172]
通过实验测定其在uv/h2o2工艺中的实际降解速率,与模型预测结果作比较,如图4所示,结果表明,模型与实测结果吻合良好。
[0173]
实施例2、实际水体uv/cl2工艺处理中有机污染物降解速率预测及实验验证按照实施例1中的方法进行试验,试验条件及结果如下:
[0174]
(1)利用水基质替代物质ba模拟背景水体成分,将探针mb分别加入到[ba]0=0,10,20,40,60,80μm的不同浓度的水基质替代物质的水溶液中,加入0.5mm硝基苯以掩蔽ho
·
,探针[mb]0=5μmol l
‑1,得到模拟水体初始体系;利用uv/cl2(mfps作光反应器,[cl2]0=5mg l
‑1,紫外光强度为3.98
×
10
‑4einstein m
‑2s
‑1,水循环温度为25℃)工艺对模拟水体初始体系进行降解,用分光光度计测量降解过程中mb在不同浓度水基质替代物质溶液中的浓度,其降解符合伪一级动力学,做ln(c
t
/c0)
‑
t图可得到降解速率k
′
p,mb
(曲线斜率即为k
′
p,mb
),得到不同浓度水基质替代物质的水溶液的探针的降解速率;
[0175]
以水基质替代物质与cl
·
的二级反应速率常数与相应水基质替代物质的浓度的乘积为cl
·
反应容量计算不同浓度水基质替代物质的水溶液的cl
·
反应容量;
[0176]
以不同浓度的水基质替代物质的水溶液的的cl
·
反应容量为横坐标,以不同浓度的水基质替代物质的水溶液的探针的降解速率的倒数为纵坐标,制作标准曲线,实验结果如图5(a)所示。
[0177]
(2)将探针加入到实际水样中,八种水体分别为:milli
‑
q超纯水(up);江苏盐城饮用水处理厂:原水(rw
‑
y)和砂滤池出水(sf
‑
y);江苏常州农村地区一小规模供水设备:原水(rw
‑
c)、超滤出水(uf
‑
c)和硫酸铁絮凝+超滤出水(pfs/uf
‑
c);北京一市政污水处理厂:初沉池出水(ps
‑
b)和二沉池出水(ss
‑
b),得到不同水样的实际水体初始体系;
[0178]
在与步骤(1)相同的条件下,利用uv/cl2工艺现场对实际水样初始体系进行降解并测定降解过程中探针mb的浓度,计算探针mb的降解速率,得到mb在在八种水体中的降解
速率k
′
p,mb
;
[0179]
根据八种水体的探针的降解速率和标准曲线,得到八种水体背景基质的cl
·
反应容量,测量结果如图5(b)所示。cl
·
反应容量值越高,说明水体背景具有越高的cl
·
竞争能力,对目标污染物的降解速率影响越大。
[0180]
(3)利用光化学模型、自由基稳态假设模型和qsar模型,预测八种水体中模型污染物磺胺二甲及嘧啶smn、卡马西平cbz和咖啡因caf([smn]0,[cbz]0,[caf]0,=0.10mg l
‑1)在uv/cl2([cl2]0=1.0mg l
‑1)工艺中的降解速率。
[0181][0182]
其中,φ
hocl
表示uv/cl2工艺中hocl的量子产率,单位为mol einstein
‑1;φ
ocl
‑
表示uv/cl2工艺中ocl
‑
的量子产率,单位为mol einstein
‑1;f
hocl
表示hocl的光子吸收系数,无单位;表示ocl
‑
的光子吸收系数,无单位;表示ho
·
与hocl的二级反应速率常数,单位为l mol
‑1s
‑1;表示ho
·
与ocl
‑
的二级反应速率常数,单位为l mol
‑1s
‑1;表示cl
·
与目标污染物的二级反应速率常数,单位为lmol
‑1s
‑1;表示cl
·
与hocl的二级反应速率常数,单位为l mol
‑1s
‑1;表示cl
·
与ocl
‑
的二级反应速率常数,单位为l mol
‑1s
‑1;[hocl]表示hocl的初始浓度,单位为mol l
‑1;[ocl
‑
]表示ocl
‑
的初始浓度,单位为mol l
‑1;表示cl
·
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤2测得的实际水体cl
·
反应容量,单位为s
‑1;φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]、[s
i
]、]、表示的含义同公式(1)。
[0183]
本实施例中,公式(2)中,各数值如下:φ
hocl
=1.7mol einstein
‑1;;;;;[mp]=0.10mg l
‑1;[hocl]=2.35
×
10
‑5mol l
‑1;[ocl
‑
]=4.69
×
10
‑6mol l
‑1。
[0184]
通过实验测定其在uv/cl2工艺中的实际降解速率,与模型预测结果作比较,如图6所示,结果表明,模型与实测结果吻合良好。
[0185]
实施例3、实际水体uv/s2o
82
‑
工艺处理中有机污染物降解速率预测及实验验证
[0186]
按照实施例1中的方法进行试验,试验条件及结果如下:
mol
‑1s
‑1;表示so4·
‑
与氢氧根离子的二级反应速率常数,单位为l mol
‑1s
‑1;表示so4·
‑
与水的二级反应速率常数,单位为l mol
‑1s
‑1;[s2o
82
‑
]表示过二硫酸盐的初始浓度,单位为mol l
‑1;[oh
‑
]表示氢氧根离子的初始浓度,单位为mol l
‑1;[h2o]表示水的浓度,单位为mol l
‑1;表示so4·
‑
与目标污染物的二级反应速率常数,单位为l mol
‑1s
‑1;表示ho
·
与s2o
82
‑
的二级反应速率常数,单位为l mol
‑1s
‑1;表示so4·
‑
与s
i
的二级反应速率常数,单位为l mol
‑1s
‑1;即为步骤2测得的实际水体so4·
‑
反应容量,单位为s
‑1;φ
mp
、i
o
、f
mp
、a、l’、e
0p,uv
、[mp]、[s
i
]、表示的含义同公式(1)。
[0196]
本实施例中,公式(3)中,各数值如下:本实施例中,公式(3)中,各数值如下:本实施例中,公式(3)中,各数值如下:本实施例中,公式(3)中,各数值如下:本实施例中,公式(3)中,各数值如下:[mp]=0.10mg l
‑1;[s2o
82
‑
]=1.85
×
10
‑4mol l
‑1。
[0197]
通过实验测定其在uv/s2o
82
‑
工艺中的实际降解速率,与模型预测结果作比较,如图8所示,结果表明,模型与实测结果吻合良好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1