一种具有广谱溶解氧和有机碳耐受性的脱氮菌剂及其应用
1.本发明属于环境微生物技术领域,具体涉及一株解淀粉芽孢杆菌(bacillus amyloliquefaciens)yel14和一株粪产碱菌(alcaligenes faecalis)cho6的选育以及由这两种微生物所组成的菌制及其在水体脱氮中的应用。
背景技术:
2.在工业化和城镇化高速发展过程中水体环境氮污染问题日益严峻。由于氮循环与多种物质循环过程紧密耦联,也是决定水体富营养化程度的重要因素,因此,受污染水体的脱氮效率倍受关注。生物脱氮技术因其具有较好的经济效益和环境效益,而成为目前水污染治理领域常用的方法。传统生物脱氮过程是在好氧条件下利用自养型的氨氧化菌和亚硝化菌将氨氮氧化为硝酸盐,再利用反硝化菌在缺氧条件下将硝酸盐还原为氮气,从而实现脱氮。然而,由于受污染水体的溶解氧浓度通常波动较大,而且往往还含有多种抑制微生物功能活性的毒害性污染物,使水体中的氨氮和硝酸盐氮难以有效去除。水体脱氮已经成为水污染防治的重点和难点。
3.随着研究的深入开展,多种新型的脱氮功能微生物不断被发现,包括异养氨氧化菌、厌氧氨氧化菌、好氧反硝化菌等。与常见的脱毒功能微生物相比,这些新型的脱氮功能微生物在污染水体治理中具有更广泛的适用性和更明显的实用性。与传统的氨氧化过程相比,异养氨氧化菌可以在存在有机碳源的条件下,将氨氮氧化为亚硝酸盐氮,从而克服了受污染水体中普遍存在的有机碳源对氨氧化的抑制作用;与传统的反硝化过程相比,好氧反硝化细菌可以在高溶解氧条件下发挥脱氮作用,从而克服了传统反硝化细菌需要在缺氧条件下才能将硝酸盐还原为氮气的缺点。这两类功能菌的组合,有望克服受污染水体治理过程中普遍存在的有机碳源对氨氧化的抑制以及溶解氧对反硝化过程的抑制,从而更灵活高效地实现总氮的脱除。但是,到目前为止,已获得的异养氨氧化菌和好氧反硝化菌极少,兼具异养氨氧化菌和好氧反硝化功能的微生物更是未见报道。
技术实现要素:
4.本发明针对受污染水体中有机碳和溶解氧抑制生物脱氮活性的水污染治理难题,提供具有溶解氧和有机碳耐受能力的脱氮功能菌剂,实现水体中氨氮和总氮的高效去除。
5.本发明首先分离获得兼具异养氨氧化功能和好氧反硝化功能的解淀粉芽孢杆菌yel14,以及在厌氧和好氧条件下均具有反硝化功能的粪产碱菌cho6。
6.本发明还利用这两种功能菌,研制了在厌氧和好氧条件下均可高效脱除受污染水体中氨氮和总氮的功能菌剂。
7.本发明还验证了所研制的脱氮菌剂对垃圾渗滤液这种含高浓度氨氮废水的脱氮能力。
8.本发明所分离获得的一株解淀粉芽孢杆菌(bacillus amyloliquefaciens)yel14和一株粪产碱菌(alcaligenes faecalis)cho6于2021年5月27日保藏于广东省微生物菌种
保藏中心(cgmcc),地址:广东省广州市先烈中路100号大院59号楼5楼,邮编:510070,保藏编号分别为:gdmcc no: 61699和gdmcc no: 61700。
9.本发明提供的粪产碱菌(alcaligenes faecalis)cho6来源于广东省广州市石井河的水体沉积物中,分离的方法是将菌群sb8通过单细胞筛选仪可视化分离筛选获得的单细胞,接种于液体培养基中培养20天,培养基成分:葡萄糖(10 g/l)、nahco3(2.52 g/l)、kh2po
4 (0.5 g/l)、nh4cl(1 g/l)、mgcl2⋅
6h2o (0.06 g/l)、cacl2⋅
6h2o(0.06 g/l)、k2so
4 (3.48 g/l)和feso4⋅
7h2o(0.05 g/l),溶剂为水。取液体培养基中长出的菌液,在上述培养基的琼脂固体平板上生长,菌落呈不规则圆形,不透明,白色菌落,在好氧和厌氧环境下均能生存。该菌通过16s rrna基因测序发现,与alcaligenes faecalis nbrc 13111具有99.41%的相似性,故命名alcaligenes faecalis cho6。
10.本发明提供的解淀粉芽孢杆菌(bacillus amyloliquefaciens)yel14分离于贵州省六盘水市的垃圾塑料袋中,所生长的培养基是马铃薯培养基(pdb, 24 g/l)。其形态学和生理生化特征:该菌经过30℃,48 h培养后,菌落呈不规则椭圆形,淡黄色,不透明,菌落表面有水珠。该菌在好氧、兼性厌氧条件下均能生存,生长ph 6.5-8.5。该菌株经过16s rrna测序,并进行blast分析发现与bacillus amyloliquefaciens mpa菌株具有99.78%的相似性,故命名bacillus amyloliquefaciens yel14。
11.本发明提供了两种菌株在普通培养基中的脱氮能力验证:将alcaligenes faecalis cho6分别接种于r2a(12 g/l)+no
2-(17.5 mm)+nh
4+
(3.5 mm)和r2a(12 g/l)+no
3-(16 mm)的培养基中,并进行好氧培养(180 rpm,30℃)和厌氧培养(30℃,充有99.99% n2的厌氧箱)以验证其硝化能力、反硝化能力和脱氮能力。结果发现在r2a(12 g/l)+no
2-(17.5 mm)+nh
4+
(3.5 mm)培养基中经过10天培养后,菌株cho6的好氧脱氮能力与厌氧脱氮能力相当,均为25%左右(图2)。而在r2a(12 g/l)+no
3-(16 mm)培养基中的脱氮能力最明显,在好氧和厌氧条件下,分别能够达到66%和71%的脱氮能力(图2)。进一步分析含氮离子化合物,发现不管是在好氧还是在厌氧条件下,菌株cho6均能将r2a(12 g/l)+no
2-(17.5 mm)+nh
4+
(3.5 mm)培养基中的no2–
经反硝化作用全部去除(图3中的、),与对照组相比,nh
4+
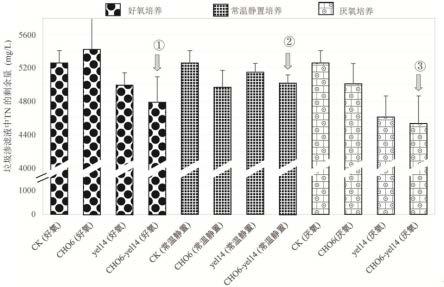
未出现明显变化。而在r2a(12 g/l)+no
3-(16 mm)培养基中,菌株cho6具有较强的反硝化能力,能够利用反硝化过程将no
3-几乎全部转化去除 (图4中的、)。
12.将bacillus amyloliquefaciens yel14分别接种于pdb(24 g/l)+no
2-(13.2 mm)+nh
4+ (3.3 mm)和pdb(24 g/l)+no
3-(11.8 mm)的培养基中,并进行好氧培养(180 rpm,30℃)和厌氧培养(30℃,充有99.99% n2的厌氧箱)。菌株yel14在pdb(24 g/l)+no
2-(13.2 mm)+nh
4+ (3.3 mm)中没有好氧脱氮能力,厌氧脱氮仅为11.42%(图2)。同样的,菌株yel14在pdb(24 g/l)+no
3-(11.8 mm)培养基中也无好氧脱氮能力,而厌氧脱氮能力仅为7.37%(图2)。菌株yel14具有的脱氮能力非常弱,原因可能在于体系中含氮离子化合物未转化为氮气,而是以离子形式相互转化。具体而言,菌株yel14在pdb(24 g/l)+no
2-(13.2 mm)+nh
4+ (3.3 mm)进行好氧培养时,能够生成培养中没有的no
3-(1.248 mm)(图3中的),而厌氧下培养时能够将47%的nh
4+
(图3中的)转化为no
3-(0.447 mm) (图3中的)和no
2-(2.683 mm)(图3中的)。在pdb(24 g/l)+no
3-(11.8 mm)中,菌株yel14的好氧反硝化能力较强,能够达到94.8%,但厌氧反硝化能力非常弱,且会大量积累no
2-(2.98 mm)(图4中的、),这可能是
体系中的总氮(tn)不能被去除的原因。
13.综合而言,在好氧或厌氧条件下,alcaligenes faecalis cho6具有较强的反硝化能力(去除no
3-和no
2-),但无氨氧化能力。而bacillus amyloliquefaciens yel14在好氧条件下有一定的反硝化能力(去除no
3-),但在厌氧条件下,其反硝化能力非常弱,会积累大量的no
2-。更有趣的是菌株yel14能够在厌氧条件下,实现47%的nh
4+
转化为no
2-和no
3-。因此,可以将菌株cho6和yel14进行混和培养,利用菌株yel14将垃圾渗滤液中的nh
4+
转化为no
2-和no
3-,再经菌株cho6反硝化作用转变为n2,以达到脱氮的目的。
14.本发明还提供解淀粉芽孢杆菌yel14和粪产碱菌cho6在垃圾渗滤液中好氧、厌氧以及常温静置培养的脱氮情况验证。
15.将菌株cho6和yel14及其1:1复配的菌群cho6-yel14分别接种于垃圾渗滤液中(惠州垃圾填埋场,成熟型,》 10年),并且未加入任何营养液。发现相比较菌株cho6和yel14单独接种于垃圾渗滤液中培养的情况,复配菌群cho6-yel14在好氧和厌氧条件下,具有较好的脱氮效果,分别能够去除垃圾渗滤液中470.5 mg/l和724.8 mg/l的总氮(图5中的、)。通过离子色谱测定发现复配后的菌群cho6-yel14在高氨氮的垃圾渗滤液中具有更好的氨氮去除能力和适应能力,其在好氧、常温静置和厌氧条件下分别可达44.4%、37.53%和38.95%的氨氮去除率(图6中的、、)。
16.因此,本发明的第一个目的是提供一种具有广谱溶解氧和有机碳耐受性的脱氮菌剂,含有解淀粉芽孢杆菌(bacillus amyloliquefaciens)和粪产碱菌(alcaligenes faecalis)。
17.优选的,所述的解淀粉芽孢杆菌是解淀粉芽孢杆菌yel14,保藏编号为:gdmcc no: 61699,所述的粪产碱菌是粪产碱菌cho6,其保藏编号为:gdmcc no: 61700。
18.优选的,所述的脱氮菌剂还含有功能载体。
19.本发明的第二个目的是提供所述的脱氮菌剂在制备脱氮生物膜中的应用。
20.本发明的第三个目的是提供一种脱氮生物膜,该脱氮生物膜含有所述的脱氮菌剂。
21.本发明的第四个目的是提供所述的脱氮菌剂或脱氮生物膜在水体脱氮中的应用。
22.优选的,是提供所述的脱氮菌剂或脱氮生物膜在好氧或厌氧条件下脱除水体中的氮。
23.优选的,所述水体中的氮包括氨氮nh
4+-n、硝态氮no
3-‑
n或亚硝态氮no
2-‑
n中的一种以上。
24.本发明的第五个目的是提供所述的脱氮菌剂或脱氮生物膜在污水除臭和/或垃圾渗滤液除臭中的应用。
25.本发明的第六个目的是提供一种水体脱氮方法,是将所述的脱氮菌剂直接投入含氮废水中,或在生化反应器中将所述的脱氮菌剂与含氮废水混合处理。优选的,是将所述的脱氮菌剂与一定量的功能载体混合后投入处理含氮废水的生化反应器中。
26.本发明具备的有益效果:本发明利用解淀粉芽孢杆菌yel14和粪产碱菌cho6,研制了在厌氧和好氧条件下均可高效脱除受污染水体中氨氮和总氮的功能菌剂,有效克服了污染水体中溶解氧和有机碳对生物脱氮的抑制作用。本发明所研制的菌剂在厌氧和好氧条件下均可高效去除垃圾渗
滤液中的氨氮和总氮,相比较菌株yel14和cho6单独接种于垃圾渗滤液中培养的情况,复配菌群cho6-yel14在好氧和厌氧条件下,具有更好的脱氮效果,两种菌株发挥协同脱氮作用,具有较大的工程应用潜力和广阔的市场应用前景。
27.bacillus amyloliquefaciens yel14其于2021年5月27日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市先烈中路100号大院59号楼5楼,邮编:510070,保藏编号为:gdmcc no: 61699。
28.alcaligenes faecalis cho6其于2021年5月27日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市先烈中路100号大院59号楼5楼,邮编:510070,保藏编号为:gdmcc no: 61700。
附图说明
29.图1为粪产碱菌alcaligenes faecalis cho6和解淀粉芽孢杆菌bacillus amyloliquefaciens yel14在垃圾渗滤液中脱氮的过程示意图。
30.图2为粪产碱菌alcaligenes faecalis cho6和解淀粉芽孢杆菌bacillus amyloliquefaciens yel14分别在pdb培养基和r2a培养基中脱氮能力的验证。
31.图3为粪产碱菌alcaligenes faecalis cho6和解淀粉芽孢杆菌bacillus amyloliquefaciens yel14的亚硝酸盐去除能力和氨氧化能力验证。
32.图4为粪产碱菌alcaligenes faecalis cho6和解淀粉芽孢杆菌bacillus amyloliquefaciens yel14的反硝化能力验证。
33.图5为粪产碱菌alcaligenes faecalis cho6、解淀粉芽孢杆菌bacillus amyloliquefaciens yel14以及两种菌1:1复配后在垃圾渗滤液中脱氮能力的验证。
34.图6为粪产碱菌alcaligenes faecalis cho6、解淀粉芽孢杆菌bacillus amyloliquefaciens yel14以及两种菌1:1复配后在垃圾渗滤液中氨氮去除能力的验证。
35.图7为通过流式细胞仪可视化筛选粪产碱菌alcaligenes faecalis cho6。
具体实施方式
36.为了使本发明的目的、技术方案和有益技术效果更加清晰,以下结合实施例,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的实施案例仅仅是为了解释本发明,并非为了限定本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
37.实施例1alcaligenes faecalis cho6和bacillus amyloliquefaciens yel14的具体分离选育过程如下:(1)alcaligenes faecalis cho6分离培养:本发明提供的alcaligenes faecalis cho6来源于受工业污染的广东省广州市石井河的水体沉积物中,分离的方法是将菌群sb8(能在平板上生长的单菌落菌群,该菌群是现有技术中获得的,公开于文献:qian y. f., xu m. y., et al. synergistic interactions of desulfovibrio and petrimonas for sulfate-reduction coupling polycyclic aromatic hydrocarbon degradation. j. hazard. mater.,2021,407)通过
单细胞筛选仪(长春长光辰英生物科学仪器有限公司)可视化筛选杆状微生物而获得的单细胞(图7),放于液体培养基中培养20天后,观察菌液是否浑浊(30℃, 10%h2+10%co2+80%n2的厌氧箱),将浑浊的菌液在上述培养基的琼脂固体平板上划线,并进行鉴定。alcaligenes faecalis cho6的菌落呈不规则圆形,不透明,白色菌落,在好氧和厌氧环境下均能生存。该菌通过16s rrna基因测序发现,与alcaligenes faecalis nbrc 13111具有99.41%的相似性,故命名alcaligenes faecalis cho6,alcaligenes faecalis cho6的16s rrna序列如seq id no.1所示。上述液体培养基成分:葡萄糖(10 g/l)、nahco3(2.52 g/l)、kh2po4(0.5 g/l)、nh4cl(1 g/l)、mgcl2⋅
6h2o (0.06 g/l)、cacl2⋅
6h2o(0.06 g/l)、k2so4(3.48 g/l)、feso4⋅
7h2o (0.05 g/l),溶剂为水;培养基的固体平板是在液体培养基中加入质量分数为1.5%琼脂。培养基配制方法是将各成分加至水中,搅拌溶解,灭菌即得。
38.(2)bacillus amyloliquefaciens yel14分离培养:本发明提供的bacillus amyloliquefaciens yel14分离于贵州省六盘水市的垃圾塑料袋中,所分离的培养基是马铃薯培养基(pdb, 24 g/l,由广东环凯微生物科技有限公司提供)。将垃圾塑料上的菌群加入无菌水里,用移液枪来回吹打5遍后,取50 μl在pdb平板上涂布(含质量分数为1.5%的琼脂),放置于30℃的恒温箱进行培养,孵育1周后,挑单菌落进一步纯化。bacillus amyloliquefaciens yel14的菌落呈不规则椭圆形,淡黄色,不透明,菌落表面有水珠。该菌在好氧,兼性厌氧条件下均能生存,生长ph 6.5-8.5。该菌株经过16s rrna基因测序,并进行blast分析发现与bacillus amyloliquefaciens mpa菌株具有99.78%的相似性,故命名bacillus amyloliquefaciens yel14,bacillus amyloliquefaciens yel14的16s rrna序列如seq id no.2所示。验证所获得微生物的氨氧化能力、反硝化能力。在众多微生物的验证中,最终发现bacillus amyloliquefaciens yel14具有较好的氨氧化功能,进而选为开展下一步实验的候选株。
39.解淀粉芽孢杆菌(bacillus amyloliquefaciens)yel14其于2021年5月27日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市先烈中路100号大院59号楼5楼,邮编:510070,保藏编号为:gdmcc no: 61699。
40.粪产碱菌(alcaligenes faecalis)cho6其于2021年5月27日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市先烈中路100号大院59号楼5楼,邮编:510070,保藏编号为:gdmcc no: 61700。
41.实施例2alcaligenes faecalis cho6和bacillus amyloliquefaciens yel14在普通培养基中的脱氮能力验证:根据两种菌株分离于不同的培养基,因此选定两种不同基础培养基来验证脱氮能力,分别是r2a和pdb培养基。以体积分数为1%的接种量,将alcaligenes faecalis cho6接种于1升的培养基r2a(12 g/l)+no
2-(17.5 mm)+nh
4+
(3.5 mm)验证其对nh
4+
氧化能力和对no
2-的还原能力,而接种于1升的培养基r2a(12 g/l)+ no
3-(16 mm)中,验证菌株cho6的反硝化能力。并且需要分别在好氧(180 rpm,30℃)条件下和厌氧(30℃,充有99.99%n2的厌氧箱)条件下验证cho6的脱氮能力。其中,no
3-、no
2-和nh
4+
的离子浓度是通过离子色谱(thermo scientific)测定,总氮(tn)是通过toc仪(岛津)测定。
42.以体积分数为1%的接种量,将bacillus amyloliquefaciens yel14分别接种在1
升的培养基pdb(24 g/l)+no
2-(13.2 mm)+ nh
4+ (3.3 mm)和pdb(24 g/l)+ no
3-(11.8 mm)中,同时进行好氧培养(180 rpm,30℃)和厌氧培养(30℃,充有99.99% n2的厌氧箱),验证yel14的脱氮能力。
43.并设置未接种菌株cho6或yel14的相应的培养基为空白对照组(ck)。
44.结果显示,菌株cho6在r2a(12 g/l)+no
2-(17.5 mm)+nh
4+
(3.5 mm)培养基中经过10天培养后,菌株cho6的好氧脱氮能力与厌氧脱氮能力相当,好氧脱氮能力和厌氧脱氮能力分别为25.32%和26.35%(图2)。而在r2a(12 g/l)+ no
3-(16 mm)培养基中经过10天培养后,菌株cho6的脱氮能力最明显,在好氧和厌氧条件下,分别能够达到66%和71%的脱氮能力(图2)。进一步分析含氮离子化合物,发现不管是在好氧还是在厌氧条件下,菌株cho6都能将r2a(12 g/l)+no
2-(17.5 mm)+nh
4+
(3.5 mm)培养基中的no
2-经反硝化作用全部去除(图3中的、),与对照组相比,nh
4+
未出现明显变化。而在r2a(12 g/l)+ no
3-(16 mm)培养基中,菌株cho6具有较强的反硝化能力,能够利用反硝化过程将no
3-几乎全部转化去除(99%)(图4中的、)。
45.菌株yel14在pdb(24 g/l)+no
2-(13.2 mm)+ nh
4+ (3.3 mm)中经过10天培养后没有好氧脱氮能力,好氧脱氮效率为0,厌氧脱氮仅为11.42%(图2)。同样的,菌株yel14在pdb(24 g/l)+ no
3-(11.8 mm)培养基中经过10天培养后也无好氧脱氮能力,好氧脱氮能力也为0,而厌氧脱氮能力仅为7.37%(图2)。菌株yel14具有的脱氮能力非常弱,原因可能在于体系中含氮离子化合物未转化为氮气,而是以离子形式相互转化。具体而言,菌株yel14在pdb(24 g/l)+no
2-(13.2 mm)+ nh
4+ (3.3 mm)进行好氧培养时,能够生成培养中没有的no3‑ (1.248 mm)(图3中的),而厌氧下培养时能够将47%的nh
4+
(图3中的)转化为no3‑ (0.447 mm) (图3中的)和no2‑ (2.683 mm) (图3中的)。在pdb(24 g/l)+ no
3-(11.8 mm)中,菌株yel14的好氧反硝化能力较强,能够实现94.8%的no
3-转化,但厌氧反硝化能力非常弱,且会大量积累no
2-(2.982 mm) (图4中的、),这可能是体系中的总氮(tn)不能被去除的原因。
46.综合而言,alcaligenes faecalis strain cho6在好氧或厌氧条件下均具有较强的反硝化功能(去除no3‑ 和no
2-),但缺乏氨氧化能力;而bacillus amyloliquefaciens strain yel14仅在好氧的条件下具有一定的程度no
3-反硝化作用(去除no
3-),在厌氧条件下几乎没有反硝化功能,但该菌具有氨氧化的能力,能够将nh
4+
转化为no2‑ 或no
3-(图2-4)。
47.实施例3alcaligenes faecalis strain cho6和bacillus amyloliquefaciens strain yel14在垃圾渗滤液中的应用,具体实施如下:从惠州垃圾渗滤液处理厂(广东省惠州市惠城区永联路,成熟型,》 10年)取回原液,放置于-4℃冷库保藏待使用。为了验证alcaligenes faecalis cho6和bacillus amyloliquefaciens yel14复配后的效果,分别将菌株cho6和yel14培养至对数生长期、以1:1体积比复配的菌群cho6-yel14接种于1升的垃圾渗滤液原液中,接种量为体积分数1%。并设置没有接种菌株cho6或yel14的垃圾渗滤液为空白对照组(ck),设置的培养方法如下:好氧培养:ck(3组),cho6 (3组),yel14 (3组),cho6-yel14 (3组),条件是180 rpm,30℃摇床;
常温静置培养:ck(3组),cho6 (3组),yel14 (3组),cho6-yel14 (3组);厌氧培养:ck(3组),cho6 (3组),yel14 (3组),cho6-yel14 (3组),条件是30℃,含99.99% n2的厌氧培养箱。
48.培养时间为10天。
49.菌株cho6和yel14在垃圾渗滤液中脱氮的过程示意图见图1。结果显示在上述三种培养条件下,菌株cho6、yel14和菌群cho6-yel14在垃圾渗滤液中均具有一定的脱氮能力以及氨氮去除能力。相比较菌株cho6和yel14单独接种于垃圾渗滤液中培养的情况,复配菌群cho6-yel14具有较好的脱氮效果,在好氧、常温静置和厌氧条件下分别能够去除垃圾渗滤液中470.5 mg/l、241.67 mg/l和724.83 mg/l的总氮(图5中的、、)。通过离子色谱测定发现复配菌群cho6-yel14在高氨氮的垃圾渗滤液环境中具有更好的氨氮去除能力和适应能力,其在好氧、常温静置和厌氧条件下分别可达44.4%、37.53%和38.95%的氨氮去除率(图6中的、、)。
50.以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1