储氧材料的制作方法
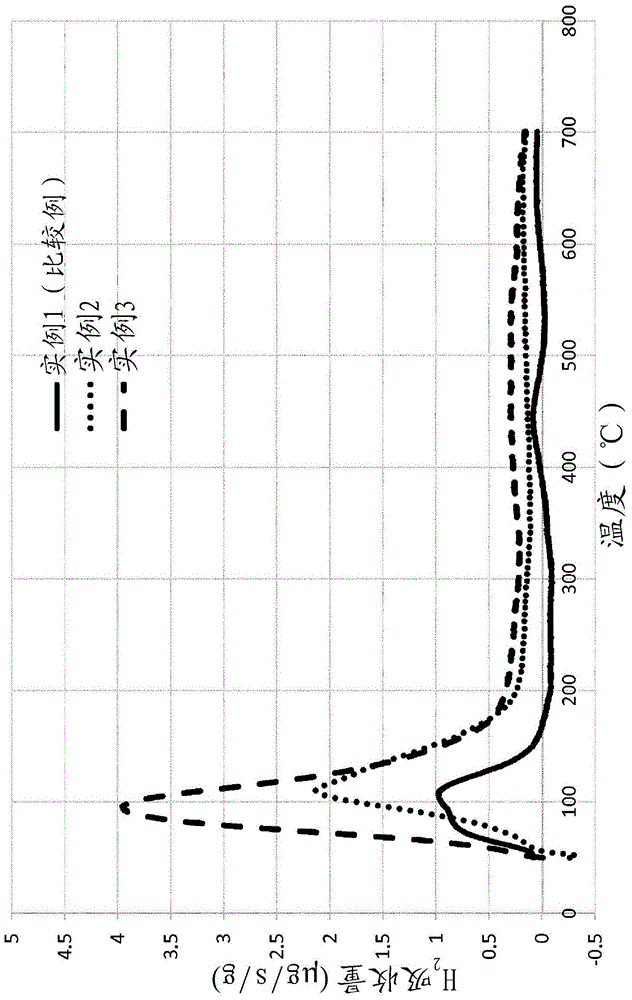
具体实施方式本发明涉及储氧材料。具体地讲,本发明提出了一种包含特定混合氧化物作为储氧组分(osc)的储氧材料(osm)。储氧材料可用于传统方式中,例如三元催化剂、氧化催化剂或nox储存催化剂。根据常规方法借助三元催化转化器(twc)清洁内燃机废气,该内燃机为主要通过化学计量的空气/燃料混合物操作的内燃机,如具有或不具有涡轮增压器的气口燃料喷射(pfi)发动机或汽油直接喷射式发动机(gdi)。这些三元催化转化器能够将发动机的三种基本气态污染物(具体地讲是烃类(hc)、一氧化碳(co)和氮氧化物(nox))同时转化成无害的组分。在λ=1附近,即空气/燃料比率等于14.56或简单地讲λ=1的情况下,twc的使用最佳。高于该值的废气称作贫气,co和hc被催化氧化成二氧化碳和水。低于该值的废气称作富气,nox主要通过co作为还原剂被还原成氮气(n2)。然而,即将出台的更严格的政府排放法规(如eu-6-表1,lev-iii)和燃料经济性标准(co2法规)无疑将会使将来的废气后处理更加困难(表1)。表1-欧6客车排放限制压缩点火车辆火花点火车辆thcmg/km不适用100nmhcmg/km不适用68hc+noxmg/km170不适用noxmg/km8060comg/km5001000颗粒质量mg/km4.54.5颗粒数量#/km6.0×1011待定因此,对于主要在化学计量的条件下(空气/燃料比率=14.56或λ=1)运行的汽油车,减轻有害污染物的能力仍需要进一步提高。如上所述,在λ=1时,通过twc达到最佳的hc、co和nox转化率。然而,汽油发动机在介于稍微贫气和稍微富气之间的振荡条件下(λ=1±0.05=>摆动)运行。在纯富气的条件下,烃类的转化率迅速下降。在贫气条件下,nox的转化效率较低。为了拓宽twc的最佳操作范围,在twc配方中纳入储氧材料(osm)。上述osm通常基于ceo2/zro2的混合氧化物(wo2008113445a1,us7943104bb),并且是已知的氧离子具备导电特性的固体电解质。在这些osm中,ceo2用于缓解典型催化剂操作过程中空气/燃料比率的局部变化对催化剂的影响。ceo2通过在氧耗尽的瞬间以快速、可再生方式从其3-d结构中释放活性氧,并且在富氧条件下把失去的氧从气相中吸附回来而发挥上述作用。该活性归因于ceo2经由2ce4+→2ce3+[o2]反应的还原性(还原-氧化或氧化还原活性)。氧的高效利用对于促进氧化/还原类化学至关重要,如用于汽油三元催化剂的co/no化学,或最近还有在edpf例如us20050282698a1、sae2008-01-0481中所述的颗粒物(烟灰)的直接催化氧化。因此,已对常用的基于ce-zr的os材料的化学、合成、改性和优化进行了广泛的研究。例如,us6468941、us6585944和us20050282698a1已广泛研究了掺杂有更低价离子的铈-锆材料在废气排放控制中的用途。这些研究表明,例如稀土金属(如y、la、nd、pr等等)、过渡金属(如fe、co、cu等)、碱土金属(如sr、ca、mg、ba)的更低价掺杂物离子均可有利地影响氧离子的导电性。这据信是因为固溶体的立方晶格内形成的氧空缺位,这降低了氧离子从块状晶体迁移到表面的能量位垒,从而增强了固溶体缓冲典型汽油(三元)催化剂应用的废气流中进行的空气燃料瞬变的能力。最后,us6468941和us6585944教导可能将基本的如非贵族(pt、pd、rh、au等)掺杂金属加入到固溶体的立方萤石晶格中,作为促进ce和被识别为特别受关注的fe、ni、co、cu、ag、mn、bi以及这些元素的混合物的氧化还原化学反应的可选方式。因此,普通未改进的osm在约600℃下通常呈现最大氧化还原率(由h2程序升温还原(h2-tpr)确定),而在晶格内加入基本金属可以将该温度降低>200℃,同时增加少许的贵金属使用费用。us6585944公开了一种osm,除包含锆、铈和稀土金属作为稳定剂以外,其包含0.01mol%-0.25mol%的选自铁、铜、钴、镍、银、锰和铋中的至少一种金属作为稳定剂。而且,该文献描述了这些金属作为osm晶体结构中的固溶体而存在。此外,jp2005125317a公开了一种含有载体的osm,所述载体包含二氧化铈(ceo2)和作为包含在所述载体中的活性物质的氧化铁。该文献描述了这种包含ceo2的载体优选地为ceo2-zro2的固溶体。另外,文献中提到期望的氧化铁含量在2重量%至30重量%的范围内(以fe2o3相对于osm的重量计),以及当氧化铁含量偏离这个范围时,无法获得大量osm。人们已尝试制备不含二氧化铈的储氧组分(wo10096612a2)。例如,wo2011109676a2涉及不含二氧化铈的储氧组分,如氧化锆-氧化镨、氧化锆-氧化钕、氧化锆-氧化钇和氧化锆-氧化镧。尽管如此,不仅因为稀土危机表明仅依赖二氧化铈可能会导致twc和市场上其他所需催化剂的供应短缺,因此仍然需要更多的或可选的osm。因此,本发明的目的是提出能够取代储氧材料中ceo2-zro2混合氧化物的新材料。另一个目的是提出就此而言在储氧表现上至少和基于ce的氧化物一样有效的新材料。自然,应该采用更便宜的材料来实现该目的。根据本发明的权利要求1所述的材料来实现这些目的以及其他由技术人员提出的源于现有技术的目的。从属于权利要求1的权利要求中描述了本发明的其他优选方面。本发明的另外的实施方案涉及某些类型的催化剂、相应的废气处理系统和废气处理方法。事实上,本发明提出了一种催化储氧材料,其包含选自cu、ag、au、pt、pd、rh、ru、ir和它们的混合物的催化活性金属,还包含作为储氧组分(osc)的二元、三元或更高元的混合氧化物,其化学式为:(m1)a(m2)b(m3)c...(m7)gox其中0≤a,b,c,…,g≤20,至少a和b>0,x的值可调整,用于抵消源于m1-m7金属阳离子的正电荷,m1-m7选自fe、mn、v、nb、ta、mo和w,并且其中氧化物负载在表面积为至少50m2/g的大表面积的难熔金属氧化物载体上。这些材料是活性储氧材料,其储氧效率并不比传统的基于ce的储氧材料差多少,并且具有相对和绝对储氧容量更高的优点。本发明的材料能够取代普通twc中基于ce的储氧材料或其他催化剂类型,而无需采取进一步的措施。因此,可能完全舍弃昂贵的基于ce的储氧材料,转而生产具有无ce储氧材料的催化剂。在本发明的一个优选方面,osm不含任何ce化合物。为了利于使用,本材料包含催化活性金属,其起到激活氧气的快速存储与释放的作用。然而,不含贵金属的储氧材料在h2-tpr中仅在升高的温度下表现出还原性,物理添加催化活性贵金属活化了所述储氧材料的氧原子,使得分别加载的样品在远低于200℃的温度下早已释放氧气。可用的催化活性金属包括活性贵金属中的至少一种,如cu、ag、au、pt、pd、rh、ru、ir,其中铂、钯和/或铑是优选的。通常,取决于分别使用的金属,这些催化金属使用量为约>0至约14g/l(400g/ft3),优选地为0.1-8.8g/l(3-250g/ft3),最优选地为在0.35-7g/l(10-200g/ft3)之间。铂族金属组分的量是基于其重量与载体体积之比而计的,通常用g材料/l载体体积表示。对于pd而言,施加的含量为0.0-300g/l,优选地为0.1-100g/l,最优选地为0.5-14g/l。pt可存在的含量为0.1-50g/l,优选地为0.5-20g/l,最优选地为1.0-7g/l。rh的含量可为0.0-1.0g/l,优选地为0.01-0.7g/l,最优选地为0.1-0.5g/l。在应用中,作为催化试剂的活性贵金属可在催化剂中以复合氧化态存在,这对于本领域的普通技术人员来说将是显而易见的。以举例的方式,钯在催化剂中可作为钯金属(0)、pd(ii)和pd(iv)存在。在一种优选的osm制备方法中,可使用合适的贵金属化合物和/或活性贵金属复合物来实现贵金属在储氧组分和/或载体(如,活性氧化铝载体颗粒)上的分散(参见下文)。如本文所用,术语“贵金属化合物”指通过煅烧或使用催化剂分解或以其他方式转化成催化活性形式的任何贵金属化合物、复合物等等,通常为贵金属本身或贵金属氧化物。因此,只要用于将催化金属化合物浸渍或沉淀到储氧组分上和/或载颗粒上的液体不是不利地与催化贵金属或其化合物或复合物或者储氧材料的其他组分发生反应,并且通过挥发或分解在加热和/或应用真空时能够从催化剂中脱除,便可使用所述贵金属的可溶解或可分散在该液体(优选为水)中的化合物或复合物。在一些情况下,直到催化剂投入使用,并在操作中经受遇到的高温,才能完成液体的脱除。通常,从经济环保两者的角度考虑,优选的是活性贵金属的可溶化合物的含水溶液。例如,合适的化合物为氯铂酸、胺溶性的氢氧化铂、硝酸铂、硝酸钯或氯化钯、氯化铑、硝酸铑、六氨合氯化铑等等。在煅烧步骤中,或至少在催化剂使用的初始阶段,此类化合物被转化成活性贵金属或其化合物的催化活性形式。可用于具有储氧容量的活性贵金属组分和二元、三元或更高元的混合氧化物的催化载体包括通常用于此实践的难熔金属氧化物中的任何者,诸如选自氧化铝、二氧化钛、二氧化硅和氧化锆的一种或多种难熔氧化物。这些氧化物包括(例如)二氧化硅和金属氧化物诸如氧化铝,包括混合氧化物形式诸如二氧化硅-氧化铝,可以是无定形或结晶状的硅铝酸,氧化铝-氧化锆,氧化铝-氧化铬,氧化铝-二氧化铈等等。优选地,载体大体上由氧化铝构成,氧化铝优选地包括γ或活性氧化铝族的成员,如γ、α、δ、η和/或θ氧化铝,以及少量的其他难熔氧化物(如果存在),比如多达约载体材料的20重量%,优选地多达10重量%。优选地,载体包含γ-氧化铝。载体材料的bet比表面积为约50至约400m2/g,优选地为80至350m2/g,最优选地为100至300m2/g。在根据本发明的osm中使用混合氧化物组分涉及能够存储氧气的某些二元、三元或更高元的混合氧化物。已经证实,根据环境废气中的氧分压,所述材料对氧化反应及还原反应特别有用,尤其是在汽车应用中。如在基于ceo2的材料中观测到的氧存储机理(wilhelmkeim,inhandbookofheterogeneouscatalysis,2ndedition,chapt11,vol5,page2295(wilhelmkeim,《非均相催化手册》,第二版,第11章,第5卷,第2295页)),本文所述的二元、三元或更高元的混合氧化物的活性归因于该混合氧化物中所用元素中的至少一种的还原性(可在氧耗尽条件下同时释放氧气)以及在环境中氧富足时此反应的可逆性。(另请参见hollemanwiberg,101.edition;bergneretal.j.solidstatechem.182(2009)2053(hollemanwiberg,第101版,bergner等人,《固态化学杂志》,2009年,第182卷,第2053页);etal.materialsresearchbulletin46(2011)1955(等人,《材料研究公告》,2011年,第46卷,第1955页))。本文使用的元素的优点在于它们的氧化态大量存在,因此很容易展现氧化还原性质。就例如包含混合氧化物的钒而言,可考虑伴随o2的释放从v(v)逐步还原到v(ii)。通常,释放氧气的反应可表述如下:在本发明的一个优选的方面,提出了使用osc来催化废气的储氧材料,其中osc的a值的摩尔范围为≥0-20,优选地为1-20,最优选地在1-16之间。同理,b值的范围为≥0-20,优选地为1-20,最优选地在1-17之间。此外,c值的范围可为0-5,优选地为0-2,最优选地为0-1,并且d-g的范围可为0-5,优选地为0-2,最优选地为0-1。非常优选的储氧材料示出osc的a-g的值,其中a值为1-16,b为1-17,c为0-1,d、e、f、g为0-1。osm中使用的极其优选的组分具有如下各值:a=1,b=1,其中m1和m2选自fe、v、mn,并且c-g为0。根据本发明的材料的储氧容量由上述组分的混合氧化物确立。可根据技术人员的知识,从fe、mn、v、nb、ta、mo和w中选择过渡金属。在一个优选的实施方案中,仅采用5种金属(m1-m5)来构成osm的储氧组分,这些金属选自fe、mn、v、nb、w。在一个非常优选的方面,提出了根据本发明的储氧材料,其中m1-m2选自fe、mn、v。应当理解,储氧组分,即建立储氧容量的组分,不含任何二氧化铈或含铈的混合氧化物。然而,在一个最优选的实施方案中,储氧材料,即储氧组分加上催化活性贵金属再加上载体材料,不包含任何二氧化铈或含铈的混合氧化物。技术人员可使用金属(m1-m7)的任何类型的水溶性前体。最优选的为醋酸铁、硝酸铁、乙酸锰、硝酸锰、草酸氧钒、偏钒酸铵、草酸铌铵、钽草酸、钼酸铵和/或偏钨酸铵。作为另外一种选择,金属(m1-m7)的氧化物、羟基氧化物和/或氢氧化物可用作制备储氧组分的前体。任何情况下,都必须由技术人员按照使得对储氧材料的前体进行热处理后得到本发明中所述的储氧材料的方式选择前体。在最普遍的内燃机废气条件下,本发明所理解的储氧材料可以在一定程度上存储氧气。本发明的材料能够在一定程度上从环境废气中存储氧气,优选地为至少8.000μgo2/mmol储氧组分。在一个更优选的方面,本发明提供了一种储氧材料,其能够存储至少10.000μgo2/mmol储氧组分、最优选地超过12.000μgo2/mmol储氧组分的氧气。此外,本发明的储氧材料能够在h2-tpr试验中在20℃-650℃、优选地在20℃-350℃、最优选地在20℃-200℃的温度范围内被氧化和还原。值得注意的是,良好的储氧材料的还原温度峰值低于150℃、最优选地低于100℃的范围内。还应强调的是,这种材料具有很高的抗老化性。在水热氧化还原老化[6h1000℃,1min1%co,1min1%o2,10%h2o,n2平衡]中,材料的储氧容量(相对量以及绝对量两者)损失量少于67%,优选地少于50%,最优选地少于33%。本发明的另一个实施方案涉及包含根据本发明的储氧材料的某些催化剂。出于这方面考虑的催化剂类型为三元催化剂(twc)、氧化催化剂或nox存储催化剂。本领域的技术人员对这些类型的催化剂以及它们的工作原理非常熟悉。这方面的基本信息请参考书目christianhagelüken的autoabgaskatalysatoren,expertverlag,2005,2.edition(《汽车废气净化催化剂》,专家出版社,2005年,第2版)和ronaldm.heck等人的catalyticairpollutioncontrol,johnwiley&sons,inc,1995(《催化空气污染控制》,约翰威立国际出版公司,1995年)。同样,可使刚刚提及的催化剂成为内燃机废气处理系统的组成部分,该内燃机为主要具有化学计量的空气/燃料混合物的、使用三元催化(twc)转化器的内燃机,其能够以非常优选的方式减少废气中的有毒污染物,例如twc加gpf(汽油颗粒过滤器)。另一方面,也可采用包含本发明的储氧材料的催化剂处理来自稀燃内燃机的废气。所述催化剂类型,如nox存储催化剂、cdpf(催化柴油微粒过滤器)、hc-捕获剂、doc(柴油氧化催化剂)可以是后处理系统的一部分,该系统还包括另外的废气后处理单元,如不包含本发明osm的scr催化剂、cdpf、doc、nox存储催化剂。优选地,选择的系统依次包括doc、包含本发明储氧材料的cdpf和scr催化剂,在cdpf和scr催化剂之间具有尿素或nh3前体的注射装置。在最后一个实施方案中,本发明涉及用于处理来自内燃机的废气的方法,其中在有效减少废气中的有害污染物的条件下,将废气与本发明的催化剂中的一种或多种或刚刚提及的后处理系统接触。应当理解,针对储氧材料而提到的优选方面和实施方案也适用于本文提供的催化剂、废气处理系统和方法。本发明描述的储氧材料的制备方式是技术人员已知的。储氧材料包含活性贵金属、二元、三元或更高元的氧化物(即储氧组分)和载体氧化物。通常,通过形成含有储氧组分的所有前体的优选含水溶液来制备储氧组分。可采用上述的化合物作为前体,但本发明不限于上述的化合物。如果前体以溶解形态存在,则可通过将含有储氧组分的前体混合物的溶液沉淀、或通过蒸发该溶剂来形成储氧组分。作为另一种选择,可通过孔体积浸渍(即始润浸渍,参见:j.w.geus,preparationofsolidcatalystswileyvch(1999),chapt.4,page464(j.w.geus,《固体催化剂制备》,wileyvch出版社,1999年,第4章,第464页)),或者通过将包含储氧组分的前体的溶液或包含储氧组分的分散液喷涂到包含载体氧化物的浆料上,来将包含储氧组分的前体的优选含水溶液添加到载体氧化物上。对上述制备方法得到的材料进行热处理,获得氧化物形式的最终储氧组分。可将贵金属前体添加到包含储氧组分前体的溶液中或添加到包含储氧组分的分散液中。作为另一种选择,在下一制备步骤中将贵金属前体添加到通过上述方法获得的已形成的储氧组分中。同样,添加贵金属前体是技术人员已知的。优选地,通过孔体积浸渍或通过将包含贵金属的溶液喷涂到包含储氧组分的浆料上或储氧组分和载体氧化物的混合物上,而将贵金属前体的含水溶液添加到储氧组分或储氧组分与载体氧化物的混合物中。在非常优选的制备储氧材料的方式中,通过孔体积浸渍,再通过干燥并煅烧混合物,将包含储氧组分的前体的含水溶液添加到载体氧化物上。在第二步骤中,通过孔体积浸渍将贵金属前体添加到储氧组分和载体氧化物的经煅烧的混合物上。贵金属前体转化成如上所述的活性贵金属。本发明涉及可选的具有储氧容量的不含ceo2的材料以及它们在废气尤其是汽车废气催化中的应用。与包含ceo2的参考材料相比,该材料的特征在于比表面积高、激活还原的温度低、相对储氧容量高以及绝对储氧容量高。进行h2-tpr实验,以确定储氧组分的活性和基于该储氧组分的材料的活性。因此,将储氧材料的粉末样品在h2流中加热,并且监控h2吸收量对温度的函数。测量具有最大h2吸收量的温度(即峰值温度),来衡量氧气释放速度。如上所述,作为本发明的一部分的材料的特征在于具有较低峰值温度。相对储氧容量定义为储氧组分实际消耗的h2量相比于还原储氧组分所需的最大h2量,以百分比的形式给出。这个相对储氧容量是样品还原性程度的量度。由于作为本发明所述的储氧材料的一部分的储氧组分针对其分子量可示出完全不同的值,因此比较h2吸收量与储氧组分的摩尔量是有意义的。该值定义为绝对氢气吸收容量,以μgh2/mmol组分的形式给出。鉴于以下化学反应,h2吸收量是组分o2释放量的量度,(m1)a(m2)b(m3)c...(m7)gox+h2→(m1)a(m2)b(m3)c...(m7)gox-1+h2o因此可从每mmol组分的绝对氢气吸收量计算出绝对储氧容量,以μgo2/mmol组分计。图1示出了本发明所述的两种氧存储材料的h2-tpr测量值。对于比较例,以类似于本发明的材料的制备方式给出负载在al2o3上的1w%pd/10w%ceo2。可明显地看到受权利要求书保护的储氧材料的优点。由于存在贵金属,因此观察到所有材料都具有较低的还原性激活温度,这在h2-tpr测量值中以较低的峰值温度示出。然而,本发明所述的材料典型地示出低于如所观察的比较例(即包含ceo2的材料)的峰值温度。就fevo4系统而言,观察到的峰值温度为95℃,比包含ceo2的参考系统低12℃。与包含ceo2的比较样品相比,本发明公开的储氧材料的相对储氧容量要高得多。就vnbo5系统而言,观察到其在从室温至高达700℃的温度范围内的相对储氧容量为81%,而ceo2参考材料在相同温度范围内的相对储氧容量只有31%。此外,与比较例(例如相对储氧容量为68%的fevo4系统)相比,作为本发明的一部分的其他材料示出更高的相对储氧容量。对于绝对氢气吸收容量而言观测到类似的结果。与ceo2比较样品相比,作为本发明的一部分的储氧材料示出的绝对氢气吸收容量要高得多,其以μgh2/mmol储氧组分计。fevo4系统在从室温至高达700℃的温度范围内的绝对氢气吸收容量(以μgh2/mmol计)为2048μgh2/mmol储氧组分,而ceo2样品示出在相同温度范围内的氢气吸收量只有306μgh2/mmolceo2。由于绝对储氧容量是由绝对氢气吸收容量计算而得的,与参考样品相比,很明显本发明公开的储氧材料示出显著高的绝对储氧容量。fevo4样品示出的储氧容量为16384μgo2/mmol组分,显著高于比较例(即2448μgo2/mmol组分)。根据上述内容,本文提供的组分和材料分别被公平地视作所谓的储氧组分中二氧化铈和含铈混合氧化物及相应材料的替代物。迄今为止尚未公开的是,所述组分和材料可展现出此类优越的性能。因此,准确地说令人惊讶的是,本发明组分和材料可充当催化剂的有利隔室,具体地讲,尤其是充当汽车领域的废气催化剂的有利隔室。实例:实例1在al2o3上的1w%pd/10w%ceo2(比较样品)制备/煅烧用pd(no3)2和(nh4)2ce(no3)6含水溶液的混合物对al2o3粉末进行孔体积浸渍,来制备该催化剂材料。干燥后,在静止空气中将样品在700℃下煅烧4h。实例2:在al2o3上的1w%pd/10w%vnbo5用pd(no3)2、草酸氧钒和草酸铌铵含水溶液的混合物对al2o3粉末进行孔体积浸渍,来制备该催化剂材料。干燥后,在静止空气中将样品在700℃下煅烧4h。实例3:在al2o3上的1w%pd/10w%fevo4用pd(no3)2、草酸氧钒和硝酸铁含水溶液的混合物对al2o3粉末进行孔体积浸渍,来制备该催化剂材料。干燥后,在静止空气中将样品在700℃下煅烧4h。参照图1和表2,对比了在al2o3上的1w%pd/10w%ceo2样品(比较样品)、在al2o3上的1w%pd/10w%vnbo5样品和在al2o3上的1w%pd/10w%fevo4样品的氧化还原活性特征。可以看出,相比于包含ceo2的参考材料,本专利描述的储氧材料示出增强的性质。这一点还在表2中得到证实,表2记录了最高还原温度以及相对储氧容量(以%计)、绝对氢气吸收容量(以μgh2/mmol储氧组分计)和绝对储氧容量(以μgo2/mmol储氧组分计)。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1