样品收集和处理装置的制作方法
本发明涉及一种用于液体样品收集、特别是用于收集液体生物样品,并且处理目标以用于诊断或表征可能存在于样品中的靶标分子或颗粒的装置。更具体地,本发明涉及一种适于样品制备的装置,所述装置允许从样品中高效分离和浓缩靶标分子或颗粒。
背景技术:
在生物测定中,从不同样品(即样品制备)提取、浓缩和纯化靶标分子、颗粒或分析物的能力代表了关键步骤,并且作为有效靶标检测和分析的前提步骤是具有挑战性的。样品制备步骤是在检测限、可重复性和对所述颗粒或分析物的其它化合物的干扰方面的生物测定中的主要速度限制步骤。典型的现有样品制备程序涉及冗长的手动或复杂的机器人移液步骤,现有样品制备程序包括长的离心循环。这些程序不仅缓慢、昂贵且耗费劳力,而且这些程序还对要求危险化学品的昂贵处置的实验室工作人员造成健康风险。此外,用于样品制备的工作流程,特别是用于新一代的分子靶标的工作流程变得甚至更加复杂,并且提供了多种解决方案。目前,用于样品制备的不同和单独的解决方案正用于每种样品类型和靶标。提供适用于多个样品和靶标的标准样品制备工作流程解决方案是易于实施的、与自动化和试剂集成兼容、并且涉及最少的手工操作时间,仍然是生命科学和诊断环境中未解决的要求。此外,样品工作流程方法的标准化主要在调节诊断环境中是主要需求。
迄今为止,存在两种用于测定处理的方法:(1)在溶液中分子水平的分析物之间操作的同质测定。这些测定中的反应速率快,这是因为这些测定发生在液相中,并且这些测定的实施是相对直接的。然而,这些测定的低特异性和对介质干扰的强烈易感性是主要的限制,这妨碍了这些测定的使用,而不需要进一步的样品处理步骤。(2)异质测定包含具有分子识别组的固体表面,在溶液中异质测定检测之前“选择性地”结合和分离靶标分析物。异质测定提供了优异的特异性,但是以分析物和固体表面之间的缓慢反应速度以及固体表面上的非特异性结合的高可能性为代价。在单个过程中对两种类型的测定进行协调将开启设计更灵敏、精确和快速诊断工具的可能性。事实上,能够控制分子相互作用以及分子水平上的识别的特异性,并且同时对固体表面进行受控分离将在生物测定中开启新的展望。
国际专利申请WO2012035508公开了使用纤维蛋白原作为载体用于从实际上任何种类的样品分离靶标分子或颗粒的方法,代替使用诸如磁珠或涂覆有不同亲和组的微孔的固体表面的现有技术方法,作为从样品中捕获和分离靶标的手段。在WO2012035508方法中,通过将纤维蛋白原载体转化为纤维蛋白来实现靶标分离,靶标分离导致纤维蛋白在纤维蛋白网中的聚集,纤维蛋白将缩回到小团块中并与样品分离。基于悬浮液中游离分子之间的相互作用(即同质条件),靶标和纤维蛋白原载体之间的反应非常快速和高效。然而,如WO2012035508中公开的方法仍然存在与在分离过程期间处理纤维蛋白团块有关的限制。特别地,所述方法没有解决与纤维蛋白团块的物理处理相关的问题。
因此,仍然需要一种允许根据WO2012035508中公开的方法形成的纤维蛋白团块的容易和自动处理的新装置和方法,新装置和方法将开启提供新的同质样品处理方法的可能性、克服了现有的基于固体表面的方法的复杂性。
技术实现要素:
本发明公开了一种用于从含纤维蛋白原的液体样品中分离和浓缩靶标颗粒或分子的装置,当将液体样品引入装置的容器中时,能够形成聚合的纤维蛋白团块,靶标颗粒或分子被捕捉在聚合的纤维蛋白团块中,所述装置包括:用于收集样品的容器以及优选地一封盖。所述容器包括限定用于接收样品的储液部分的第一顶端和第二底端以及至少一个内壁,其中所述储液部分包含至少一个锚元件,所述锚元件构造成与在将所述样品添加至容器时形成的聚合的纤维蛋白团块局部钩挂,并且其中所述靶标颗粒或分子被捕捉在聚合的纤维蛋白团块内。
在根据本发明的装置内捕获靶标的聚合的纤维蛋白团块根据专利申请WO2012035508中描述的方法实现,其内容通过引用并入本文。在这方面,本发明涉及一种用于从含有纤维蛋白原的液体样品中分离和浓缩靶标颗粒或分子的装置,所述装置包括:用于收集样品的容器以及优选地一封盖。所述容器包括限定用于接收所述样品的储液部分的第一顶端和第二底端以及至少一个内壁,其中所述储液包括至少一个锚元件,所述锚元件构造成与在添加所述样品到容器时形成的聚合的纤维蛋白团块局部钩挂。靶标颗粒或分子被捕捉在聚合的纤维蛋白团块内,聚合的纤维蛋白团块在样品中包含的纤维蛋白原至少部分转化为纤维蛋白时形成。
本发明还公开了一种从含纤维蛋白原的样品中分离和浓缩靶标颗粒或分子的方法,其中操作中包括以下步骤:
(a)将所述样品添加至装置容器,
(b)将样品内的纤维蛋白原至少部分地转化为纤维蛋白,由此形成捕捉靶标分子或颗粒的纤维蛋白网,
(c)将步骤(b)形成的纤维蛋白网缩回到钩挂在所述装置的锚元件周围的小团块中,并且
(d)将步骤(b)的聚合的纤维蛋白团块与周围的样品介质分离。
本发明的装置在使用时导致形成小的纤维蛋白团块,其中靶标颗粒或分子被捕捉和浓缩。如此形成的纤维蛋白团块被位于装置的容器内的锚元件局部捕获,锚元件允许纤维蛋白团块容易地与周围液体介质分离。
此外,靶标浓缩速度由如此形成的纤维蛋白团块的尺寸确定。因此,装置组成和设计使得将导致形成尺寸为初始样品尺寸的至多1/3的凝块,并且优选凝块尺寸为初始样品容积的至多1/10。此外,在本发明的优选实施例中,凝块缩回以进一步形成具有一尺寸的小团块,尺寸可达到初始样品容积的1/50和1/1000之间的值。
因此,本发明公开了一种使用纤维蛋白原作为载体分子以将任何靶标分子或颗粒与实际上任何种类的样品分离的装置。分离机制包括两个程序:(1)通过在样品经受凝血酶或类凝血酶酶时捕获纤维蛋白网中的靶标而进行的大小分离,(2)亲和捕获悬浮液中的纤维蛋白原上的靶标颗粒或分子,并且在样品经受凝血酶或类凝血酶酶时在纤维蛋白网中分离捕获的靶标。在后一种情况下,亲和捕获可归因于靶标对纤维蛋白原分子的天然亲和力。在另一个实施例中,亲和捕获可通过由纤维蛋白/纤维蛋白原结合部分和靶标捕获部分组成的分子实现。
根据本发明的方法可进一步包括将如此产生的纤维蛋白团块溶解以回收靶标的步骤。该溶解步骤在将纤维蛋白团块浓缩物再悬浮到合适的缓冲溶液中时实现。受控缓冲液的典型实例是低渗缓冲液、含缓冲液的表面活性剂与纤维蛋白溶解样纤维蛋白溶酶(fibrinolytic like plasmin)和/或如蛋白酶K的蛋白水解剂、链霉蛋白酶和金属蛋白酶的组合。这种溶解步骤可通过进一步添加如纤溶酶原或纤溶酶原激活剂的凝块溶解增强剂来改善。在优选的实施例中,溶解步骤可以进一步包括使用核酸降解酶。
纤维蛋白网中的尺寸捕捉以及特异性亲和结合反应可以用于测定或分离生物样品中的大范围的靶标物质。靶标物质的实例是细胞、细胞组分、细胞亚群(真核和原核的)、细菌、病毒、寄生虫、抗原、特异性抗体、毒素、蛋白质、核酸序列以及类似物。
根据独立权利要求1,本发明的主要方面涉及一种用于从含纤维蛋白原的样品中分离靶标分子或颗粒的装置。
本发明的另一个主要方面涉及根据权利要求15从样品中分离靶标分子或颗粒的方法。
在从属权利要求中阐述了不同的实施例。权利要求的主题和所有要求保护的组合通过引用并入本说明书中并且即使权利要求被放弃仍然是本公开的一部分。
附图说明
本发明的目的和特征在所附权利要求中具体阐述。通过参考结合附图的以下描述,可以最好地理解本发明的关于本发明的组织和操作方式以及其他目的和优点,其中
图1是根据本发明的装置的优选实施例的示意图,
图2(a)和图2(b)是装置的操作的示意图,
图3示出了靶标颗粒或分子的分离和浓缩,
图4示出了用于靶标回收和悬浮的第二容器,
图5示出了三种不同类型的锚元件,
图6是整体操作的图解,
图7(a)、(b)和(c)示出了处于三种不同状态的装置的另一实施例。
图1是用于从液体样品中分离和浓缩靶标颗粒或分子的装置的优选实施例的示意图,装置包括用于收集样品的容器(1)和位于容器的敞开的第一顶侧上的封闭盖(2)。容器还包括限定用于接收样品的储液部分(5)的第二封闭底端和至少一个内壁。封闭盖(2)包括细长的向下突出的浸入装置的储液(5)中的样品中的针元件(3)、以及在封闭盖的下端包括锚元件(4)。
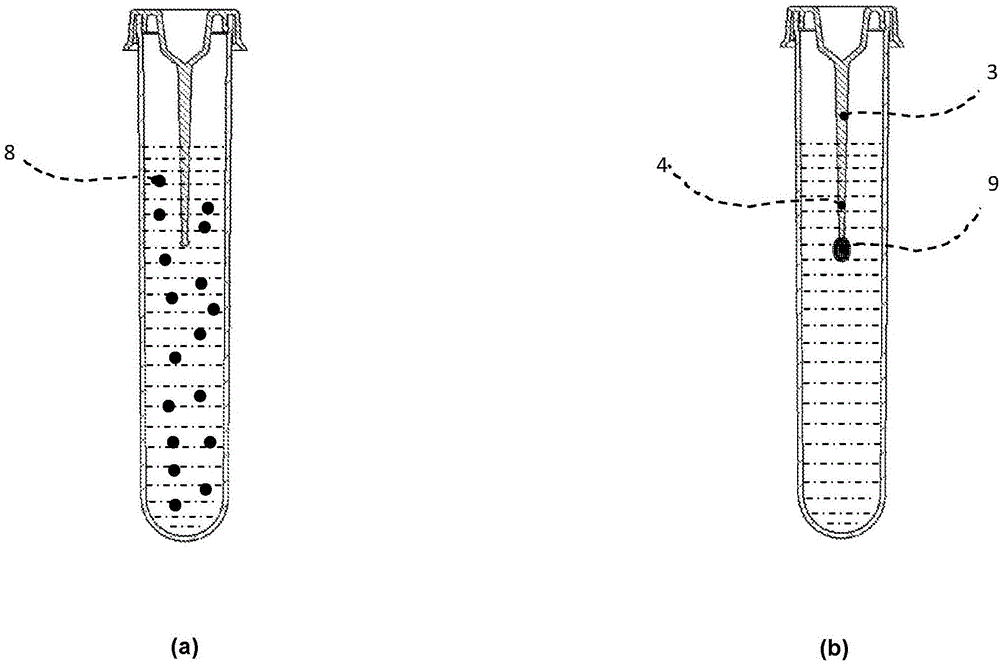
图2是用于从样品分离和浓缩靶标颗粒或分子的装置操作的示意图。如图2(a)中所示,根据本发明的装置设计成接收可包括待分离或浓缩的靶标颗粒或分子(8)的液体样品。样品可包括作为天然组分(例如血液)的纤维蛋白原。在待处理的无纤维蛋白原的样品的情况下,容器(1)应包括作为与无纤维蛋白原样品混合的添加剂的纤维蛋白原。图2(b)显示,当将样品添加到装置时,液体内的纤维蛋白原(来子样品的天然或非天然的)在将样品经受凝血酶或类凝血酶酶时将至少部分地转化为纤维蛋白,从而形成将捕捉靶标分子或颗粒的纤维蛋白网。如此形成的纤维蛋白网将缩回以形成钩挂或粘附在锚元件(4)周围的聚合的纤维蛋白团块(9)。
图3是用于从样品分离和浓缩靶标颗粒或分子的装置操作的示意图。在纤维蛋白网缩回到钩挂在锚元件(4)周围的聚合的纤维蛋白团块(9)中时,具有锚元件(4)和钩挂的聚合的纤维蛋白团块(9)的封盖(2)将从容器(1)中取出,从而将带有捕捉的靶标的聚合的纤维蛋白团块(9)从样品介质分离。在随后的步骤中,封盖(2)可浸入含有将溶解纤维蛋白团块的再悬浮液体介质(7)的第二容器(6)中,从而允许回收靶标分子或颗粒(8)。第二容器(6)优选小于根据本发明的装置。
图4是靶标回收和再悬浮装置的优选实施例的示意图,靶标回收和再悬浮装置包括用于容纳再悬浮液体的较小的第二容器(6)。容器(6)包括适于接收诸如封盖(2)的盖的敞开的第一顶端,所述盖包括根据本发明的装置的锚元件(4)。容器(6)还包括限定用于容纳再悬浮液体的储液部分(7)的第二封闭底端和至少一个内壁,再悬浮液体允许溶解纤维蛋白团块并由此回收靶标(8)。通过将封盖(2)的锚元件(4)浸入回收容器(6)中来实现靶标回收。
图5示出了锚元件(4)的不同实施例:即(4a)环形,(4b)化学或生物涂层和(4c)不规则钩形。
图6是使用根据本发明的装置从含纤维蛋白原的样品中分离和浓缩靶标颗粒或分子的方法的总体操作的示意图。在步骤1中,将样品添加至装置的容器。在步骤2中,存在纤维蛋白网形成反应。在步骤3中,纤维蛋白团块围绕装配在管盖上的疏水针(锚元件)缩回。步骤4是团块分离阶段。在步骤5中,将团块浸入小容积的再悬浮溶液中。最后,在步骤8中,回收靶标颗粒或分子。
图7是用于从液体样品中分离和浓缩靶标颗粒或分子的装置的优选实施例的示意图,所述装置包括相对于图1的装置不同的向上延伸的细长针元件(3),针元件浸入在储液部分(5)中并且定位在容器(1)的封闭底端中。细长针元件(3)还在其上端处包括锚元件(4)。在操作中,形成聚合的纤维蛋白团块(9)的缩回的纤维蛋白网将钩挂或粘附在锚元件(4)的周围。如此形成的纤维蛋白团块可随后通过倒出周围的液体介质而分离。通过向同一容器(1)中添加将溶解纤维蛋白团块的纤维蛋白团块溶解缓冲液(7)从而允许回收靶标分子或颗粒(8)以实现靶标回收。
具体实施方式
如图1中所示,根据本发明的用于从含纤维蛋白原的液体样品中分离和浓缩靶标颗粒或分子的装置包括:用于收集样品的容器(1)以及封盖(2)。容器(1)包括限定用于接收样品的储液部分(5)的第一顶端和第二底端和以及至少一个内壁,其中储液部分包含至少一个锚元件(4)以局部钩挂在将样品添加到容器时形成的聚合的纤维蛋白团块(9),并且其中靶标颗粒或分子被捕捉在聚合的纤维蛋白团块内。
本发明还包括用于收集和处理生物样品的方法,所述方法包括:提供容器,所述容器包含处于适当浓度的凝血酶和潜在纤维蛋白原以导致靶标分子或颗粒从周围的复杂液体介质的高效分离。该方法还允许回收在聚合的材料内高度浓缩的靶标并且优选具有初始样品容积的最多1/10的容积的靶标。此外,所公开的方法的优点是达到初始样品容积的1/100至1/1000的浓缩速度的能力。这样浓缩的靶标可随后通过进一步纯化步骤非常容易地加工和/或使用现有技术方法直接分解。
所公开的装置的一个主要优点是通过将锚元件(4)集成到装置中来允许靶标颗粒或分子的自动和容易分离,锚元件(4)将局部钩挂、粘附聚合的纤维蛋白团块或使聚合的纤维蛋白团块成核。在实践中,锚元件(4)以某种方式构成“成核”点,纤维蛋白团块将围绕所述“成核”点形成并缩回到如图2中所示的小团块中。在优选实施例中,锚元件(4)与包括细长针元件(3)的封盖(2)是一体的,在封闭所述盖时,细长针元件浸入包含在储液部分(5)中的液体样品中。在该构造中,锚元件(4)位于或朝向针元件(3)的端侧。
锚元件(4)在盖中的集成具有允许容易分离钩挂在锚元件(4)周围的聚合的纤维蛋白团块(9)的优点。如图3中所示,包含带有钩挂的聚合的纤维蛋白团块(9)的锚元件(4)的封盖(2)可从容器(1)中从初始样品介质取出,从而实现分离带有靶标被捕捉在其中的浓缩的聚合的纤维蛋白团块(9)。如图4中所示,然后可将封盖(2)插入包含用于靶标回收的再悬浮液体介质(7)的较小容器(6)中。
尽管通过优选实施例已经说明了本发明,其中锚元件(4)集成在封盖中,但实际上锚元件也可以是装置容器(1)的一部分,如例如集成到储液部分的壁或底侧中(如图7中所示)。在这种情况下,分离过程将通过从装置容器(1)倒出样品,同时保持纤维蛋白团块附着(或钩挂)至锚元件(4)来实现。通过向同一容器(1)添加纤维蛋白团块溶解缓冲液(7)(如图7c中所示)来实现靶标回收,纤维蛋白团块溶解缓冲液将溶解纤维蛋白团块由此允许回收靶标分子或颗粒(8)。
根据本发明的锚元件可以是具有不规则或规则形状的任何局部部分,如图5中所示的锚元件。在优选实施例中,锚元件可以是允许纤维蛋白团块的局部附着的局部表面涂层。这种涂层的非限制性实例包括化学涂层(例如疏水涂层)和生物涂层(例如纤维蛋白原/纤维蛋白结合分子诸如凝血酶、凝快因子XIII、细菌纤维蛋白原结合蛋白和组织纤溶酶原激活物(t-PA))。
如本文公开的装置可包括任何样品收集装置,样品收集装置包括诸如试管和离心管的管;诸如收集袋的封闭系统样品收集装置;特别是预填充注射器的注射器;导管;微孔和其它多孔板;阵列(array);管子;诸如烧瓶和组件的实验室容器;移液管和移液管吸头等。一般来说,本发明涉及适于容纳生物样品的任何容器以及涉及转移样品的容器和元件,只要它们满足本文概述的标准。
基于前述公开,本发明还包括使用样品收集装置用于从样品分离靶标分子或颗粒的方法,样品收集装置可以非常容易地手动使用或与现有技术的自动系统集成,自动系统使得该样品制备方法容易地集成在如图6中所示的常规实验室工作流程中。
样品容器的容积在0.1至100ml之间、并且优选在0.1至10ml之间。样品中纤维蛋白原的浓度优选为至少0.1μg/ml。在优选的实施例中,样品中纤维蛋白原的浓度在0.1至100mg/ml之间、并且最优选在10mg/ml至10μg/ml之间。
装置可以进一步包括作为添加剂的凝血酶或凝血酶酶。样品的凝血酶浓度为0.01至10I.U./ml,并且优选在0.1至2I.U./ml的范围内。在实践中,凝血酶或类凝血酶酶的量必须根据装置内的纤维蛋白原浓度进行调整以获得期望的纤维蛋白网状结构和团块尺寸。凝血酶量优选小于20I.U.凝血酶/mg纤维蛋白原,优选在0.01至10I.U.凝血酶/mg纤维蛋白原之间的范围内,更优选在0.1至1I.U.凝血酶/mg纤维蛋白原之间。
在血液样品例如全血的情况下,根据本发明的样品收集装置还可以包括促进样品内的内源性凝血酶的产生的凝结剂。这样的促进剂可例如选自包括诸如高岭土、Celite、硅藻土和玻璃纤维的粉末或纤维状硅酸盐化合物、诸如碳酸钙和硫酸钙的钙化合物的细粉末、衍生自蛇毒的凝血酶样物质以及可以活化血液制粒因子以促进凝结的多酚的组。此外,这些凝结促进剂可例如单独或组合添加至样品中或涂覆在样品容器的壁内侧。这种促进剂的量必须以控制凝结过程和获得小纤维蛋白团块尺寸的方式调节。
在控制纤维蛋白网结构以便从样品捕捉靶标分子或颗粒的优选实施例中,根据本发明的样品收集装置可进一步包括允许调节钙浓度的添加剂。在实践中,这可以通过向装置中添加钙离子源来实现。钙离子源优选为氯化钙(CaCl2),优选浓度范围在1至10mg/ml样品容积之间,甚至更优选在4至7mg/ml样品容积之间,最优选在5至6mg/ml样品体积之间。例如,在血液样品中自然存在钙,并且可以通过向装置中进一步添加诸如GDTA、EDTA或柠檬酸盐的钙螯合剂来实现钙浓度的调节。
此外,根据本发明的装置可以包括添加剂,添加剂包含具有(I)纤维蛋白/纤维蛋白原结合部分和(II)针对靶标分子或颗粒的物质捕获部分的分子。因此,针对靶标分子或颗粒的物质捕获部分可选自包括设计用于特异性识别所述靶标分子或颗粒的抗体、核酸和适体的组。此外,物质捕获部分可与选自包括凝血酶、纤连蛋白、细菌纤维蛋白原结合蛋白、组织型纤溶酶原激活物、整合素和衍生自该组的任何构件的部分的组的纤维蛋白/纤维蛋白原结合部分偶联或组合。在优选的实施例中,纤维蛋白/纤维蛋白原结合部分和物质捕获部分在融合分子中组合。
此外,根据本发明的装置可包括包含纤维蛋白原重组蛋白的添加剂。这种重组纤维蛋白原蛋白可被特异性设计以增强或抑制重组纤维蛋白原蛋白与在装置内使用下的样品中包含的特定靶标分子或颗粒的亲和相互作用。在优选的实施例中,在装置内在使用中的重组蛋白是具有针对所述靶标分子或颗粒的捕获部分结构域的纤维蛋白原融合蛋白。在另一个实施例中,纤维蛋白原融合蛋白进一步包括降解位点。降解位点对于在溶解步骤期间从纤维蛋白网中回收结合的靶标分子或颗粒将特别有用。在优选的实施例中,降解位点是酶或水解降解位点。在最优选的实施例中,降解位点是酶降解位点,酶降解位点被选自包含纤溶酶和基质金属蛋白酶的组的酶切割。
在实践中,所有前述添加剂可在样品收集之后添加到样品中或者已经集成在装置内。在最后一种情况下,可将添加剂整合溶解在缓冲水溶液中。在优选的实施例中,所述添加剂能够以冻干形式包含在装置内,所述添加剂可在装置使用之前或在将样品引入装置中时被溶解。
根据本发明的样品收集装置可用于分离和浓缩靶标分子或颗粒,诸如靶标细胞、细胞组分、细胞亚群(真核以及原核)、细菌、病毒、寄生虫、抗原、特异性抗体、毒素、蛋白质、核酸序列以及类似物。
根据本发明的样品收集装置可用于从不同样品中分离和浓缩靶标分子或颗粒。通常,这包括全血、血液衍生物、血液成分以及无纤维蛋白原样品(包括但不限于尿、痰和拭子)。在这方面,本文中的样品可指需要测试的任何样品类型,包括食品、临床、环境和实验样品。
在实践中,装置还可包括识别码。这样的识别码可以通过但不限于添加到装置的代码条或颜色或者通过装置本身的尺寸和/或形状来确定。这种识别码可用作装置的预期用途和应用的参考或指示。根据本发明的若干个实施例的装置实际上可根据装置组成、装置将使用的样品类型和/或需要分离的靶标而区分。
本领域技术人员将理解,可在不脱离本发明的范围的情况下配置刚刚描述的优选实施例的各种改型和变型。因此,应当理解,在所附权利要求的范围内,本发明能够以与本文具体描述不同的方式实施。
- 还没有人留言评论。精彩留言会获得点赞!