锰氧化物催化剂、包含所述锰氧化物的整体式催化剂以及它们的应用的制作方法
本发明涉及锰氧化物催化剂、包含所述锰氧化物的整体式催化剂以及它们的应用,具体涉及一种用于催化氧化去除挥发性有机化合物(voc),尤其是去除甲醛的锰氧化物催化剂。
背景技术:
:主要来自家具和建材的甲醛、苯、甲苯对人体健康产生潜在的不利影响。甲醛已被列为可疑致癌物。因此,甲醛的减排是一个亟待解决的问题。现今,传统的除去室内空气污染物的方法是使用固体吸附剂,如活性炭、沸石、改性中孔二氧化硅、层状粘土和金属有机骨架化合物(mof)进行吸附。在这些吸附剂中,活性炭是最常用的。其高的比表面积、丰富和容易改性的表面官能团赋予其对室内污染物高效的物理或化学吸附性能。然而,活性碳吸附剂因其有限的吸附量导致必须频繁地更换,并且其再生会导致二次污染。这些缺点限制了其实际应用。另一种常用的策略是光催化,最常规的光催化剂是二氧化钛。然而,使用光源(尤其是紫外光)会使空气滤清器的设备结构较复杂,并会导致产生臭氧。与这两种常用的方法相比,催化氧化是一种用于去除室内污染物(如,甲醛或hcho)的具有更大吸引力和希望的解决方案,它不需要引入光,仅仅生成co2和h2o,无二次污染。报道了两种氧化催化剂,包括负载在氧化物和不含贵金属的过渡金属氧化物上的贵金属。贵金属(铂、钯、金、银)可以很容易地在较低温度下活化污染物分子,这使得它常用作活性成分来以除去甲醛。现有技术报道了使用tio2负载贵金属来氧化甲醛。他们发现,铂表现出比其它贵金属更好的催化氧化性能。此外,铂纳米粒子具有高的分散性和小尺寸(≈1nm),其可以在室温(20℃)下完全降解甲醛。现有技术中还报道了负载在tio2的少量pt(0.1重量%)能在室温下有效降解甲醛。他们还研究了pt的价态和粒径以及氧化物载体特征对甲醛氧化的影响。证明pt(100%效率)比氧化铂(25%效率)具有更高的甲醛去除性能。pt的粒径分布对催化剂的氧化活性影响很大。具有高表面积的氧化物载体可以负载粒径分布窄的pt纳米颗粒,从而提高了催化活性。金是另一个常用于除去甲醛的贵金属。现有技术报道了负载au的zro2催化剂可以降解甲醛,并发现甲醛的氧化发生在au和氧化锆之间的界面处,活性位点被归于au和的au3+。但au的负载量为4重量%时,在80℃下可以实现甲醛的完全降解。此外,现有技术中还提及负载银的sba-15催化剂。ag的高分散性和小粒度(2.83纳米)被认为是在100℃下完全降解甲醛的关键。过渡金属氧化物也常用载体加载贵金属,其中,氧化锰是最常用的。由于贵金属和过渡金属氧化物载体之间的强相互作用(强金属-载体相互作用,smsi),这种复合催化剂通常表现出比基于其他氧化物基质的较高的催化性能。现有技术中提及负载mnox的氧化铝(具有或不具有pd催化剂)可氧化甲醛和甲醇。发现,当pd和mn含量分别为0.1%(重量)和18.2重量%时,其引发温度降低到80℃。催化性能的改善可以归因于mn和pd之间的协同效应(mnox可以释放氧气来将钯氧化为pdo,其上的有机污染物可以被氧化和降解,并在同一时间将pdo还原为钯)。现有技术还报道了负载银和pt的mnox-ceo2催化剂用于甲醛降解。ag/mnox-ceo2在100℃下完全降解甲醛。在这个系统中,氧化铈是氧存储的良好部件,在甲醛氧化和除去的过程中,活性氧从氧化铈通过mnox转移到银。pt/mnox-ceo2催化剂可以在室温下完全降低甲醛,因为在pt和金属氧化物之间的界面存在大量活性位点,从而氧分子可以容易地激活mnox-ceo2。现有技术还报道了mno2的不同形貌(茧状、海胆状和巢状),然后将pt负载其上来进行甲醛的催化氧化。结果表明,负载2重量%pt的巢状的mno2表现出最佳的催化性能(在70℃下完全降解甲醛),而没有贵金属的二氧化锰在200℃下才完全降解甲醛。虽然当所负载的贵金属具有窄粒度分布和高分散时,上述催化剂可以在室温降解甲醛,但尚未提及湿气的影响。事实上,贵金属通常往往会在湿气中失去活性。由于贵金属有限的储量和高成本,开发不含贵金属的催化剂具有十分重要的意义。金属氧化物尤其是过渡金属氧化物因其多价态是常用的在高温下氧化去除烃化合物的催化剂。现有技术报道了通过kmno4和油酸之间的反应制备中空的多孔式kxmno2纳米球和中孔的多孔式kxmno2纳米球。前者在80℃下完全氧化甲醛,后者在85℃下才完全氧化甲醛。然而,这些催化剂在室温下均未显示催化活性。现有技术比较了具有不同晶形(软锰矿、钾锰矿和软锰矿)的二氧化锰的性能。虽然起始于不同的前体,但所有样品均在300℃下煅烧得到具有较高结晶性的样品。三种晶形式显示在低于100℃的温度下几乎没有催化性能。现有技术种制备了呈单分散纳米球(小于50nm)的结晶mnox,将其涂覆到活性炭过滤器,在室温下除去低浓度的甲醛和voc。所述mnox样品主要包括mn2+、mn4+、o以及少量的k。所述催化剂有效的去除相对低浓度的甲醛,例如200ppb,但是尚未提及对更高浓度甲醛的去除效率。更重要的是,不清楚其去除甲醛的主要贡献是mnox还是活性炭过滤器。目前,一些文献报道了mn3o4(mn12+[mn23+]o42-)的氧化工艺:首先,mn(2+)氧化成mn(3+),以形成mn2o3(mn23+o32-);然后,一些mn(3+)氧化成mn(4+),以形成mn5o8((mn14+[mn43+]o82-),但在这些文献中,mn(2+)、mn(3+)和mn(4+)不会共存。而且,这些文献没有提及或研究所述锰氧化物的催化性能。此外,一些文献中提及的锰氧化物材料是结晶良好的,且表面积低。虽然过渡金属氧化物是清除室内污染物的潜在和有效的催化剂,但目前仍需要提供一种新的催化剂,用于低成本和高效率的去除挥发性有机化合物,尤其是甲醛。技术实现要素:本发明示例实施方式的目的在于解决现有技术中存在的上述和其它的不足。一方面,本发明提供一种锰氧化物催化剂,其中,所述锰以包含mn2+、mn3+和mn4+的多价态形式存在。在一些实施方式中,所述锰氧化物是部分结晶的。在一些实施方式中,所述锰氧化物包含δ相。在一些实施方式中,所述锰氧化物具有多孔结构,比表面积大于10m2/g,大于50m2/g,或者大于100m2/g。在一些实施方式中,所述多孔结构的孔径为2-50nm,或者5-20nm。另一方面,本发明提供一种整体式催化剂,所述整体式催化剂包含多孔基体以及负载在所述多孔基体上的所述锰氧化物催化剂。又一方面,本发明提供所述锰氧化物催化剂在去除挥发性有机化合物中的应用。在一些实施方式中,所述挥发性有机化合物包括甲醛。又一方面,本发明提供所述整体式催化剂在去除挥发性有机化合物中的应用。在一些实施方式中,所述挥发性有机化合物包括甲醛。通过下面的详细描述、附图以及权利要求,其他特征和方面会变得清楚。附图简述通过结合附图对于本发明的示例性实施例进行描述,可以更好地理解本发明,在附图中:图1显示了本发明一些实施方式中用于去除甲醛的一次测试工作台的示意图;图2是本发明一些实施方式中合成的锰氧化物样品的x射线衍射图(xrd);图3a是本发明实施例1样品的高分辨率的透射电镜图(hrtem);图3b是实施例4样品的高分辨率的透射电镜图(hrtem);图3c是实施例5样品的高分辨率的透射电镜图(hrtem);图4是本发明制备的锰氧化物样品的氮气(n2)吸附-脱附等温线;图5a是本发明实施例1样品的mn2p的x射线光电子(xps)光谱;图5b是实施例4样品的mn2p的x射线光电子(xps)光谱;图5c是实施例5样品的mn2p的x射线光电子(xps)光谱;图6a是在室温、在不同时间下记录的甲醛输入下实施例1样品的漫反射傅里叶变换红外光谱(drift);图6b是在不同温度下记录的实施例1样品在输入甲醛下的drift谱;图7a是本发明实施例1样品在室温下去除1ppm和0.2ppm甲醛的效率;图7b是本发明实施例1样品从40℃缓慢升温(5小时)到85℃,并在85℃下恒温地去除1ppm甲醛的效率;图7c是实施例4和2的样品去除1ppm甲醛的效率;图7d是对比例1的样品去除1ppm甲醛的效率;图7e是本发明实施例2样品在室温下去除1ppm甲醛的效率;图8是本发明实施例3所述样品的x射线衍射图(xrd);和图9是本发明实施例3样品去除1ppm甲醛的效率。发明详述除非另作定义,权利要求书和说明书中使用的技术术语或者科学术语应当为本发明所属
技术领域:
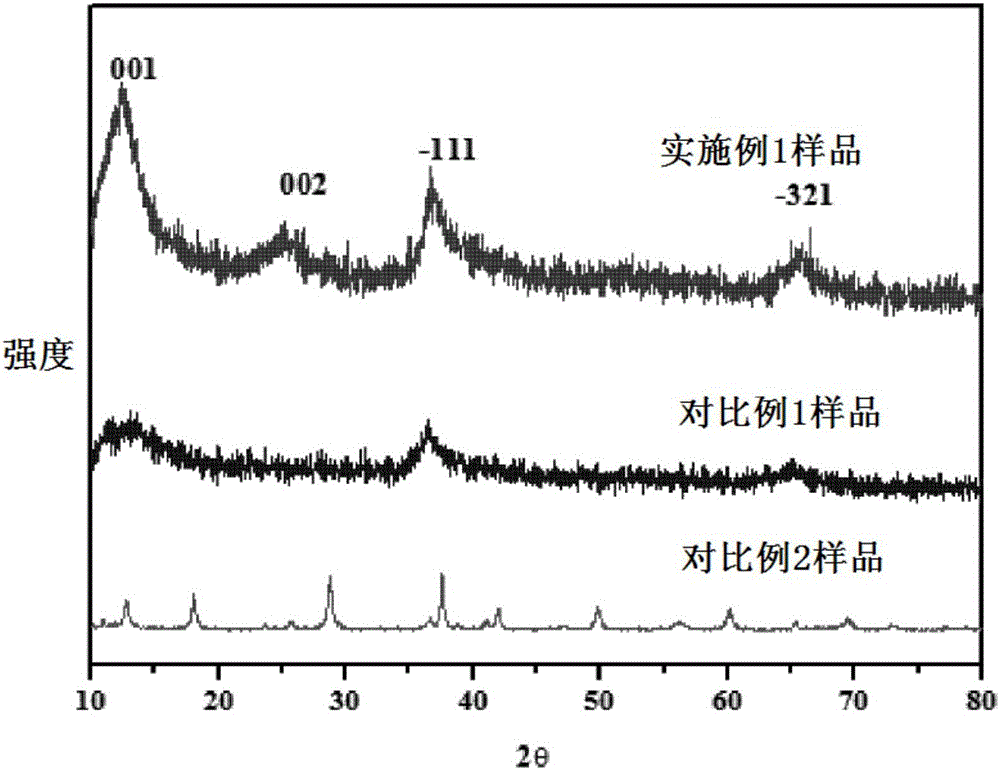
内具有一般技能的人士所理解的通常意义。在本文中,用来对例如组合物中成分的量、浓度、过程温度、过程时间、流速、和类似数值及其范围,或者组件的尺度和类似数值及其范围进行修饰的“约”指的是可能发生的数值量的改变,例如,源自用于制备材料、组合物、复合体、浓缩物、组件部件、制品的制造或使用制剂所用的常规测量和操作过程;源自这些过程中的偶然性误差;源自用来实施方法的制造、来源或起始材料的纯度或成分的差异;以及类似因素。在本文中,当给出数值范围例如5-25时,这指至少5或不小于5以及分开地和独立地不大于或小于25。在一些实施例中,这种范围可独立地限定为不小于5,以及分开地和独立地不大于25。具有这种范围例如10-15,或10-20的值也分开地和独立地以相同的方式包括所述范围的下限值和上限值。如本文所用,除非有具体的相反表示,否则,组分的“重量%”或“重量百分数”是以包含该组分的组合物或物件的总重量为基准的。术语“包括”或者“包含”等类似的词语意指出现在“包括”或者“包含”前面的元件或者物件涵盖出现在“包括”或者“包含”后面列举的元件或者物件及其等同元件,并不排除其他元件或者物件。在本文中,术语“锰氧化物”是指自然界或人工合成的许多层状结构的锰氧化物,因来源和制备方法不同,它们具有一定的含水量和外来杂离子;其中,杂离子可以是碱金属或者碱土金属;并且其也可以带有一定的结晶水。在本文中,术语“挥发性有机化合物(voc)”是指一种挥发性有机化合物和/或多种挥发性有机化合物,可以相同(例如,具有相同的分子)或不同。在本文中,术语“多孔基体”是指其中具有许多流通孔结构的基体。在一些实施方式中,所述多孔基体包括多孔陶瓷、多孔金属、多孔泡沫、多孔棉、多孔碳等,主要它们不会显著的影响催化氧化去除voc即可。在一些实施方式中,多孔基体是包含许多交叉孔隙壁的多孔蜂窝体结构,所述孔隙壁限定了敞开通道,在蜂窝体结构的相对末端之间延伸。在本发明中,所述锰氧化物催化剂具有部分结晶的相、高比表面积,包含mn2+、mn3+和mn4+的多价态形式,和/或二维层状结构。在本发明一些实施方式中,所述锰氧化物催化剂中的锰以包含mn2+、mn3+和mn4+的多价态形式存在。本发明的发明人创造性的发现,mn3+的存在可大大促进催化氧化,这是因为mn3+/mn4+的转移能量比mn2+/mn4+的转移能量低得多。在一些实施方式中,所述锰氧化物是部分结晶的。在一些实施方式中,所述锰氧化物包含δ相。在本文中,δ相为层状结构,属于单斜晶系。本发明的发明人发现,这种部分结晶的锰氧化物在催化氧化方面具有出乎意料的技术优势:一方面,所述锰氧化物的结晶部分可以提供晶格氧;另一方面,所述锰氧化物的无定形部分具有一些缺陷,这些缺陷提供用于催化的活性中心。在本发明中,所述高比表面积和二维层状结构可以提供更具活性的催化氧化反应中心。在一些实施方式中,所述锰氧化物具有介孔结构,比表面积大于10m2/g,大于50m2/g,或者大于100m2/g。在一些实施方式中,所述介孔结构的孔径为2-50nm,或者5-20nm。在本发明一些实施方式中,以锰的总摩尔百分数计,mn4+的含量是20-60%、30-50%、或35-45%;mn3+的含量是20-60%、30-50%、或35-45%;mn2+的含量是0-30%、5-25%、8-15%或10-13%,前提是mn2+、mn3+和mn4+的总和为100%。在本发明一些实施方式中,本发明所述锰氧化物催化剂具有以下一种特征或多种特征的任意组合:(1)锰以包含mn2+、mn3+和mn4+的多价态形式存在;(2)所述锰氧化物是部分结晶的;(3)所述锰氧化物包含δ相;(4)所述锰氧化物具有多孔结构,比表面积大于10m2/g、大于20m2/g、大于30m2/g、大于40m2/g、大于50m2/g、大于60m2/g、大于70m2/g、大于80m2/g、大于90m2/g、大于100m2/g、大于120m2/g、大于150m2/g、大于200m2/g或者大于300m2/g;以及(5)所述锰氧化物具有多孔结构,该多孔结构的孔径为2-50nm、3-40nm、4-30nm或者5-20nm。在本发明中,因来源和/或制备方法不同,所述锰氧化物催化剂具有一定的含水量(例如,结晶水)和/或外来杂离子;其中,杂离子包括当不限于碱金属(例如,钾(k))、碱土金属等。本发明中,所述锰氧化物催化剂具有的结晶水和/或外来杂离子对于其催化氧化反应的活性没有任何显著和实质性的影响。在本发明中,所述整体式催化剂包含多孔基体以及负载在所述多孔基体上的所述锰氧化物催化剂。在一些实施方式中,所述多孔基体包括多孔陶瓷(例如,多孔堇青石陶瓷)、多孔金属、多孔泡沫、多孔棉、多孔碳等,前提是它们不会显著的影响催化氧化去除voc。在一些实施方式中,所述整体式催化剂除包含本发明所述锰氧化物催化剂以外基本不含或完全不含任何贵金属,所述贵金属例如但不限于,铂、钯、金、银等等。术语“基本不含”是指除制造整体式催化剂和/或本发明所述锰氧化物催化剂时可能不可避免带入了一些作为杂质存在的贵金属外,不加入任何对其催化氧化具有积极或消极影响的任何贵金属。在一些实施方式中,所述锰氧化物催化剂负载到多孔基体(例如,蜂窝状陶瓷或蜂窝状碳)上,形成整体式催化剂。在本文中,术语“负载”包括但不限于加入、涂覆(例如,浸渍)、覆盖等,不限于直接的接触还是间接的接触,也不限于部分的负载还是完全的负载。在本发明中,所述锰氧化物催化剂或所述整体式催化剂是在温和条件(例如,室温)下催化氧化除去室内空气中低浓度甲醛或其它挥发性有机化合物污染物的有前景希望的候选者。因此,本发明提供所述锰氧化物催化剂和所述整体式催化剂在去除挥发性有机化合物中的应用,尤其是在温和温度(例如,室温)下去除挥发性有机化合物中的应用。在本发明一些实施方式中,所述温和温度包括大于0℃且小于100℃、5-90℃、10-85℃、25-85℃、40-85℃、40-60℃、25-40℃、25-50℃或40-50℃。在一些实施方式中,所述挥发性有机化合物包括甲醛。在使用所述锰氧化物催化剂或所述整体式催化剂来除去例如1ppm和0.2ppm的voc,尤其是甲醛时,在室温下显出优良的去除效率。在65-85℃时,该催化剂表现出长期的有效除去甲醛的持续时间。相比现有技术(例如,us20140255283a1)中完全结晶且锰以mn2+和mn4+存在的样品,本发明的锰氧化物催化剂在室温或温和温度、高空速(~48000小时-1)下去除相对低浓度(例如,1ppm和0.2ppm)甲醛时表现出更高的去除效率。而且,本发明锰氧化物的制备方法是简单、环境友好且成本有效:(1)kmno4和草酸进行氧化还原沉积反应,并用硼氢化钠在室温下进行后处理;或(2)在室温下使用kmno4和醇进行直接的氧化还原沉积反应。在本发明中,x射线衍射图谱(xrd)使用rigakud/max-rbx-ray衍射计(cuk辐射:40kv和40ma)进行测量,扫描速度为约4°/分钟。在本发明中,能量色散谱(eds)由安装在200kv下操作的jem-2010电子显微镜上的附带的oxford链isis能量色散谱仪来获得。在本发明中,高分辨透射电子显微镜(hrtem)分析使用jeol200cx电子显微镜在约200kv下进行。在本发明中,在77k下的氮吸附-脱附等温线在tristar3000(购自美国micromeriticsinstrument)上测量。所有样品在进行测量之前在流动氮气下在150℃下脱气约12小时。在本发明中,比表面积(sbet,brunauer–emmett–teller(bet))通过使用bet方法得到的等温线计算获得。在本发明中,x射线光电子谱(xps)的信号用单色镁kαx射线在1253.6ev处在vgmircomkii仪器上收集,在120w下操作。所有元件结合能参照位于284.6ev的c(1s)线。在本发明中,紫外可见吸收光谱使用由shimadzucorporation制造的uv-3101pc仪器进行。在本发明中,使用drift技术在nicoletis10上记录红外光谱,并从4000扫描至600厘米-1(64次扫描,4cm-1分辨率)。在进行drift实验之前,在室温下,使用20体积%o2/n2的气流扫掠所述催化剂约60分钟。然后,使气态甲醛通过样品孔隙,所述气态甲醛由约20体积%o2/n2以200毫升/分钟的速度从质量流量控制器通过37%甲醛溶液来产生,每10分钟记录drift光谱。如果需要加热,则每10度记录drift光谱。在本发明中,甲醛去除测试在图1所示的设备上进行。图1显示了本发明所述一次测试工作台的构造。其中,mfc表示气体质量流量计,v1、v2……v11均表示各阀门。总流速(空气由压缩空气机产生)设定在约52升/分钟。将甲醛气体(浓度:约1ppm和0.2ppm)从5重量%甲醛溶液中鼓泡的流速是约2升/分钟和约0.5升/分钟。开始时,所有阀门都是开放的。当关闭阀门v7、v10和v11时,以约0.5升/分钟的流速、5分钟的取样时间在“取样点”对进口气体进行取样。当关闭阀门v8和v9时,在相同的取样条件下对出口气体进行取样。根据国标gb/t18204中所述的方法测定进口气体和出口气体中甲醛的浓度c进口和c出口(在安捷伦(agilent)cary60紫外可见分光光度计中测定)。通过以下公式计算甲醛去除效率:具体实施方式实施例制备例1.本发明所述锰氧化物催化剂以下述两种方式制备。方法1:(1)使kmno4溶液和草酸溶液在室温下反应,形成无定形锰氧化物;和(2)使用nabh4,在室温下对步骤(1)获得的无定形锰氧化物进行后处理,形成所述锰氧化物。方法2:使kmno4溶液与醇在室温下进行氧化还原沉积反应,形成所述锰氧化物。制备例2本发明包含锰氧化物的整体式催化剂按照以下方式制得:(1)提供来自康宁有限公司的2mgo-2al2o3-5sio2的蜂窝体陶瓷,所述蜂窝体是矩形(立方体:截面为1平方英寸,长度为3.9英寸),并且孔隙密度为每平方英寸230孔隙;(2)在所述蜂窝体陶瓷整料上涂覆有氧化铝;(3)在约550℃下退火过夜;(4)将本发明锰氧化物涂覆到其上。实施例1将1.58克kmno4溶解在60毫升的去离子水中,将1.89克c2h2o4·2h2o溶解在100毫升去离子水中。然后在搅拌下,将kmno4溶液滴加到草酸溶液。在室温下搅拌所得混合物约24小时。然后,过滤该棕色浆液,用去离子水洗涤三次,并在约120℃下干燥过夜。在将0.4mnabh4溶液(nabh4与无定形锰氧化物的摩尔比为2:1)快速加入到无定形锰氧化物的分散液中后,将所得混合物保持搅拌约15分钟。过滤产物,用水洗涤,并在约80℃下干燥过夜。然后将样品涂覆在陶瓷蜂窝体上。实施例2将1.58克kmno4溶解在60毫升的去离子水中,将1.89克c2h2o4·2h2o溶解在100毫升去离子水中。然后在搅拌下,将kmno4溶液滴加到草酸溶液。在室温下搅拌所得混合物约24小时。然后,过滤该棕色浆液,用去离子水洗涤三次,并在约120℃下干燥过夜。在将0.4mnabh4溶液(nabh4与无定形锰氧化物的摩尔比为2:1)快速加入到无定形锰氧化物的分散液中后,将所得混合物保持搅拌约15分钟。过滤产物,用水洗涤,并在约80℃下干燥过夜。然后将样品涂覆在碳蜂窝体上。实施例3在将31.6克kmno4溶于600ml水后,将该溶液滴加到17.5毫升乙醇中。在过滤之前,该溶液于室温下搅拌约24小时。将过滤粉末干燥,然后涂覆到陶瓷蜂窝体上。实施例4(无定形样品)按照实施例1中制备无定形锰氧化物,但未进行nabh4后处理(制备例方法1中步骤(1)制得)。将1.58克kmno4溶解在60毫升的去离子水中,将1.89克c2h2o4·2h2o溶解在100毫升去离子水中。然后在搅拌下,将kmno4溶液滴加到草酸溶液。在室温下搅拌所得混合物约24小时。然后,过滤该棕色浆液,用去离子水洗涤三次,并在约120℃下干燥过夜。得到实施例4的样品,然后将样品涂覆在陶瓷蜂窝体上。实施例5(结晶样品)在约500℃下,以1℃/分钟的升温速度进一步焙烧实施例4中的无定形锰氧化物,由此获得实施例5的样品。然后,将样品涂布在陶瓷蜂窝体上。对比例1(结晶样品且mn以mn2+和mn4+的价态存在)如在us20140255283(a1)中详述,使用化学共制备方法制得mno2(二氧化锰)。将kmno4和mnso4分别溶解在蒸馏水中,摩尔比保持在2:3。在室温下,在恒定搅拌下将kmno4溶液缓慢加入mnso4溶液中。约24小时后,过滤所得到的悬浮液并用去离子水洗涤几次,以去除任何杂质。将得到的产物在空气中在100℃下加热约12小时。图2显示了实施例4和5中的样品以及实施例1中的样品的x射线衍射(xrd)图。所述xrd图清楚地显示:因为只在36.5°处找了弱且宽的峰,故实施例4的样品是无定形的。在进行nabh4后处理之后,在2θ=12.5°和25°处找到两个明显的信号,这与δ-二氧化锰(jcpds80-1098)一致,且可以指标为(002)和(001)晶面。结果表明,在实施例1样品中已经部分形成了结晶的δ-二氧化锰。但由于这样的具有二维层状结构的锰氧化物通常在某一结晶方向上是无序的,因此其结晶度不高。这种部分结晶的锰氧化物具有一定的优势。一方面,所述结晶部分可以提供晶格氧。另一方面,无定形部分可具有一些缺陷,由此提供用于催化的活性中心。对于实施例5中的样品,所有的峰均指示出一种四方的α-二氧化锰的晶体结构(jcpds44-0141),这表明合成的锰氧化物在500℃下在空气中煅烧后从δ-二氧化锰转变成结晶良好的α-二氧化锰。实施例1中样品的部分结晶性质可通过tem进一步证实。图3a是本发明实施例1样品的高分辨率的透射电镜图(hrtem)。除了因其二维层状结构而出现的0.7nm的层间间隔外,其还显示了指标δ-二氧化锰的(-111)面的0.24nm的间隔。相反的是,从图3b显示的实施例4样品的高分辨率的透射电镜图(hrtem)中仅观察到指标(001)面的隔层间隔的0.7nm边缘。这表明实施例4中样品是无定形结构。图3c是实施例5样品的高分辨率的透射电镜图(hrtem),清楚地显示了实施例5样品的晶格,显示该样品是结晶良好的。为了表征样品的孔结构的特征,在图4中记录了n2吸附-脱附等温线,并在表1中归纳了相应的孔结构参数。表1:所得锰氧化物样品的孔隙结构参数如图4所示,所有样品在0.1-1.0的相对压力范围内都具有n2吸附,这表明它们具有介孔结构。实施例1样品的比表面积比实施例4样品高,这可能是由于产生的氢气鼓泡或在锰氧化物和bh4-之间反应中锰氧化物的溶解-再结晶。合成的锰氧化物样品的表面化学组成和化学状态通过xps(图5)来分析。在642.2ev和653.6ev处具有结合能的两个峰分别对应于mn2p3/2和mn2p1/2。所述mn2p3/2可以去卷积成分别在641ev、642ev和644ev处具有结合能的mn2+、mn3+和mn4+。mn2+、mn3+和mn4+相应的分布列于表2中。这清楚地显示,在所有样品中,mn2+的量很低。表2:合成的介孔锰氧化物中mn2+、mn3+和mn4+的分布样品mn2+mn3+mn4+实施例1样品10.5%48.8%40.7%实施例4样品9.6%62.6%27.8%实施例5样品19.9%56.5%23.6%实施例4、实施例5和实施例1中各样品的mn4+百分数分别为27.8%、23.6%和40.7%。由于mn4+具有较强的氧化能力,希望样品中mn4+的比例较高,将有更好的催化性能。除mn3+和mn4+以外,所有的锰氧化物样品均含有mn3+。mn3+可大大有利于甲醛的催化氧化,因为mn3+/mn4+的转移能量比mn2+/mn4+的低得多。图6a是在室温下、在不同时间下记录的甲醛输入下实施例1样品的漫反射傅里叶变换红外光谱(drift)。可以观察到,在1027cm-1处有一个与吸附到催化剂表面上的双配位碳酸盐有关的强带。没有发现甲醛的特征峰。这表明,实施例1样品在室温下进行的是催化过程,而不是吸附过程。并且,在本发明这种催化剂上,甲醛可以氧化成碳酸盐,并且可能进一步氧化成二氧化碳。类似的,催化剂表面上双配位碳酸盐物质的积聚会覆盖活性位点,导致催化剂失活。但当催化剂加热到40℃时,峰的强度提高,这归因于碳酸盐的降低。当温度进一步升高时,双配位碳酸盐的峰进一步降低,在80℃出几乎消失。这显示温和加热催化剂可以加速催化剂表面上碳酸盐的脱附和分解,由此提高催化剂的活性和耐久度。图7a-7e是各样品去除低浓度甲醛的效率。对于实施例1的样品(图7a),当甲醛的进口浓度为1ppm时,室温下甲醛的去除效率达到52.7%,在420分钟后降低到29.3%。当甲醛的进口浓度为0.2ppm时,催化剂的耐久度可以达到864分钟。当温度缓慢从40℃升高到85℃(见图7b)时,实施例1样品上的甲醛去除效率从55%升高到80%,在34小时后,该催化剂在80℃时仍保持活性,这可能归因于催化剂表面上双配位碳酸盐的即时分解,如drift谱所示。但是,当甲醛的进口浓度为1ppm时,在实施例4和5样品上的甲醛去除效率(图7c)则低至36和37%,并在25分钟和50分钟之后降低到29%和21%。显然,实施例1的样品比实施例4和5的样品具有更好的性能。所述部分结晶相和部分无定形相、更高的mn4+比例以及足够的mn3+共同地大大提高了催化剂的性能,但它们各自对于提高催化剂性能均有出乎意料的贡献。本发明实施例3制得的样品也具有部分结晶的δ相,如图8所示。比表面积计算为208平方米/克。xps结果表明,样品中的锰具有mn2+(16.7%)、mn3+(45.8%)和mn4+(37.5%)的化学态。所述样品显示90%的初始去除效率和长得多的耐久度(见图9)。在对比例1中,还按照专利us20140255283a1制备了相应的催化剂样品。其声称该样品有结晶良好的六方锰矿(nsutitle)和钾锰矿相,其中锰的化学态为mn2+和mn4+。如图7d所示,样品的初始去除效率为21%。在90分钟后,效率降低至10%。显然,其性能比实施例1差,这可能是由于其相和锰的化学态存在差异。除了陶瓷(堇青石)蜂窝体,所述部分结晶的催化剂也涂覆到碳蜂窝体上(实施例2)。该样品显示出与实施例1样品类似的性能,这表明该催化剂可用于各种基材。总之,本发明所合成的锰氧化物显示出在室温或温和温度、高空速(~48000小时-1)下去除低浓度(1ppm和0.2ppm)甲醛时更高的去除效率。合成的催化剂具有高比表面积、多价态的锰(mn2+、mn3+和mn4+)和/或二维层状结构。当所述催化剂加热到85℃时,甲醛去除的耐久度延长,这是因为在催化氧化反应中形成的碳酸盐被即时脱附、并进一步分解成二氧化碳,这使锰氧化物上的活性位点不会失效。在室温下甲醛氧化去除的高催化活性中,锰的多价态和/或高比例的mn4+发挥了关键的作用。而mn3+的存在大大有利于甲醛的催化氧化,因为mn3+/mn4+的转移能量比mn2+/mn4+的转移能量低得多。本发明所述方法制得的不含贵金属的催化剂可以用于低成本和高效率的去除挥发性有机化合物,尤其是甲醛。虽然结合特定的实施例对本发明进行了描述,但本领域的技术人员可以理解,对本发明可以作出许多修改和变型。因此,要认识到,权利要求书的意图在于覆盖在本发明真正构思和范围内的所有这些修改和变型。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 过渡金属化合物、包含其的催化剂组合物和制备聚烯烃的方法与制造工艺
- 一种球形氮掺杂碳与过渡金属氧化物复合材料的制备方法与制造工艺
- 高氯酸铵内嵌的碳/金属氧化物复合催化剂及其制备方法与制造工艺
- 一种复合氧化物负载杂多酸催化合成尿囊素的方法与制造工艺
- 一种无定形铁锌复合氧化物光芬顿催化剂的制备方法与制造工艺
- 具有杂原子的过渡金属化合物、包含该化合物的催化剂组合物和使用该催化剂组合物的聚合物的制备方法与制造工艺
- 配体化合物、过渡金属化合物和包含该化合物的催化剂组合物的制造方法与工艺
- 烷烃氧化脱氢和/或烯烃氧化的制造方法与工艺
- 烷烃氧化脱氢和/或烯烃氧化的制造方法与工艺
- 一种碳/金属氧化物纳米纤维复合催化剂的制备方法与制造工艺
- 高氯酸铵内嵌的碳/金属氧化物复合催化剂及其制备方法与制造工艺
- 一种复合氧化物负载杂多酸催化合成尿囊素的方法与制造工艺
- 一种无定形铁锌复合氧化物光芬顿催化剂的制备方法与制造工艺
- 具有杂原子的过渡金属化合物、包含该化合物的催化剂组合物和使用该催化剂组合物的聚合物的制备方法与制造工艺
- 配体化合物、过渡金属化合物和包含该化合物的催化剂组合物的制造方法与工艺
- 一种碳/金属氧化物纳米纤维复合催化剂的制备方法与制造工艺
- 改性无机耐热氧化物及其制备方法及加氢脱硫催化剂和降低加氢脱硫催化剂失活速度的方法与制造工艺
- 一种用于莫来石陶瓷晶须制备的氧化物催化剂的制造方法与工艺
- 一种中空金属蜂窝式氧化催化器的制造方法
- 一种处理汽车尾气的三元金属氧化物催化剂制备方法