一种金纳米粒子表面荧光分子印迹聚合物的制备方法与流程
本发明涉及一种金纳米粒子表面荧光分子印迹聚合物的制备方法,属生物功能材料制备技术领域。
背景技术:
人血红蛋白(Hb),作为人体血液中的一种重要的组成成分,在人的日常生活中扮演着重要的角色。它主要将氧气分子从肺部运送到身体各处,并将身体各处组织产生的废气(如二氧化碳)运送到肺部排除体外。同时,人体中血红蛋白的含量能够反映人体病症的情况,例如:白血病、贫血以及心脏病等。因此,对于人体中血红蛋白的精确监测,能够反映人体中各个器官的活动情况。
目前,对于人体血红蛋白的传统检测方法有:电化学法、质谱法以及高效液相法等。这些方法都有着它们各自的优势之处,例如:高效液相法有着良好的重现性和较低的检出限,但是,它仍然存在着很多的不足之处,包括需要繁琐的样品前处理过程。例如在前处理的过程中,通常会造成二次污染而且操作过程相对复杂、成本费用较高。因此,针对人体中成分复杂、性质相似和含量偏低的血红蛋白,建立和完善快速、灵敏和选择性的分析检测方法是做好血红蛋白监控的当务之急。
近年来,分子印迹聚合物(MIPs)凭借着其构效预定性、特异识别性和广泛实用性等优异的特性,逐渐吸引了越来越多的科学工作者的青睐。首先,将模板分子加入到聚合基质中,模板分子和功能单体之间能够通过共价键和非共价键的作用连接在一起,聚合后将模板分子移除,从而形成一定的分子印迹识别位点。表面分子印迹技术则是通过把分子识别位点建立在基质材料的表面。因此,这种方法能够较好的解决传统分子印迹聚合物存在的一些严重缺陷,如机械性能差、活性位点包埋过深、模板分子的去除不彻底、吸附容量偏低和吸附-脱附的动力学性能不佳等。通过查阅文献发现,高大明等人于2007年,在JACS上发表的一篇文章“A Surface Functional Monomer-Directing Strategy for Highly Dense Imprinting of TNT at Surface of Silica Nanoparticles”(一种硅球表面功能化的单体指向性识别TNT的方法),该篇作者通过在硅球表面制备一种功能化的印迹聚合物,用来识别TNT,并取得了良好的实验结果。虽然表面印迹技术有诸多优点,但该方法仍然存在很多不足,例如:工作量较大,速度慢,灵敏度较低。因此,如何能够优化表面印迹技术还是一件亟待解决的问题。
在过去的十几年中,荧光检测技术凭借着灵敏的检测性能,已经在生物和化学领域受到了越来越广泛的关注。与传统的有机荧光素相比,荧光量子点及荧光纳米粒子具有较好的耐光性,较大的斯托克斯位移和荧光光谱窄且对称等性质,逐渐发展成为一类新型的具有广泛发展前景的发光生物标记材料。其中,由于金纳米粒子具有化学惰性和在生物体内的稳定性,从而成为生物研究的理想材料。同样,纳米尺度的金粒子对于生物细胞来说具有低毒性,并且在生物体内和临床生物相容性的研究中也取得了令人满意的结果,因此,金纳米粒子逐渐被应用于生物领域的研究。
因此,将高灵敏性的荧光检测与高选择性的分子印迹技术相结合用于对人血红蛋白的检测,利用荧光信号弥补分子印迹聚合物缺乏信号传导的缺陷,制备分子印迹荧光传感器,满足了传感器材对抗干扰、高选择、高灵敏等方面的需求,成为了当前传感、分离等领域的研究热点。表面分子印迹荧光传感器的制备使分子印迹技术在分析检测中的应用范围和使用方法得到进一步扩展,同时分子印迹聚合物的选择性也使复合型荧光探针的灵敏度和选择性得到显著提高。利用分子印迹表面荧光传感器进行光学分析,使得快速、方便检测残留量的研究成为必要。
技术实现要素:
本发明的目的是提供一种金纳米粒子表面荧光分子印迹聚合物的制备方法,首先,将正硅酸四乙酯(TEOS)加入到乙醇、水的混合溶剂中,搅拌均匀后加入氨水(NH3·H2O),待硅球生成后,加入3-氨基丙基三乙氧基硅烷(APTES)对生成的SiO2球进行表面氨基化处理,反应后,反复洗涤,离心分离,烘干备用;其次,将四氯金酸(HAuCl4)与谷胱甘肽(GSH)同时加入到去离子水中,充分搅拌,反应数小时,生成金纳米粒子,将合成的产物储存在4℃条件下,待用;然后,将合成的金纳米粒子与含有1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)的2-吗啉乙磺酸(MES)溶液相混合,搅拌条件下再滴加一定量的N-羟基琥珀酰亚胺(NHS),然后将其加入到含有SiO2球的MES溶液中,充分搅拌,使得金纳米粒子能够接到SiO2球的表面;最后,将制备的SiO2/Au纳米粒子分散在去离子水中,通过硅基印迹法,合成以人血红蛋白为模板分子,SiO2纳米球为载体,金纳米粒子为荧光物质,3-氨基丙基三乙氧基硅烷为功能单体的核壳型表面分子印迹聚合物,并用于光学检测人血红蛋白。制备的表面荧光分子印迹聚合物具有良好的光学性质,且对于人血红蛋白具有良好的选择性能。
本发明采用的技术方案如下:
一种金纳米粒子表面荧光分子印迹聚合物的制备方法,步骤如下:
步骤1、3-氨基丙基三乙氧基硅烷修饰的SiO2球的合成
在单口烧瓶中,加入体积比9:1的乙醇/水的混合溶剂,搅拌条件下,逐滴加入正硅酸四乙酯,充分搅拌后,加入氨水,搅拌1~3h后,逐滴加入3-氨基丙基三乙氧基硅烷,搅拌12~14h;随后,将合成的产物离心分离,洗涤,真空干燥待用;
步骤2、羧基修饰的金纳米粒子的合成
在单口烧瓶中,将浓度为20mmol/L的HAuCl4溶液分散在去离子水中,搅拌条件下,加入50mmol/L的谷胱甘肽溶液,升温至70~90℃,持续搅拌20~24h;将得到的羧基修饰的金纳米粒子分散液密封储存在4℃条件下,待用;
步骤3、SiO2/Au纳米粒子的合成
将步骤2得到的羧基修饰的金纳米粒子分散液加入到1mmol/L 2-吗啉乙磺酸溶液中,搅拌条件下,再加入1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐溶液,继续搅拌,再逐滴加入10mg/mL N-羟基琥珀酰亚胺溶液,随后静置,得到混合液A,待用;另将SiO2球分散在1mmol/L 2-吗啉乙磺酸溶液中,得到混合液B;搅拌条件下,将混合液A逐滴加入到混合液B中,随后将反应体系避光,继续搅拌12~14h;将产物离心分离,洗涤,随后分散在PBS缓冲溶液中,得到SiO2/Au纳米粒子分散液,待用;
步骤4、金纳米粒子表面荧光分子印迹聚合物的制备
在单口烧瓶中,依次加入SiO2/Au纳米粒子分散液、血红蛋白(Hb)、3-氨基丙基三乙氧基硅烷、正硅酸四乙酯、氨水,超声分散,将反应体系密封,将烧瓶至于磁力搅拌器上,常温搅拌12~14h;反应结束后,收集并洗涤产物,以除去未反应的物质,最终用曲拉通X-100洗涤,脱除模板分子,室温下真空干燥,得到金纳米粒子表面荧光分子印迹聚合物;最后,产物在真空烘箱中干燥,得到金纳米粒子表面荧光分子印迹聚合物,在干燥器中存储。
步骤1中,正硅酸四乙酯与乙醇/水的混合溶剂的体积比为1:16~20,正硅酸四乙酯与氨水的体积比为1:0.2~0.6,正硅酸四乙酯与3-氨基丙基三乙氧基硅烷的体积比为1:0.2~0.6;氨水的质量分数为28%,所述的洗涤为乙醇和水分别洗涤3次。
步骤2中,HAuCl4溶液与去离子水的体积比为1:6~10,HAuCl4溶液与谷胱甘肽溶液的体积比为1:0.6~1。
步骤3中,制备混合液A时,羧基修饰的金纳米粒子分散液与2-吗啉乙磺酸溶液的体积比为1:0.6~1,羧基修饰的金纳米粒子分散液与1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐溶液的体积比为1:0.01~0.014,羧基修饰的金纳米粒子分散液与NHS溶液的体积比为1:0.6~0.8;制备混合液B时,SiO2球与2-吗啉乙磺酸溶液的用量比为3~4mg:3mL,SiO2球与混合液A中的羧基修饰的金纳米粒子分散液的用量比为6~8mg:1mL;所述的洗涤为乙醇和水分别洗涤3次;所使用的PBS缓冲溶液与羧基修饰的金纳米粒子分散液的体积比为1:1,PBS缓冲溶液的pH为7.0,浓度为0.01M。
步骤4中,SiO2/Au纳米粒子分散液、血红蛋白、3-氨基丙基三乙氧基硅烷、正硅酸四乙酯和氨水的用量比为1mL:1mg:8μL:0.01~0.02μL:0.01~0.02μL;氨水的质量分数为28%,所述的洗涤为乙醇和水分别洗涤3次。
本发明对应的非印迹聚合物的制备方法类似合成方法如上,但不加Hb。
有益效果:
本发明将荧光检测技术与表面分子印迹技术相结合,使得制备的产物兼具灵敏的检测性质与特异性的选择性质;本发明将具有生物低毒性的金纳米粒子选作荧光检测物质,用于对人血红蛋白的检测,拓宽了荧光检测的应用范围;在本发明中,将具有荧光性质的金纳米粒子与硅基表面分子印迹技术相结合,使得聚合产物具有生物良好的生物兼容性,能够应用于对血红蛋白的检测。金纳米粒子近几年,逐渐成为了科学研究热点。金纳米粒子符合材料是获取材料新特性的一种有效手段,对于改善现有的荧光光学性质以及促进荧光传感器的发展,有着十分重要的意义。本发明预示着金纳米粒子在生物荧光传感器领域有着广阔的应用前景。
附图说明
图1为金纳米粒子表面荧光分子印迹聚合物的透射电镜图;
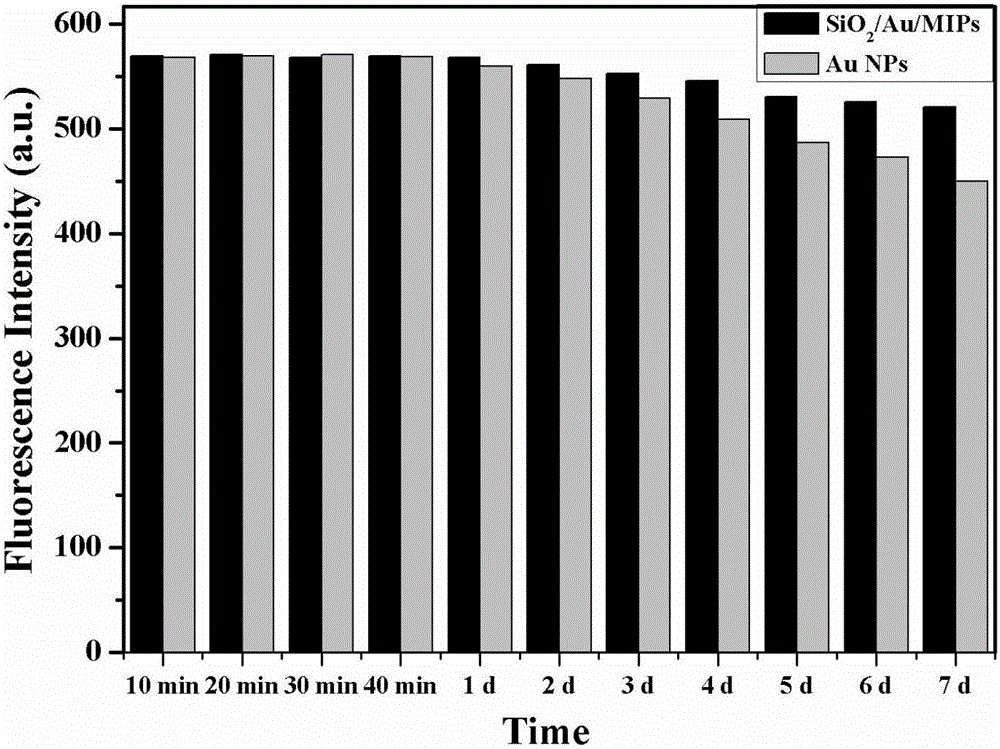
图2为金纳米粒子以及SiO2/Au/MIPs的荧光稳定性;
图3为不同浓度的Hb对金纳米粒子表面荧光分子印迹聚合物(左图)和非印迹聚合物(右图)荧光光谱的影响;
图4为不同浓度的Hb与金纳米粒子表面荧光分子印迹聚合物(左图)和非印迹聚合物(右图)作用后的相对荧光强度线性图;
图5为不同蛋白质类物质在同一浓度下对金纳米粒子表面荧光分子印迹聚合物和非印迹聚合物作用的相对荧光强度。
具体实施方式
下面结合具体实施实例对本发明做进一步说明。
实施例1:
(1)APTES修饰的SiO2球的合成:
在250mL三口烧瓶中,加入80mL乙醇、水混合溶剂(体积比9/1),搅拌条件下,加入5mL TEOS。充分搅拌后,加入1mL氨水,室温条件下持续搅拌1h。随后加入1mL APTES,继续搅拌12h。将产物离心分离,洗涤烘干,待用。
(2)羧基修饰的金纳米粒子的合成:
在100mL单口烧瓶中,将5mL浓度为20mmol/L的HAuCl4溶液分散在30mL去离子水中,充分搅拌后,加入3mL浓度为50mmol/L的GSH溶液,升温至70℃,持续搅拌20h。将合成的金纳米粒子密封储存在4℃条件下,待用。
(3)SiO2/Au纳米粒子的合成:
在100mL单口烧瓶中,加入6mL MES(1mmol/L),搅拌条件下,逐滴加入10mL羧基修饰的金纳米粒子分散液,充分搅拌后,加入100μLEDC,继续搅拌,逐滴加入6mL NHS(10mg/mL)溶液,随后静置;另取100mL单口烧瓶,加入60mL MES(1mmol/L),搅拌条件下,加入60mg APTES修饰的SiO2球,搅拌条件下,将含有金纳米粒子的MES溶液逐滴加入到SiO2的溶液中,随后将反应体系避光,继续搅拌12h。将产物离心分离,反复洗涤,随后分散在10mL PBS缓冲溶液中,待用。
(4)金纳米粒子表面荧光分子印迹聚合物的制备
在50mL单口烧瓶中,加入SiO2/Au纳米粒子的PBS分散液,充分搅拌后,依次加入10mg Hb,80μL APTES,100μL TEOS,充分搅拌后,加入100μL氨水,随后,将反应体系密封,然后置于磁力搅拌器上,常温搅拌12h,反应结束后,洗涤数次,以除去未反应完的物质,最终用曲拉通X-100反复洗涤,脱除模板分子,室温下真空干燥,得到金纳米粒子表面荧光分子印迹聚合物。最后,产物在真空烘箱中干燥,得到金纳米粒子表面荧光分子印迹聚合物,记为SiO2/Au/MIPs,并在干燥器中存储。
步骤(1)中所述的反应体系中,TEOS与混合溶剂的体积比为5mL:80mL,TEOS与氨水的体积比为5mL:1mL,TEOS与APTES的体积比为5mL:1mL。步骤中所述的洗涤,为乙醇和水分别洗涤3次。
步骤(2)中所述的反应体系中,HAuCl4溶液与溶剂水的体积比为5mL:30mL,HAuCl4溶液与GSH溶液的体积比为5mL:3mL。
步骤(3)中所述的反应体系中,羧基修饰的金纳米粒子分散液与MES溶液的体积比为10mL:6mL,羧基修饰的金纳米粒子分散液与EDC溶液的体积比为10mL:100μL,羧基修饰的金纳米粒子分散液与NHS溶液的体积比为10mL:6mL,羧基修饰的金纳米粒子分散液与SiO2球的体积质量比为10mL:60mg,SiO2球与MES溶液的质量体积比为60mg:60mL。步骤中所述的洗涤,为乙醇和水分别洗涤3次。
步骤(4)所述的反应体系中,SiO2/Au纳米粒子分散液的体积为10mL,Hb、APTES与TEOS的质量体积比为10mg:80μL:100μL,氨水的体积为100μL。步骤中所述的洗涤,为乙醇和水分别洗涤3次。
本发明对应的非印迹聚合物的制备方法类似合成方法如上,但不加Hb。
实施例2:
(1)APTES修饰的SiO2球的合成:
在250mL三口烧瓶中,加入100mL乙醇、水混合溶剂(体积比9/1),搅拌条件下,加入5mL TEOS。充分搅拌后,加入3mL氨水,室温条件下持续搅拌1h。随后加入3mL APTES,继续搅拌14h。将产物离心分离,洗涤烘干,待用。
(2)羧基修饰的金纳米粒子的合成:
在100mL单口烧瓶中,将5mL浓度为20mmol/L的HAuCl4溶液分散在50mL去离子水中,充分搅拌后,加入5mL浓度为50mmol/L的GSH溶液,升温至90℃,持续搅拌24h。将合成的金纳米粒子密封储存在4℃条件下,待用。
(3)SiO2/Au纳米粒子的合成:
在100mL单口烧瓶中,加入10mL MES(1mmol/L),搅拌条件下,逐滴加入10mL羧基修饰的金纳米粒子分散液,充分搅拌后,加入140μLEDC,继续搅拌,逐滴加入8mL NHS(10mg/mL)溶液,随后静置;另取100mL单口烧瓶,加入60mL MES(1mmol/L),搅拌条件下,加入80mg APTES修饰的SiO2球,搅拌条件下,将含有金纳米粒子的MES溶液逐滴加入到SiO2的溶液中,随后将反应体系避光,继续搅拌14h。将产物离心分离,反复洗涤,随后分散在10mL PBS缓冲溶液中,待用。
(4)金纳米粒子表面荧光分子印迹聚合物的制备
在50mL单口烧瓶中,加入SiO2/Au纳米粒子的PBS分散液,充分搅拌后,依次加入10mg Hb,80μL APTES,200μL TEOS,充分搅拌后,加入200μL氨水,随后,将反应体系密封,然后置于磁力搅拌器上,常温搅拌14h,反应结束后,洗涤数次,以除去未反应完的物质,最终用曲拉通X-100反复洗涤,脱除模板分子,室温下真空干燥,得到金纳米粒子表面荧光分子印迹聚合物。最后,产物在真空烘箱中干燥,得到金纳米粒子表面荧光分子印迹聚合物,记为SiO2/Au/MIPs,并在干燥器中存储。
步骤(1)中所述的反应体系中,TEOS与混合溶剂的体积比为5mL:100mL,TEOS与氨水的体积比为5mL:3mL,TEOS与APTES的体积比为5mL:3mL。步骤中所述的洗涤,为乙醇和水分别洗涤3次。
步骤(2)中所述的反应体系中,HAuCl4溶液与溶剂水的体积比为5mL:50mL,HAuCl4溶液与GSH溶液的体积比为5mL:5mL。
步骤(3)中所述的反应体系中,羧基修饰的金纳米粒子分散液与MES溶液的体积比为10mL:10mL,羧基修饰的金纳米粒子分散液与EDC溶液的体积比为10mL:140μL,羧基修饰的金纳米粒子分散液与NHS溶液的体积比为10mL:10mL,羧基修饰的金纳米粒子分散液与SiO2球的体积质量比为10mL:80mg,SiO2球与MES溶液的质量体积比为80mg:60mL。步骤中所述的洗涤,为乙醇和水分别洗涤3次。
步骤(4)所述的反应体系中,SiO2/Au纳米粒子分散液的体积为10mL,Hb、APTES与TEOS的质量体积比为10mg:80μL:200μL,氨水的体积为200μL。步骤中所述的洗涤,为乙醇和水分别洗涤3次。
本发明对应的非印迹聚合物的制备方法类似合成方法如上,但不加Hb。
实施例3:
(1)APTES修饰的SiO2球的合成:
在250mL三口烧瓶中,加入90mL乙醇、水混合溶剂(体积比9/1),搅拌条件下,加入5mL TEOS。充分搅拌后,加入2mL氨水,室温条件下持续搅拌1h。随后加入2mL APTES,继续搅拌13h。将产物离心分离,洗涤烘干,待用。
(2)羧基修饰的金纳米粒子的合成:
在100mL单口烧瓶中,将5mL浓度为20mmol/L的HAuCl4溶液分散在40mL去离子水中,充分搅拌后,加入4mL浓度为50mmol/L的GSH溶液,升温至80℃,持续搅拌22h。将合成的金纳米粒子密封储存在4℃条件下,待用。
(3)SiO2/Au纳米粒子的合成:
在100mL单口烧瓶中,加入8mL MES(1mmol/L),搅拌条件下,逐滴加入10mL羧基修饰的金纳米粒子分散液,充分搅拌后,加入120μL EDC,继续搅拌,逐滴加入7mL NHS(10mg/mL)溶液,随后静置;另取100mL单口烧瓶,加入60mL MES(1mmol/L),搅拌条件下,加入70mg APTES修饰的SiO2球,搅拌条件下,将含有金纳米粒子的MES溶液逐滴加入到SiO2的溶液中,随后将反应体系避光,继续搅拌13h。将产物离心分离,反复洗涤,随后分散在10mL PBS缓冲溶液中,待用。
(4)金纳米粒子表面荧光分子印迹聚合物的制备
在50mL单口烧瓶中,加入SiO2/Au纳米粒子的PBS分散液,充分搅拌后,依次加入10mg Hb,80μL APTES,150μL TEOS,充分搅拌后,加入150μL氨水,随后,将反应体系密封,然后置于磁力搅拌器上,常温搅拌13h,反应结束后,洗涤数次,以除去未反应完的物质,最终用曲拉通X-100反复洗涤,脱除模板分子,室温下真空干燥,得到金纳米粒子表面荧光分子印迹聚合物。最后,产物在真空烘箱中干燥,得到金纳米粒子表面荧光分子印迹聚合物,记为SiO2/Au/MIPs,并在干燥器中存储。
步骤(1)中所述的反应体系中,TEOS与混合溶剂的体积比为5mL:90mL,TEOS与氨水的体积比为5mL:2mL,TEOS与APTES的体积比为5mL:2mL。步骤中所述的洗涤,为乙醇和水分别洗涤3次。
步骤(2)中所述的反应体系中,HAuCl4溶液与溶剂水的体积比为5mL:40mL,HAuCl4溶液与GSH溶液的体积比为5mL:4mL。
步骤(3)中所述的反应体系中,羧基修饰的金纳米粒子分散液与MES溶液的体积比为10mL:8mL,羧基修饰的金纳米粒子分散液与EDC溶液的体积比为10mL:120μL,羧基修饰的金纳米粒子分散液与NHS溶液的体积比为10mL:8mL,羧基修饰的金纳米粒子分散液与SiO2球的体积质量比为10mL:70mg,SiO2球与MES溶液的质量体积比为70mg:60mL。步骤中所述的洗涤,为乙醇和水分别洗涤3次。
步骤(4)所述的反应体系中,SiO2/Au纳米粒子分散液的体积为10mL,Hb、APTES与TEOS的质量体积比为10mg:80μL:150μL,氨水的体积为150μL。步骤中所述的洗涤,为乙醇和水分别洗涤3次。
本发明所使用的氨水的质量分数均为28%,PBS缓冲溶液的pH均为7.0,浓度为均0.01M。
本发明对应的非印迹聚合物的制备方法类似合成方法如上,但不加Hb。
本发明所制备的材料的透射电镜图如图1,由图1中可以看出,该印迹聚合物形貌明显,已经成功合成,聚合物尺寸为200~300nm,且分散性良好。
本发明具体实施方式中识别和光学检测性能评价按照下述方法进行:将适量金纳米粒子表面荧光分子印迹聚合物的水溶液和一系列已知浓度的目标物溶液加入到10mL比色管中。用分子荧光光度计测量系统检测溶液的荧光强度。根据Stern-Volmer equation(F0/F=1+Ksv[c])以浓度[c]为横坐标,相对荧光强度(F0/F)为纵坐标绘制荧光响应曲线。选择几种蛋白质类物质,作为对比物质,参与表面荧光分子印迹聚合物识别性能的研究。
试验例1:首先考察了聚合物的荧光时间稳定性(如图2所示,所制得的金纳米粒子荧光分子印迹聚合物在制备后的7天之间内,荧光强度基本稳定,且SiO2/Au/MIPs的荧光稳定性要优于纯的金纳米粒子)。将荧光分子印迹材料配置成100mg/L的水溶液,蛋白质类目标物配置成为0.1mmol/L的水溶液。取3.3mL聚合物溶液和0-2mL目标物人血红蛋白溶液加入到比色管中,并用PBS缓冲溶液定容至10mL,然后用荧光分光光度计检测溶液的荧光强度。根据Stern-Volmer equation(F0/F=1+Ksv[c])以浓度[c]为横坐标,相对荧光强度(F0/F)为纵坐标绘制荧光响应曲线。如图3所示,随着人血红蛋白浓度的升高,荧光强度减弱,根据Stern-Volmer equation(F0/F=1+Ksv[c])以浓度[c]为横坐标,相对荧光强度(F0/F)为纵坐标绘制荧光响应曲线,分别得到相关系数为0.9995和0.9943的直线(如图4所示)。结果表明,金纳米粒子表面荧光分子印迹聚合物具有很好的光学检测人血红蛋白的能力。
试验例2:选择牛血清蛋白(BSA)、牛血红蛋白(BHb)和鸡蛋白蛋白(ACE)三种目标物,分别配置以上几种蛋白质类物质0.1mmol/L水溶液。取3.3mL配置好的聚合物的水溶液和2mL酚类物质的水溶液加入到比色管中,并用PBS缓冲溶液定容,室温下振荡后,用荧光分光光度计检测溶液的荧光强度。由图5为不同蛋白质类物质在同一浓度下(10μmol/L)对金纳米粒子表面荧光分子印迹聚合物和非印迹聚合物作用的相对荧光强度,由图5可知,人血红蛋白对荧光分子印迹聚合物的猝灭量最大,说明荧光分子印迹聚合物对模板分子人血红蛋白具有特异性识别能力。结果表明,本发明制备的荧光分子印迹聚合物对人血红蛋白有明显的专一识别性,猝灭效果高于其它蛋白质类物质。
- 还没有人留言评论。精彩留言会获得点赞!