一种从混合气中分离乙烯和乙炔的方法与流程
本发明涉及吸附材料以及能源的技术领域,尤其涉及一种金属有机框架材料的制备方法及其在烯烃炔烃分离方面的应用。
背景技术:
乙烯一直有着“石化工业之母”之称,是化工行业最重要的基础原料之一,其生产能力被认为是一个国家经济实力的体现。目前,乙烯被广泛应用于润滑油、塑料、聚合物及其他化工材料的生产中,一般通过石油、天然气和多碳的碳氢化合物裂解获得,但是裂解产物往往成分复杂,经常夹带不同碳数的烷烃、单烯烃、二烯烃、炔烃、二炔烃等,在工业生产中又往往需要高纯度的聚合级乙烯。比如在生产聚乙烯的工艺流程中,乙烯中残留的微量乙炔会致使催化剂失活,甚至乙炔还会跟金属反应生成金属炔化物堵塞管道引发爆炸。
工业上还常用部分氢化法对乙炔进行选择性加氢以去除乙烯中残留的乙炔(如cn102898266a、cn104689816),但是该方法通常以pd等贵金属为有效催化成分,价格昂贵,并且会有部分乙烯被加氢转化为附加值很低的乙烷,导致乙烯产量下降。
现阶段,工业上能有效分离乙烯乙炔的方法相对较少,主要有深冷法、溶剂吸收法和吸附法等。深冷法利用混合气中各组分挥发性的不同,在低温条件下将混合气的各组分冷凝下来,然后用精馏手段将各组分逐一分离。例如,美国mobil公司和airproducts公司研究开发的深冷分离工艺在投入工业化后使液化催化裂化工艺中的乙烯收率达到了90%~98%,但其巨大的能耗和对中小规模设备的不友好限制了它的普及和运用。溶剂吸收法是利用吸收剂对混合气中各组分溶解度不同从而对各组分进行分离的技术,但吸收法对溶剂的消耗量大,一般多使用挥发性溶剂,例如二甲基甲酰胺、n-甲基吡咯烷酮、乙酸乙酯、丙酮等,对环境危害大,并且操作压力高,能耗大。
因此,目前仍亟需一种更加经济节能的分离手段来纯化分离乙烯乙炔。相比,吸附分离法具有操作简便、能耗小、成本低等特点,但乙烯乙炔的吸附分离最关键的是选择具有较高吸附量和较大吸附选择性的吸附剂。常用的吸附剂包括活性炭、硅胶、分子筛、氧化铝、树脂等。yang等研究了负载nicl2的多孔沸石对乙烯乙炔的分离(ind.eng.chem.res.,2000,39:3108);lewis等报道了活性炭和硅胶对乙烯乙炔的选择性吸附(j.am.chem.soc.,1950,72,1157.),但是效果都不佳,并不能达到工业应用水平。
金属有机框架材料具有极高的比表面积和孔容,并且通过改变金属离子和配体种类,以及合成条件能够得到具有不同孔道形状和孔径大小的多孔结构,其在气体分离领域具有十分广阔的应用前景。然而,大多数金属有机框架材料的稳定性较差且制备成本较高,不仅配体价格普遍较贵,而且材料合成过程需要在n,n-二甲基甲酰胺或者n,n-二甲基乙酰胺等有机溶剂中,材料后续的纯化过程产生大量的有机废液。如何低成本制备得到良好稳定性、高乙炔吸附量以及乙炔/乙烯吸附分离选择性的金属有机框架材料是一个十分具有挑战性的技术难题。
技术实现要素:
为克服现有技术存在的问题,本发明提供一种从混合气中分离乙烯和乙炔的方法。
一种从混合气中分离乙烯和乙炔的方法,包括如下步骤:以金属有机框架材料为吸附剂,从含乙烯和乙炔的混合气中分离乙烯和乙炔;
所述金属有机框架材料结构通式为m(c7o5h4)·2h2o,式子中m为金属离子,由过渡金属离子或碱土金属离子与没食子酸通过配位键或者分子间作用力形成的三维网络结构。
本发明的吸附分离过程简单,将一定压力下的混合气,通过装填有该吸附剂的吸附塔或者吸附柱即可,进一步地,吸附塔也可以由一个或多个组成,采用现有的变压吸附或者真空变压吸附或者变温吸附实现分离。
吸附分离的原理:该类金属有机框架材料孔道为三角形,孔道尺寸在3.3~3.5埃,分子直径较小的乙炔能更快进入孔道且与材料孔表面的功能基团发生强烈的相互作用,而分子直径较大的乙烯则较难进入孔道且相互作用也较弱。热力学和动力学两方面因素使得两个气体在材料表面的吸附量有显著差异,在混合气通过吸附塔时,乙烯的作用弱且吸附容量小,最先从塔出口流出,而乙炔的作用强且吸附容量大,从塔出口流出所需的时间更长,从而实现乙炔乙烯的分离。
优选地,所述金属由机框架材料有如下方法制备:
(1)将无机盐、没食子酸、碱、去离子水按比例混合,搅拌溶解后,投入反应釜中进行水热反应;所述无机盐为金属离子的氯化盐、硝酸盐、乙酸盐、碳酸盐、硫酸盐或高氯酸盐
(2)水热反应结束后,依次用去离子水、无水乙醇洗涤,然后真空干燥即得。
该金属有机框架材料的制备过程中是以价廉易得的没食子酸为有机配体,与一系列金属无机盐在纯水中进行反应,无需使用有毒、易挥发的有机溶剂,制备材料的原料价格低、合成条件温和、操作简单、后处理容易、材料合成成本低。本发明的方法中,金属有机框架材料对乙烯和乙炔有很高的吸附分离选择性,且材料结构和吸附性能稳定,耐水性好,具有良好的工业化应用前景。
本发明所采用的吸附剂吸附饱和后只需在真空或氦气及氮气等惰性氛条件下加热至50~150℃,保持2~10小时即可实现再生。温度过高或者时间过长会导致吸附剂结构破坏;温度过低或者时间过短,吸附剂内残留的吸附质将无法全部脱除。
本发明中上述优选方法制备的吸附剂结构性能稳定,颗粒形状规则,对烃类吸附分离有着较高的选择性和吸附量。
进一步优选地,所述碱为氢氧化钾或氢氧化钠。
进一步优选地,所述金属离子为锌、铁、钴、镍、铜、镁或锰离子。
进一步优选地,所述无机盐、没食子酸和碱的摩尔比为1:(1~5):(0.1~5)。去离子水作为溶剂。进一步优选,所述无机盐、没食子酸和碱的摩尔比为1:(1.5~2.5):(0.5~3)。
进一步优选地,当金属盐为镁盐时,所述的金属盐、没食子酸、碱的摩尔比为1:(1.5~2.5):(2~3),最优选为1:2:2.5;当金属盐为铁盐、锰盐时,所述的金属盐、没食子酸、碱的摩尔比为1:(1.5~2.5):(1~1.5),最优选为1:2:1.2;当金属盐为钴盐、镍盐时,所述的金属盐、没食子酸、碱的摩尔比为1:(1.5~2.5):(0.5~1),最优选为1:2:0.8;当金属盐为锌盐、铜盐时,所述的金属盐、没食子酸、碱的摩尔比为1:(1.5~2.5):(0.5~1.5),最优选为1:2:1;改变金属盐,没食子酸和碱的配比会改变晶体的大小、晶型,规整度等,同时还会影响该材料对烃类气体的吸附量和选择性分离性能。
所述的搅拌步骤为:在500~1000转/分钟下搅拌适当时间将溶液混合均匀。混合不均匀会导致反应得到的晶体晶型不规整。
进一步优选地,所述水热反应的反应温度为60~150℃,反应时间为12~72小时。反应温度影响晶体的生成,过高或过低都会导致无法生成晶体。
进一步优选地,真空干燥的温度为30~120℃、时间为6~24小时。
水热反应后的产品经水洗涤离心若干次,置换掉孔道内残留的碱溶液和残留的无机盐,再用无水乙醇洗涤离心若干次,置换掉孔道内残留的有机配体和水,完成对吸附剂的纯化。
优选地,所述吸附分离的温度为-5~50℃,混合气的总压为100~1000kpa;进一步优选地,吸附分离的温度为20~50℃,混合气的总压为100~400kpa;最优选地,吸附分离的温度为25℃,混合气的总压为100kpa。
优选地,所述混合气通过吸附剂的流速为1~10cm/min。
优选地,所述混合气不仅限于含有乙烯和乙炔,也可以含有其它如二氧化碳、甲烷、氮气、乙烷、丙烯和丙烷等气体。本发明的原料气组成范围很宽,各种浓度都可以适用,可以从50ppm到65%。
本发明所用金属有机框架材料可以通过不同的加工工艺制备成球形、柱状、颗粒等吸附分离材料或按照现有常规技术制成膜材料用于乙烯乙炔的膜分离。
与现有技术相比,本发明具有以下优点:
本发明所涉及的金属有机框架材料制备所用的没食子酸和金属盐均廉价易得,合成条件温和,纯化步骤简单,易于操作和放大。本发明所涉及的金属有机框架材料结构稳定,性能稳定,对乙炔具有较高的吸附量,同时对乙烯/乙炔具有非常高的吸附选择性,并且多次反复吸附-再生后,吸附性能仍然保持原有效果。在乙烯/乙炔的吸附分离方面,本发明制备的吸附剂远优于绝大多数固体吸附剂。
附图说明
图1为实施例1~7制备的金属有机框架材料的sem图
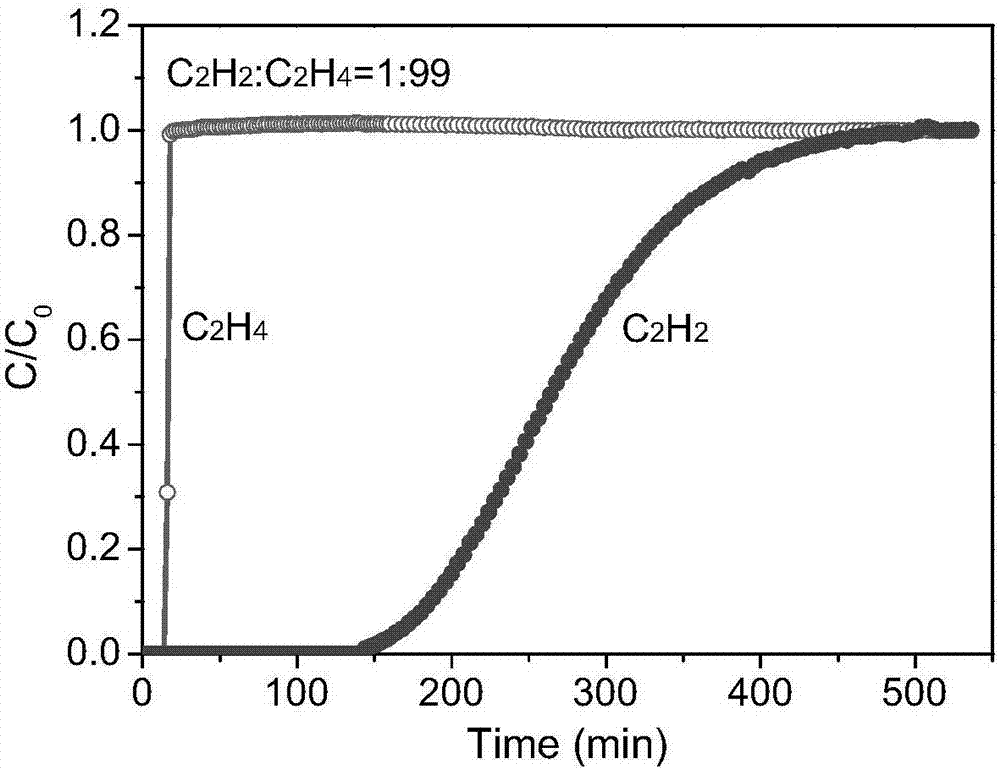
图2和图3为实施例1中的乙烯乙炔混合气体的穿透曲线图
图4和图5为实施例2中的乙烯乙炔混合气体的穿透曲线图
图6和图7为实施例3中的乙烯乙炔混合气体的穿透曲线图
具体实施方式
下面的实施实例对本发明作进一步的说明,但本发明的内容完全不局限于这些实例
以下实施例中所用原料均为普通的市售产品。
实施例1
将2mmol无水氯化镁、4mmol没食子酸、5mmol氢氧化钾、10ml去离子水混合,放入25ml水热反应釜中,搅拌30分钟,然后加热至120℃下反应24小时。反应完成后,待反应釜冷却,反应所得固体依次用水洗涤和乙醇洗涤多次得到纯化后的金属有机框架材料。将纯化后的吸附剂在120℃真空脱气24小时得到去溶剂的吸附剂,随后进行气体吸附。
为了测试上述合成的金属有机框架材料的吸附分离性能,使用上述吸附剂进行了乙烯乙炔的单组份吸附等温线。取适量吸附剂,吸附温度为25度。经测试,在25℃和1bar时,乙炔的吸附量高达4.41mmol/g,乙烯的吸附量仅为2.61mmol/g,经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为37和54。
为了测试样品的稳定性,将样品暴露在相对湿度为60%的空气中7天后再进行乙烯乙炔单组份等温线的测定。乙炔的吸附量为4.40mmol/g,乙烯吸附量为2.60mmol/g。经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为37和53。
为了测试该类金属有机框架材料对烃类分离的实际效果,使用上述合成的吸附剂进行了乙烯乙炔混合气体的穿透实验。本实施例中吸附分离的是乙炔乙烯混合气体,体积比为1:99和50:50,穿透温度为25℃,压强为0.1mpa。穿透曲线见附图2和图3。经测试,乙炔/乙烯体积比为1:99,混合气体流速为1.14ml/min时,乙烯在16分钟穿透,18分钟穿透完全;乙炔在146分钟穿透,500分钟穿透完全。乙炔的动态饱和吸附量为0.38mmol/g。乙炔/乙烯体积比为50:50,混合气体流速为0.67ml/min时,乙烯在18分钟穿透,乙炔在65分钟才开始穿透,乙炔的动态吸附量为2.91mmol/g。两种混合气体得到了有效的分离。该金属有机框架材料经5次吸附-再生循环,吸附性能仍然稳定。
实施例2
将2mmol六水氯化钴、4mmol没食子酸、1.6mmol氢氧化钾、10ml去离子水混合,放入25ml水热反应釜中,搅拌30分钟后于120℃下反应24小时。反应完成后,待其冷却,依次用水和乙醇洗涤3次得到纯化后的金属有机框架材料。将纯化后的吸附剂在120℃真空脱气24小时得到去溶剂的吸附剂,随后进行气体吸附。
为了测试上述合成的金属有机框架材料的吸附分离性能,使用上述吸附剂进行了乙烯乙炔的单组份吸附等温线。取适量吸附剂,吸附温度为25度。经测试,在25℃和1bar时,乙炔的吸附量高达3.78mmol/g,乙烯的吸附量仅为2.87mmol/g,经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为23和27。
为了测试样品的稳定性,将样品暴露在相对湿度为60%的空气中7天后再进行乙烯乙炔单组份等温线的测定。乙炔的吸附量为3.76mmol/g,乙烯吸附量为2.85mmol/g。经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为22和25。
为了测试该类金属有机框架材料对烃类分离的实际效果,使用上述合成的吸附剂进行了乙烯乙炔混合气体的穿透实验。本实施例中吸附分离的是乙炔乙烯混合气体,体积比为1:99和50:50,穿透温度为25℃,压强为0.1mpa。穿透曲线见附图4和图5。经测试,乙炔/乙烯体积比为1:99,混合气体流速为1.17ml/min时,乙烯在20分钟穿透,22分钟穿透完全;乙炔在144分钟穿透,480分钟穿透完全。乙炔的动态饱和吸附量为0.24mmol/g。乙炔/乙烯体积比为50:50,混合气体流速为0.59ml/min时,乙烯在28分钟穿透,乙炔在58分钟才开始穿透,乙炔的动态吸附量为1.54mmol/g。两种混合气体得到了有效的分离。该金属有机框架材料经5次吸附-再生循环,吸附性能仍然稳定。
实施例3
将2mmol六水氯化镍、4mmol没食子酸、1.6mmol氢氧化钾、10ml去离子水混合,放入25ml水热反应釜中,搅拌30分钟后于120℃下反应24小时。反应完成后,待反应釜冷却,依次用水和乙醇洗涤3次得到纯化后的金属有机框架材料。将纯化后的吸附剂在120℃真空脱气24小时得到去溶剂的吸附剂,随后进行气体吸附。
为了测试上述合成的金属有机框架材料的吸附分离性能,使用上述吸附剂进行了乙烯乙炔的单组份吸附等温线。取适量吸附剂,吸附温度为25度。经测试,在25℃和1bar时,乙炔的吸附量高达3.01mmol/g,乙烯的吸附量仅为1.83mmol/g,经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为31和32。
为了测试样品的稳定性,将样品暴露在相对湿度为60%的空气中7天后再进行乙烯乙炔单组份等温线的测定。乙炔的吸附量为2.99mmol/g,乙烯吸附量为1.82mmol/g。经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为30和40。
为了测试该类金属有机框架材料对烃类分离的实际效果,使用上述合成的吸附剂进行了乙烯乙炔混合气体的穿透实验。本实施例中吸附分离的是乙炔乙烯混合气体,体积比为1:99和50:50,穿透实验温度为25℃,压强为0.1mpa。穿透曲线见附图6和图7。经测试,乙炔/乙烯体积比为1:99,混合气体流速为1.17ml/min时,乙烯在16分钟穿透,18分钟穿透完全;乙炔在248分钟穿透,548分钟穿透完全。乙炔的动态饱和吸附量为0.23mmol/g。乙炔/乙烯体积比为50:50,混合气体流速为0.60ml/min时,乙烯在26分钟穿透,乙炔在60分钟才开始穿透,乙炔的动态吸附量为0.95mmol/g。两种混合气体得到了有效的分离。该金属有机框架材料经5次吸附-再生循环,吸附性能仍然稳定。
实施例4
将2mmol无水氯化锰、4mmol没食子酸、2.4mmol氢氧化钾、10ml去离子水混合,放入25ml水热反应釜中,搅拌30分钟后在120℃下反应24小时。反应完成后,待其冷却,依次用水洗涤一次,用乙醇洗涤3次得到纯化后的金属有机框架材料。将纯化后的吸附剂在120℃真空脱气24小时得到去溶剂的吸附剂,随后进行气体吸附。
为了测试上述合成的金属有机框架材料的吸附分离性能,使用上述吸附剂进行了乙烯乙炔的单组份吸附等温线。取100mg吸附剂,设定吸附温度25度。经测试,在25℃和1bar时,乙炔的吸附量高达3.56mmol/g,乙烯的吸附量仅为2.37mmol/g,经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为39和34。
为了测试样品的稳定性,将样品暴露在相对湿度为60%的空气中7天后再进行乙烯乙炔单组份等温线的测定。乙炔的吸附量为3.52mmol/g,;乙烯吸附量为2.35mmol/g。经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为38和34。
为了测试该类金属有机框架材料对烃类分离的实际效果,使用上述合成的吸附剂进行了乙烯乙炔混合气体的穿透实验。本实施例中吸附分离的是乙炔乙烯混合气体,体积比为1:99和50:50,穿透温度为25℃,压强为0.1mpa。经测试,乙炔/乙烯体积比为1:99,混合气体流速为1.15ml/min时,乙烯在20分钟穿透,24分钟穿透完全;乙炔在218分钟穿透,512分钟穿透完全。乙炔的动态饱和吸附量为0.22mmol/g。乙炔/乙烯体积比为50:50,混合气体流速为0.60ml/min时,乙烯在22分钟穿透,乙炔在64分钟才开始穿透,乙炔的动态吸附量为2.1mmol/g。两种混合气体得到了有效的分离。该金属有机框架材料经5次吸附-再生循环,吸附性能仍然稳定。
实施例5
将2mmol无水氯化亚铁、4mmol没食子酸、2.4mmol氢氧化钾,10ml去离子水混合,放入25ml水热反应釜中,搅拌30分钟后于120℃下反应24小时。反应完成后,待其冷却,依次用水、乙醇洗涤3次得到纯化后的金属有机框架材料。将纯化后的吸附剂在120℃真空脱气24小时得到去溶剂的吸附剂,随后进行气体吸附。
为了测试上述合成的金属有机框架材料的吸附分离性能,使用上述吸附剂进行了乙烯乙炔的单组份吸附等温线。取100mg吸附剂,设定吸附温度25度。经测试,在25℃和1bar时,乙炔的吸附量高达4.00mmol/g,乙烯的吸附量仅为2.72mmol/g,经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为30和33。
为了测试样品的稳定性,将样品暴露在相对湿度为60%的空气中7天后再进行乙烯乙炔单组份等温线的测定。乙炔的吸附量为3.96mmol/g,乙烯吸附量为2.72mmol/g。经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为30和32。
为了测试该类金属有机框架材料对烃类分离的实际效果,使用上述合成的吸附剂进行了乙烯乙炔混合气体的穿透实验。本实施例中吸附分离的是乙炔乙烯混合气体,体积比为1:99和50:50,穿透温度为25℃,压强为0.1mpa。经测试,乙炔/乙烯体积比为1:99,混合气体流速为1.15ml/min时,乙烯在22分钟穿透,24分钟穿透完全;乙炔在148分钟穿透,500分钟穿透完全。乙炔的动态饱和吸附量为0.26mmol/g。乙炔/乙烯体积比为50:50,混合气体流速为0.60ml/min时,乙烯在22分钟穿透,乙炔在60分钟才开始穿透,乙炔的动态吸附量为1.5mmol/g。两种混合气体得到了有效的分离。该金属有机框架材料经5次吸附-再生循环,吸附性能仍然稳定。
实施例6
将2mmol无水氯化锌、4mmol没食子酸、2mmol氢氧化钾、10ml去离子水混合,放入25ml水热反应釜中,搅拌30分钟后于120℃下反应24小时。反应完成后,待反应釜冷却,依次用水和乙醇洗涤3次得到纯化后的金属有机框架材料。将纯化后的吸附剂在120℃真空脱气24小时得到去溶剂的吸附剂,随后进行气体吸附。
为了测试上述合成的金属有机框架材料的吸附分离性能,使用上述吸附剂进行了乙烯乙炔的单组份吸附等温线。取100mg吸附剂,设定吸附温度25度。经测试,在25℃和1bar时,乙炔的吸附量高达4.11mmol/g,乙烯的吸附量仅为2.32mmol/g,经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为29和36。
为了测试样品的稳定性,将样品暴露在相对湿度为60%的空气中7天后再进行乙烯乙炔单组份等温线的测定。乙炔的吸附量为4.11mmol/g,乙烯吸附量为2.32mmol/g。经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为30和37。
为了测试该类金属有机框架材料对烃类分离的实际效果,使用上述合成的吸附剂进行了乙烯乙炔混合气体的穿透实验。本实施例中吸附分离的是乙炔乙烯混合气体,体积比为1:99和50:50,穿透温度为25℃,压强为0.1mpa。经测试,乙炔/乙烯体积比为1:99,混合气体流速为1.14ml/min时,乙烯在20分钟穿透,24分钟穿透完全;乙炔在139分钟穿透,480分钟穿透完全。乙炔的动态饱和吸附量为0.34mmol/g。乙炔/乙烯体积比为50:50,混合气体流速为0.60ml/min时,乙烯在24分钟穿透,乙炔在68分钟才开始穿透,乙炔的动态吸附量为1.9mmol/g。两种混合气体得到了有效的分离。该金属有机框架材料经5次吸附-再生循环,吸附性能仍然稳定。
实施例7
将2mmol二水氯化铜、4mmol没食子酸、2mmol氢氧化钾、10ml去离子水混合,放入25ml水热反应釜中,搅拌30分钟后于120℃下反应24小时。反应完成后,待反应釜冷却,依次用水和乙醇洗涤3次得到纯化后的金属有机框架材料。将纯化后的吸附剂在120℃真空脱气24小时得到去溶剂的吸附剂,随后进行气体吸附。
为了测试上述合成的金属有机框架材料的吸附分离性能,使用上述吸附剂进行了乙烯乙炔的单组份吸附等温线。取100mg吸附剂,设定吸附温度25度。经测试,在25℃和1bar时,乙炔的吸附量高达4.25mmol/g,乙烯的吸附量仅为2.91mmol/g,经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为36和36。
为了测试样品的稳定性,将样品暴露在相对湿度为60%的空气中7天后再进行乙烯乙炔单组份等温线的测定。乙炔的吸附量为4.23mmol/g,乙烯吸附量为2.90mmol/g。经iast计算,乙炔/乙烯体积比为1:99和50:50时,1bar下该吸附剂对两种气体的吸附选择性分别为36和35。
为了测试该类金属有机框架材料对烃类分离的实际效果,使用上述合成的吸附剂进行了乙烯乙炔混合气体的穿透实验。本实施例中吸附分离的是乙炔乙烯混合气体,体积比为1:99和50:50,穿透温度为25℃,压强为0.1mpa。经测试,乙炔/乙烯体积比为1:99,混合气体流速为1.14ml/min时,乙烯在22分钟穿透,24分钟穿透完全;乙炔在160分钟穿透,498分钟穿透完全。乙炔的动态饱和吸附量为0.22mmol/g。乙炔/乙烯体积比为50:50,混合气体流速为0.56ml/min时,乙烯在26分钟穿透,乙炔在60分钟才开始穿透,乙炔的动态吸附量为1.52mmol/g。两种混合气体得到了有效的分离。该金属有机框架材料经5次吸附-再生循环,吸附性能仍然稳定。
以上实施例中所用吸附剂的sem图如图1所示。
- 还没有人留言评论。精彩留言会获得点赞!